СВАРКА разнородных металлов и сплавов
СВАРИВАЕМОСТЬ РАЗНОРОДНЫХ МЕТАЛЛОВ
Возможность соединения разнородных металлов с образованием прочных связей определяется прежде всего физико-химическими свойствами соединяемых металлов и применяемой технологией сварки. Физические свойства металлов, от которых зависит их свариваемость, могут существенно отличаться. В табл. 1 приведены некоторые физические свойства металлов, наиболее часто встречающиеся в комбинированных соединениях. Соединяемые разнородные металлы могут быть одной основы (например, перлитная сталь + аустенитная сталь) и различной основы. Металлургические процессы сварки разнородных металлов, особенно с различной основой, более сложны и менее исследованы, чем процессы сварки однородных металлов [128, 166].
Решающее влияние на свариваемость разнородных. металлов оказывает металлургическая совместимость, которая определяется взаимной растворимостью соединяемых металлов и в жидком, и в твердом состоянии, а также образованием хрупких химических соединений — интерметаллидов. Практически не свариваются плавлением металлы и сплавы, которые не могут взаимно растворяться в жидком состоянии, например железо и магний, чистые свинец и медь, железо и свинец и др. При расплавлении таких пар металлов образуются несмешивающиеся слои, которые при последующем затвердевании могут быть сравнительно легко отделены друг от друга. Образуют сварные соединения металлы и сплавы, в состав которых входят элементы, обладающие неограниченной взаимной растворимостью не только в жидком, но и в твердом состоянии, т. е. образующие, непрерывный ряд твердых растворов.
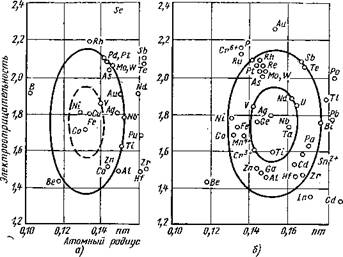
Взаимная растворимость элементов определяется подобием кристаллических решеток растворителя и растворяемого компонента, разницей в атомных радиусах компонентов и величиной электроотрицательности, характеризующей энергию связи между двумя элементами [98 ]. На диаграмме растворимости JI. Даркена и Г. Гурри [18] (рис. 2) по оси абсцисс отложены атомные радиусы элементов, а по оси ординат — электроотрицательность. Для определения пределов растворимости строят вспомогательные эллипсы: внутренний— с большой осью размером ±0,2 единицы электроотрицательностц и малой осью ±0,8 % разницы в атомных радиусах и вцещццй
|
Некоторые физические свойства металлов Таблица 1
|
|
* Электросопротивление при 18 °С. ** То же при О °С. |
|
Рис. 2. Влияние атомного радиуса и электроотрицательности на растворимость различных легирующих элементов в твердом состоянии в железе (а) и в ниобии (б) |
с большой осью ±0,4 единицы электроотрицательности^и малой осью ±15 % разницы в атомных радиусах. В пределах малого эллипса находятся металлы, образующие неограниченные твердые растворы с данным металлом-растворителем. Между малым и большим эллипсами располагают металлы с ограниченной растворимостью в металле-матрице. За пределами большого эллипса валентный и размерный факторы неблагоприятны для образования твердых растворов.
Исключение из описанной полуэмпирической теории растворимости составляют системы тугоплавких металлов: вольфрам—хром, ванадий—хром и другие, в которых может наблюдаться образование промежуточных фаз, хотя их кристаллические решетки подобны, а их электроотрицательность благоприятна для образования ряда не содержащих вакансий твердых растворов. Возможность применения этих данных описана на примере сварки ниобия с хромоникелевой сталью 12Х18Н10Т [18]. Как известно, предпосылок образования твердрго раствора между железом и ниобием нет. Вместе с тем возможно соединение этой стали с ниобием без образования в шве интерметаллических фаз, если с помощью электронного луча расплавляют только сталь и смачивают ею ниобий. Эта технология трудно осуществима и требует точного соблюдения определенных параметров сварки. Даже в случае незначительных отклонений механические свойства сварного соединения ухудшаются; так, при уменьшении температуры или нарушении контакта между жидким и твердым металлом могут появиться дефекты смачивания.
Можно предположить, что при сварке двух разнородных металлов в зону сплавления необходимо вводить такой барьерный элемент, который бы находился Внутри малых эллипсов на графиках растворимости в твердом состоянии для обоих свариваемых металлов-растворителей.
Представленная на рис. 2 диаграмма растворимости для железа и ниобия позволяет определить подходящий, промежуточный металл для соединений хромоникелевой стали 12Х18Н10Т (сплава железа) и ниобия. Находящийся на краю внутреннего эллипса ванадий обладает предпосылками для образования не содержащего вакансий твердого раствора как с железом, так и с ниобием. Из легирующих элементов в аустенитной стали, как следует из соответствующей диаграммы состояния, хром неограниченно растворим в ванадии, никель — ограниченно. Ванадий может быть нанесен на ниобий как наплавкой, так и осаждением из паровой фазы или с помощью катодного распыления. Соединения ниобия и высоколегированной хромоникелевой стали 12Х18Н10Т получены электронно-лучевой сваркой с использованием ванадия в качестве промежуточного металла [18, 195].
При сварке металлов с ограниченной растворимостью в твердом состоянии или сплавов, содержащих ограниченно растворимые легирующие элементы и примеси, возможность образования качественного соединения зависит от степени развития внутрикристалличе - ской ликвации в процессе первичной кристаллизации металла шва и от характера последующих фазовых и структурных превращений в нем в твердом состоянии. Некоторые фазовые и структурные превращения, протекающие в полиморфных металлах и сплавах в процессе охлаждения твердого раствора, при сварке могут приводить к образованию холодных трещин. Как правило, такие превращения сопровождаются значительными искажениями кристаллической решетки и объемными изменениями (мартенситное превращение в сталях перлитного и мартенситного классов, гидридное превращение в титане и его сплавах).
Образование горячих трещин при сварке разнородных металлов— менее характерный дефект, так как обычно предусматриваются меры предотвращения их появления [128]. При сварке металлов, сильно различающихся тепловыми свойствами (теплопроводностью, температурой плавления), возникают трудности, связанные с различиями в площади проплавления, обусловленными различными теплоемкостью, охлаждающей способностью. Кроме того, различия в магнитных свойствах приводят к изменениям глубины проплавления и стабильности горения дуги, что затрудняет получение однородной зоны сварки. Поэтому необходимо уделять внимание предварительному нагреву, способам перемещения электродов, образованию Дуги.
Правильный выбор способа, режимов и технологии сварки в сочетании с металлургическими средствами воздействия в большинстве случаев позволят полностью устранить или свести к минимуму вредные последствия ограниченной растворимости.
Рассмотрим наиболее характерные 'случаи сваривания двух разнородных металлов с использованием диаграмм состояния, которые
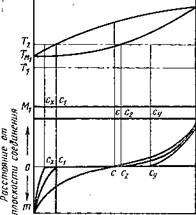
рис. 3. Система с полной взаимной растворимостью компонентов в жидком и твердом состояниях
|
Р |
известны в большинстве ДЛЯ двух, в ограниченных случаях для трех металлов.
Свариваемые металлы образуют непрерывный ряд твердых растворов.
Металлы, образующие системы с неограниченной взаимной растворимостью компонентов как в жидком, так и в твердом состоянии, например Си—Ni, легко диффундируют друг в друга с образованием твердых растворов переменной концентрации. (Как медь, так и никель имеют гранецентриро - ванную кубическую решетку.) Если два таких металла соединить между собой в твердом состоянии, нагреть до температуры tl9 лежащей несколько ниже температуры плавления более легкоплавкого компонента, и выдержать при этой температуре достаточное время то в результате процесса взаимной атомной диффузии по обе стороны от плоскости соединения образуются твердые растворы с плавно изменяющейся концентрацией по кривой men (рис. 3), т. е. начнется процесс сваривания под давлением [83].
Иная картина наблюдается в случае, если диффузионный процесс идет при температуре t2i лежащей выше температуры плавления более легкоплавкого компонента. Когда температура достигнет температуры плавления более легкоплавкого металла, в создании сварного соединения начнет принимать участие и жидкая фаза. В этом случае максимальная концентрация компонента в твердом М2 может быть не более с2. Дальнейшее повышение концентрации Мг в М2 невозможно, так как при температуре t2, как это видно из диаграммы состояния, кристаллы более высокой концентрации (например, с) в твердом состоянии существовать не могут.
Характер изменения концентрации твердого раствора по мере продвижения внутрь металла М2 будет определяться (при данной постоянной температуре) временем взаимодействия и значениями коэффициентов диффузии DMi и В общем
случае изменение концентрации может быть выражено кривой с2п.
Одновременно с диффузией компонента М1 в твердый М2 происходит растворение компонента М2 в жидком Мх. В результате этого растворения расплав постепенно насыщается компонентом М2, и при достаточном времени взаимодействия металлов расплав может достичь концентрации сг. Дальнейшее насыщение расплав может достичь концентрации сг. Дальнейшее насыщение расплава компонентом М2 вызовет образование равновесных при данной температуре кристаллов с2. Формируясь на поверхности твердого металла, эти кристаллы могут образовать общий неотделимый слой с кристаллами того же состава с2, образовавшимися на поверхности металла М2 в результате атомной диффузии в него компонента Мг.
При охлаждении системы двух взаимодействующих металлов произойдет кристаллизация расплава состава сг. Образующиеся при температуре ликвидуса первые кристаллы будут иметь состав с2 при дальнейшем охлаждении состав кристаллов будет меняться по кривой солидуса от с2 к сг. Под - влиянием диффузии состав последовательно образующихся слоев кристалла непрерывно выравнивается, и если процесс охлаждения идет не слишком быстро, образовавшиеся из расплава кристаллы у поверхности раздела при температуре солидуса будут иметь равномерный состав сг.
Однако реальный процесс формирования соединения может значительно отличаться от идеального. Если в процессе растворения компонента М2 в Мг происходит сильное перемешивание, как это имеет место в сварочной ванне, расплав на любом расстоянии от поверхности металла Мг будет иметь равномерную концен-
трацию с± (на рис. 3 обозначено прямой сгр). В реальных условиях полное выравнивание концентрации расплава обычно не происходит: вблизи поверхности твердого металла она равна съ а в глубине расплава концентрация компонента М2 может падать до нуля. В этом случае закристаллизовавшийся твердый раствор будет иметь переменный состав, который можно изобразить кривой с^тп.
Таким образом, после охлаждения системы на границе между твердыми растворами на основе металлов М2 и Мг (если даже они обладают полной растворимостью в твердом состоянии) может образоваться скачок концентрации с2—сг. Малое время взаимодействия, наличие посторонних примесей в металлах и высокая скорость растворения компонента М2 в Мг могут послужить причиной того, что содержание компонента Мг в поверхностных слоях твердого М2 не достигнет концентрации с2у равновесной для данной температуры, а будет иметь концентрацию су. Те же причины в совокупности с малой скоростью растворения могут вызвать снижение концентрации М2 в расплаве. Кристаллизация такого расплава начнется при более низкой температуре, и закристаллизовавшийся твердый раствор вблизи поверхности раздела будет иметь более низкое содержание М2, например сх. В этом случае изменение концентрации по сечению шлифа выразится кривой тсхсуп. Следует, однако, помнить, что в непосредственной близости от поверхности раздела наиболее вероятно образование равновесных концентраций с2 и сг даже при малом времени взаимодействия.
Применительно к диаграмме состояния системы медь—никель можно отметить, что сварку этих чистых металлов можно производить без присадки, при помощи дуги, горячей в среде аргона. Граница соединения резкая, что находится в соответствии с вышеизложенным. При большом увеличении (Х300) заметны переходные слои. Резкая граница не является недостатком полученного' сварного соединения. Прочность таких швов весьма высокая, и разрушение происходит вне шва.
С таким же успехом можно использовать другие виды сварки, используя в качестве присадочного материала либо медь, либо никель, либо медно-никелевый сплав.
Отметим справедливость изложенного применительно лишь к чистым металлам. Выпускаемый промышленностью никель часто содержит малые добавки углерода, некоторые сорта технически чистой меди содержат немного кислорода, так что их взаимодействие при сварке (с учетом попадания кислорода из атмосферы дуги) может вызвать появление пористости [191]. Чтобы устранить пористость, в электродную проволоку необходимо ввести элементы-раскислители. Этот пример подчеркивает значение другого важного обстоятельства. Используя диаграмму равновесия, следует учитывать, какие посторонние элементы могут присутствовать в сплаве, не усложняя при этом общей простой картины, которую представляет собой бинарная диаграмма.
Поскольку система медь—никель образует диаграмму с одной твердой фазой, то единственный эффект быстрого охлаждения, который часто наблюдается в структуре сварного шва, — это образование столбчатой структуры.
Другими примерами комбинаций металлов, которые образуют непрерывные ряды твердых растворов, являются пары серебро—золото и никель—платина (гранецентрированная кубическая), хром—молибден (объемно-центрированная кубическая), кадмий—магний (плотноупакованная гексагональная решетка) и др.
Свариваемые металлы образуют твердые растворы с ограниченной растворимостью. Возможны два случая ограниченной растворимости компонентов в твердом состоянии: с образованием эвтектики и образованием перитектики. Процесс сваривания в обоих случаях протекает аналогично, поэтому ограничимся рассмотрением только системы эвтектического типа с ограниченной растворимостью компонентов в твердом состоянии.
К комбинациям металлов, образующих простые эвтектические системы, относятся серебро—медь, алюминий—олово, кадмий—цинк, серебро—свинец. Наиболее известным образцом таких комбинаций может служить система свинец— олово, из которой изготовляют обычные твердые припои (эвтектический сплав 62 % Sn+ 38 % Pb).
Металлы, образующие системы простого эвтектического типа с ограниченной растворимостью компонентов в твердом состоянии, например Cd—Zn, способны диффундировать друг в друга только в пределах их взаимной растворимости. При взаимной диффузии таких компонентов в твердом состоянии (при нагреве ниже эв-
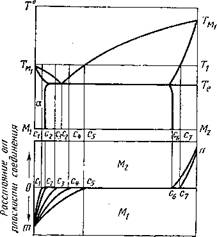
рис. 4. Система эвтектического типа с ограниченной растворимостью компонентов в твердом состоянии
|
Р |
тектической температуры Те) по обе стороны от плоскости соединения образуются твердые растворы, причем максимальные концентрации твердых растворов Мг в М2 (Р) и М2 в Мг (а) будут соответственно равны с6 и с2 (рис. 4). В отличие от системы с неограниченной растворимостью компонентов в твердом состоянии в данном случае на границе раздела будет наблюдаться скачок концентрации с6—с2. Общее распределение концентрации по сечению шлифа выразится кривой тс2с3п.
При взаимодействии металла М2 с металлом Мг (при температуре Тj) максимальная концентрация Мг в твердом М2 может быть не выше с1.
Одновременно с атомной диффузией в твердый металл произойдет растворение металла М2 в Мъ при этом концентрация М2 в расплаве может достичь c5i при которой на поверхности М2 будут расти кристаллы (3-фазы. При охлаждении ниже Тг из расплава выпадут кристаллы P-фазы состава с7—с6. а затем при температуре Те закристаллизуется эвтектика а+ р. Первичные кристаллы P-фазы могут также расти на слое родственной фазы, образовавшейся ранее на поверхности твердого М2, и оттеснять эвтектику в глубь расплава. Однако чаще эти кристаллы располагаются в массе эвтектики.
При сильном конвекционном или механическом перемешивании, обеспечивающем равномерность концентрации по всей массе расплава, закристаллизовавшийся сплав может иметь среднюю концентрацию съ с учетом p-фазы и эвтектики. В этом случае общее изменение концентрации по сечению шлифа будет выражено кривой пс3сър. В практике сварки полное выравнивание концентрации расплава обычно не происходит, и поэтому изменение концентрации чаще всего может быть примерно выражено кривой пс7сьт. Однако следует иметь в виду, что при сравнительно медленном охлаждении концентрация [3-фазы изменится с с7 на с6.
Уменьшение насыщения расплава компонентом М2 до концентрации с4 не вносит принципиальных изменений в строение зоны соединения, если не считать некоторого смещения концентрационной кривой в расплаве от сьт к с±т.
Если концентрация расплава перед охлаждением не достигла эвтектической, то при кристаллизации прежде всего выпадут первичные кристаллы a-фазы (с усредненным составом с2), а затем уже эвтектика а + р. Средний состав сплава, закристаллизовавшегося вблизи зоны соединения, будет соответствовать с3, а общее изменение 'концентрации по системе выразится кривой пс7с3т.
При кратковременном взаимодействии твердого металла М2 с жидким Мг состав расплава может достичь лишь точки сг. В этом случае в зоне соединения образуются только кристаллы a-фазы без эвтектики. Общее изменение концентрации при этом будет соответствовать кривой пс7с^т.
Таким образом, в результате взаимодействия твердого и жидкого металлов, образующих эвтектическую систему с ограниченной растворимостью компонентов, возникает промежуточная зона, состоящая из слоя твердого раствора (переменной концентрации) на базе твердого металла, эвтектики и твердого раствора (также переменной концентрации) на базе жидкого металла.
Остановимся еще на одном примере использования диаграммы эвтектического типа — явлении^контактного плавления [84, 110]. В этом процессе детали сжимают с небольшим усилием для образования физических контактов. В участках контактов
|
|
|
|
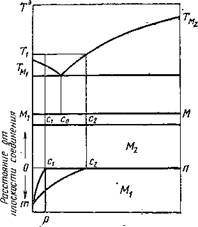
Рис. 5. Система эвтектического тина без Рис. 6. Система с интерметаллическими со - растворимости в твердом состоянии единениями
после схватывания и взаимной диффузии при нагреве образуется жидкость, имеющая меньшую температуру плавления, часто эвтектического состава, или отвечающая составу с минимумом температуры плавления твердого раствора. Образовавшаяся жидкость, растекаясь по стыку, обеспечивает образование межфазных поверхностей.
Для осуществления этого процесса необходимо выбирать пары металлов с расчетом, чтобы в результате взаимодействия в контакте при нагреве могла образоваться жидкость с температурой плавления ниже, чем у соединяемых металлов.
Свариваемые металлы образуют систему без растворимости компонентов в твердом состоянии. Металлы, не образующие твердых растворов и интерметаллических соединений, например Sn—Zn, не могут диффундировать друг в друга в твердом состоянии. Поэтому на границе между ними будет скачок концентрации от Мг до М2. Если такие металлы образуют простую эвтектическую систему (рис. 5), то при нагреве выше TMi возможно растворение твердого металла М2 в расплаве металла Мг. При этом вблизи поверхности М2 концентрация расплава достаточно быстро может достичь предела насыщения с2, и дальнейшее растворение будет определяться скоростью отвода атомов М2 от поверхности в глубь расплава.
При кристаллизации расплава с концентрацией с2 на границе раздела выпадут избыточные кристаллы М2 и эвтектика Мх + М2. Общее изменение концентрации по сечению шлифа при этом будет выражено кривой пс2т. При быстром отводе растворяющихся в расплаве атомов от поверхности раздела возможен случай, когда максимальная концентрация расплава достигнет лишь точки сг. В этом случае при охлаждении выпадут первичные кристаллы Мх и эвтектика Мх + М2. Распределение концентраций по шлифу при этом выразится кривой /гсх/?г. При сильном конвекционном или механическом перемешивании расплава возможно полное выравнивание концентрации, выраженное ломаной псгр.
Некоторые металлы, как, например, железо и свинец, не только практически нерастворимы друг в друге в твердом состоянии, но и не смешиваются между собой в жидком состоянии. Такие металлы выше линии ликвидуса расслаиваются и при охлаждении кристаллизуются самостоятельно. В зоне соединения таких металлов нельзя обнаружить каких-либо новых структурных образований.
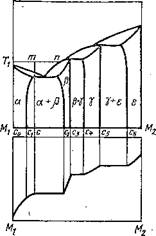
Свариваемые металлы образуют химические соединения. В этом случае процесс усложняется присутствием нового вещества. Возникновение таких соединений путем пересыщения основного твердого раствора или в результате непосредствен, ной реакции на поверхности контакта [14]. Чаще всего (хотя и не всегда) первой воз.
никает фаза, обладающая максимальной в данной системе теплотой образования.
Возникшая в результате реакции интерметаллическая фаза в дальнейшем растет по общим законам диффузии, при этом рост слоя каждой фазы во времени подчиняется параболическому закону. Рост фаз, расположенных на поверхности твердого металла, несколько искажается влиянием процесса растворения [101]. Проникание атомов металла Мг за счет диффузионной подвижности в металл М2 вызовет образование слоя твердого раствора є (рис. 6); концентрация компонента Мх в М2 при этом будет меняться по кривой М2с6.
Непосредственно к слою твердого раствора є прилегает слой у, представляющий собой твердый раствор на базе интерметаллического соединения. Концентрация компонента М2 в компоненте Мг на границе соприкосновения фаз 8 и у меняется скачком от св до сь. Внутри слоя у концентрация, как это следует из диаграммы состояния, не остается постоянной, а изменяется по кривой с5с4.
Слой фазы у граничит со слоем (J. Концентрация на границе соприкосновения Р и у скачком меняется от с4 до cz. Внутри слоя (J концентрация меняется по кривой с3с2. При диффузии в твердом состоянии концентрация в зоне соединения еще раз изменилась бы скачком от с2 до сг и затем по плавной кривой до чистого металла Мг. При взаимодействии твердого металла М2 с расплавом конечный результат процесса будет иным.
Одновременно с возникновением и ростом фаз Р, у и 8 происходит растворение твердого металла М2 в расплаве Мг. При отсутствии перемешивания концентрация расплава вблизи поверхности твердой фазы быстро достигает предела насыщения (сп) при данной температуре tl9 после чего начинается процесс образования Р-фазы. Кристаллы P-фазы, выпадающей из пересыщенного расплава, обычно растут внутрь расплава, перпендикулярно к поверхности твердого металла, и по своему строению значительно отличаются от идентичного им по составу слоя P-твердого раствора, образовавшегося в результате реактивной диффузии.
При охлаждении внутри расплава прежде всего образуются избыточные кристаллы P-фазы, затем эвтектика а + р. По мере удаления от зоны соединения появляются кристаллы a-фазы переменного состава, постепенно переходящие в кристаллы чистого Мг. Если содержание М2 в расплаве достигнет точки т, то среднее изменение состава закристаллизовавшегося расплава изобразится кривой стМх.
Наличие каждой данной фазы в зоне соединения и относительная толщина слоя ее зависит от работы образования этой фазы, скорости роста ее и склонности твердого металла к растворимости в расплаве. В связи с этим в реальных системах отдельные фазы, возможные по диаграмме состояния, иногда не обнаруживаются. Реальную диаграмму состояния с несколькими интерметаллическими соединениями имеют, например, системы железо — цинк, железо—алюминий, алюминий—медь, титан—железо и др.
Практически трудно встретить такие пары металлов, которые образовали бы только химическое соединение; в том или ином объеме будут образовываться также твердые растворы и даже эвтектики.
Прежде чем закончить с равновесной бинарной диаграммой, очень важно подчеркнуть еще раз ее ограниченную применимость. Она способна лишь указать, какие фазы возможны в равновесных условиях, однако она не может, к сожалению, ответить на вопрос, какие фазы появятся в условиях, отличных от равновесных. Не может она предсказать и форму, в которой данная фаза_будет присутствовать в сплаве. v ~
Интерметаллическая фаза может быть совершенно безвредной (или даже действовать как упрочнитель) в случае, если она распределена между зернами сплава в виде мелких включений. Эта фаза может создать угрозу разрушения материала, если будет присутствовать в виде непрерывных полос-строчек по границам зерен.
Большинство применяемых в промышленности материалов являются многокомпонентными сплавами, поэтому при сварке большинства сочетаний разнородных металлов необходимо пользоваться тройными, четверными и более сложными диаграммами равновесия (если они уже разработаны).
Использование тройной диаграммы медь—никель—цинк рассмотрим на при“ мере сварки монель-металла (сплав 65 % Ni и 35 % Си) с латунью J1KC (ГОСТ 1020—77), в состав которой входит 15 % Zn. Если не принимать во внимание элементы, содержащиеся в виде малых примесей, и рассматривать монель-
|
|
|
Ag |
С |
S |
X |
с |
D |
с |
С |
D |
X |
С |
D |
N |
С |
С |
S |
D |
С |
D |
С |
D |
D |
X |
|
|
А1 |
s |
X |
С |
X |
X |
X |
С |
X |
с |
X |
X |
X |
X |
с |
X |
N |
С |
X |
X |
X |
X |
X |
|
|
Аи |
s |
X |
X |
X |
С |
D |
S |
С |
X |
X |
С |
N |
S |
X |
S |
N |
X |
N |
X |
D |
N |
X |
|
|
Be |
X |
С |
X |
N |
X |
X |
X |
X |
X |
X |
X |
X |
X |
N |
X |
X |
D |
D |
X |
X |
X |
X |
|
|
Cd |
с |
X |
X |
N |
D |
D |
X |
D |
S |
D |
N |
N |
D |
с |
X |
N |
С |
N |
X |
N |
N |
I) |
|
|
Со |
D |
X |
с |
X |
D |
С |
С |
С |
X |
С |
X |
X |
S |
С |
S |
S |
X |
X |
X |
X |
X |
X |
|
|
Сг |
С |
X |
D |
X |
D |
С |
С |
С |
X |
С |
S |
X |
С |
с |
С |
S |
С |
X |
S |
D |
S |
X |
|
|
Си |
Г с |
С |
S |
X |
X |
С |
С |
С |
X |
S |
D |
D |
S |
с |
S |
D |
С |
D |
X |
D |
D |
X |
|
|
Fe |
D |
X |
с |
X |
D |
С |
С |
с |
D |
с |
С |
X |
с |
с |
S |
X |
X |
X |
X |
S |
X |
X |
|
|
Mg- |
X |
С |
X |
X |
S |
X |
X |
X |
D |
X |
D |
N |
X |
X |
X |
N |
X |
N |
D |
N |
D |
D |
|
|
Mn |
С |
X |
X |
X |
D |
С |
С |
S |
С |
X |
D |
X |
С |
с |
X |
N |
X |
X |
X |
X |
D |
X |
|
|
Mo |
D |
X |
с |
X |
N |
X |
S |
D |
С |
D |
D |
S |
X |
D |
D |
X |
D |
S |
S |
S |
S |
X |
|
|
Nb |
N |
X |
N |
X |
N |
X |
X |
D |
X |
N |
X |
S |
X |
N |
X |
X |
X |
D |
S |
S |
D. |
S |
|
|
Ni |
С |
X |
S |
X |
D |
S |
с |
S |
С |
X |
с |
X |
X |
С |
S |
D |
X |
X |
X |
X |
X |
X |
|
|
Pb |
С |
с |
X |
N |
С |
С |
с |
с |
С |
X |
с |
D |
N |
С |
X |
N |
С |
N |
X |
N |
D |
X |
|
|
Pt |
s |
X |
S |
X |
X |
S |
с |
S |
S |
X |
X |
D |
X |
S |
X |
с |
X |
X |
X |
X |
X |
X |
|
|
Re |
D |
N |
N |
X |
N |
S |
S |
D |
X |
N |
N |
X |
X |
D |
N |
с |
D |
D |
X |
D |
X |
X |
|
|
Sn |
С |
С |
X |
D |
С |
X |
с |
С |
X |
X |
X |
D |
X |
X |
С |
X |
D |
X |
X |
X |
D |
X |
|
|
Та |
D |
X |
N |
D |
N |
X |
X |
D |
X |
N |
X |
S |
D |
X |
N |
X |
D |
X |
S |
D |
D |
X |
|
|
Ті |
С |
X |
X |
X |
X |
X |
S |
X |
X |
D |
X |
S |
S |
X |
X |
X |
X |
X |
S |
S |
С |
S |
|
|
V |
D |
X |
D |
X |
N |
X |
D |
I) |
S |
N |
X |
S |
S |
X |
N |
X |
D |
X |
D |
S |
D |
X |
|
|
w |
D |
X |
N |
X |
N |
X |
S |
D |
X |
D |
D |
S |
D |
X |
D |
X |
X |
D |
D |
с |
D |
X |
|
|
,Zr |
X |
X |
X |
X |
D |
X |
X |
X |
X |
D |
X |
X |
S |
X |
X |
X |
X |
X |
X |
S |
X |
X |
|
Рис. 7. Прогноз возможности сварки разнородных металлов по диаграммам состояния: X — свариваемые пары, образующие интерметаллические соединения; S — хорошо свариваемые пары, образующие твердые растворы; С — поддающиеся сварке пары, отличающиеся образованием сложной микроструктуры; D —данных недостаточно, для сварки необходимы особые меры; N — сведения отсутствуют |
металл как простейший никель-медный сплав, то будем иметь дело с тремя основными металлами, входящими в состав шва, — медью, никелем и цинком. Медь и никель образуют непрерывный ряд твердых растворов, и оба металла растворяют в себе большое количество цинка, образуя твердый раствор.
Предположим, что необходимо осуществить сварку в защитной атмосфере стыкового соединения без разделки кромок и при использовании в качестве присадочного металла никеля [197]. Чтобы рассчитать состав получающегося после сварки сплава, предположим для простоты, что результирующий шов будет состоять из равных долей монель-металла, латуни и присадочного металла. Расчет показывает, что конечный состав сварного шва следующий: ~56 % Ni; ~39 % Си; 5 % Zn. Использование других присадочных металлов изменит относительное количество меди и никеля в сварном шве, но не будет воздействовать на цинк. Диаграмма показывает, что предельное содержание цинка не должно превышать 27 %, и в этом случае (с учетом высказанных предположений) сварное соединение между двумя этими металлами должно быть вполне надежным.
Приведенный выше анализ зависимости строения зоны соединения между двумя металлами от типа образуемой ими диаграммы состояния облегчает понимание фазового строения переходных зон в реальных сварных соединениях разнородных металлов и дает возможность сознательно воздействовать на технологические параметры процесса с целью получения наиболее прочного соединения.
На рис. 7 приведена схема, предсказывающая согласно диаграмме состояния возможность соединения между разнородными металлами [197]. Этой схемой можно пользоваться, исходя из предположения, что в процессе сварки будет достигнуто равновесное состояние и в соединении образуется совершенная форма твердого раствора.