СВАРКА разнородных металлов и сплавов
ДИФФУЗИОННЫЕ ПРОЦЕССЫ НА ГРАНИЦЕ КОНТАКТА
Диффузия играет важную роль во многих процессах, протекающих при сварке разнородных металлов. Диффузия вызывает перераспределение элементов в зоне сварного соединения; с нею связывают возникновение микронеоднородности сварных швов.
Диффузионные процессы обусловлены флуктуацией энергии атомов и дефектами кристаллической решетки. Движущими силами диффузии при сварке в твердом состоянии являются градиент химического потенциала, концентрации и фактические внутренние напряжения. Под действием этих напряжений диффузия идет весьма инг - тенсивно, к тому же в процессе ползучести материала возникают дополнительные вакансии. Надежность соединений повышается за счет переходной зоны, которая образуется путем взаимной диффузии атомов. Однако в ряде случаев, когда имеет место выделение интерметаллических фаз, механические свойства соединений могут ухудшаться.
К настоящему времени осуществлено много экспериментальных работ по исследованию взаимной диффузии для систем, образующих непрерывный ряд твердых растворов, а также для систем, образующих интерметаллические соединения (реактивная диффузия). Установлено [14], что в системах первого типа диффузионный слой характеризуется непрерывным изменением состава диффузионного слоя. В системах второго типа образуются слои интерметаллических соединений, соответствующих диаграмме состояний. Состав и порядок образования слоев при диффузии определяются диаграммой состояний изучаемой системы. Подробный обзор результатов исследования взаимной диффузии дан в работах [26, 84].
Сварка металлов в твердом состоянии. Для соединения разнородных металлов в твердой фазе необходимы развитие физического контакта, активация контактных поверхностей и объемное развитие взаимодействия. Последний процесс сопровождается диффузией и может заканчиваться образованием интерметаллических фаз и рекристаллизацией. В связи с этим необходимо иметь представление о скорости развития диффузионных процессов. В работе [78] методом локального рентгеноспектрального анализа исследована зона объемного взаимодействия золота с серебром (металлов, образующих непрерывный ряд твердых растворов), полученная сваркой давлением с импульсным косвенным нагревом. Золотая прокладка (золото марки Зл 999,9 ГОСТ 6835—80) толщиной ~20 мкм находилась на никелевой ленте, серебряная — толщиной ~50 мкм — на кварцевой пластине. Никелевую ленту с кварцевой пластиной соединяли через золотую и серебряную прокладки в атмосферных условиях под давлением 60 МПа в течение 0,7 с. Зона контакта золота с серебром при сварке нагревалась за счет теплопередачи от пуансона до температуры 500 °С. После сварки образцы отжигали при 500 °С в течение 1, 5, 10, 30 и 60 мин.
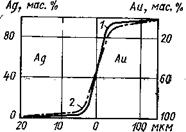
Объемное взаимодействие золота с серебром при импульсной сварке в течение 0,7 с происходит очень интенсивно. За указанное время развивается зона протяженностью до 4,5 мкм. При последующем отжиге сварного соединения в течение 10 мин протяженность зоны объемного взаимодействия увеличивается всего лишь на доли микрометра. Распределение золота и серебра в зоне объемного взаимодействия исследовали методом локального рентгеноспектрального анализа на установке «Камека». На рис. 13 представлены концентрационные кривые распределения золота в серебре и серебра в золоте в момент окончания сварки при последующем отжиге.
По формуле
с/с0 - 1 —erf (х/2Dt), (13)
|
33 |
где х —расстояние, на котором концентрация равна с D —коэффициент диффузии; t —время.
Рассчитаны коэффициенты диффузии золота в серебре [78]. Коэффициент диффузии золота в серебре [26 ]
Dau-as = 5,3- 1(Г4 exp (—29800/ДГ).
При температуре 500 °С DAu-Ag = 2* Ю-1^ см[1]/с. ^
Сравнение коэффициентов диффузии показало, что^в период импульсной сварки коэффициент диффузии золота примерно на четыре порядка больше, чем в случае обычного отжига. Такое существенное увеличение его в серебре можно объяснить тем, что в указанных условиях свариваемые металлы подвергаются интенсивной пластической деформации.
При сварке давлением с подогревом наиболее интенсивно пластическая деформация протекает по периферии контактной поверхности [77 ]. На краях контактной поверхности коэффициенты диффузии золота в серебре в 1,5—2 раза больше, чем по оси сварного соединения.
Рассмотрим механизм и кинетику образования и роста интерметаллических фаз при сварке металлов без расплавления, т. е. типичных реакций в твердом состоянии. В простейшем случае взаимодействия металла А с металлом В на границе раздела возникает лишь одна интерметаллическая фаза АтВп.
При обсуждении механизма подобного процесса обычно противопоставляют две точки зрения. Согласно первой —интерметаллическая фаза может возникнуть лишь после достижения в пограничном слое металла-растворителя предела насыщения твердого раствора при данной температуре
А + в'ЛАВ^ААвВ^ААвАтВпВ,
т. е. новая фаза возникает в результате перестройки кристаллической решетки вследствие достижения предела растворимости в пограничной прослойке одного из металлов.
|
|
Согласно второй —при соприкосновении двух металлов независимо от явления взаимной растворимости может произойти химическая реакция с образованием интерметаллического соединения непосредственно на границе раздела реагирующих металлов
А + В —> Л | Б —> Л | АтВп | В.
Предварительным этапом перед образованием на поверхности соприкосновения двух металлов новой интерметаллической фазы является
Рис. із. Взаимная диффузия золота и серебра:
I — сварной образец золота с литым серебром;
‘ — сварной образец, отожженный при 500 °С в течение 60 мин
хемосорбция (х. с.), т. е. такая адсорбция, при которой проявляются химические силы взаимодействия. Дальнейший рост интерметаллической прослойки, разделяющей оба металла, происходит за счет диффузионного поступления по крайней мере одного из компонентов к поверхности раздела.
Известно, что в случае постоянства концентрации диффундирующего компонента можно получить параболический закон роста слоя
у2 = 2А cDtla = kt, (14)
где у —толщина слоя; Дс —разность концентрации на его грани
цах; D — коэффициент диффузии в слое; t ■— время; а — некоторая постоянная величина с размерностью концентрации.
Температурная зависимость скорости роста имеет экспоненциальный характер, т. е.
k = k0 exp (—E/RT), (15)
где E — энергия активации диффузии; k0 — коэффициент, мало зави
сящий от температуры.
Обе эти зависимости соблюдаются в ряде случаев, но далеко не всегда.
В случае возникновения нескольких интерметаллических фаз картина еще более усложняется (см. рис. 6). Кроме того, в большинстве случаев свариваются не чистые металлы, а технические многокомпонентные сплавы с несовершенной кристаллической структурой. Температура и давление в ходе сварки не сохраняются постоянными. В целом истинная картина оказывается довольно сложной. При взаимодействии двух твердых металлов действительно возникают твердые растворы. Однако интерметаллическая фаза наблюдается и в случаях, когда твердые растворы еще не достигли предельной концентрации для данной температуры. Интерметаллические фазы образуются также в металле, почти не растворяющем диффундирующий компонент, например при диффузии железа в алюминии (предел растворимости <0,025 ат. % Fe при эвтектической температуре и <0,001 ат. % Fe при температурах ниже 500 °С).
Для правильного понимания механизма сварки разнородных металлов и сплавов без расплавления необходимо прежде всего выяснить закономерности ранних этапов диффузионного взаимодействия, когда интерметаллические фазы лишь начинают возникать и их наличие еще не привело к существенному ухудшению механических свойств. При этом необходимо учесть реальную структуру свариваемых металлов и, в частности, наличие границ зерен, дислокаций, неравновесных вакансий и др., а также нестационарность по температуре и давлению самого процесса сварки.
Необходимо прежде всего учесть весьма ограниченное применение законов диффузии Фика. Коэффициент диффузии существенно зависит от реальной структуры металлов и от концентрации. Следовательно, диффузионный поток будет зависеть от природы и протяженности границ между зернами, а также от температуры, состава и градиента концентрации. Правда, с повышением температуры эф
фективный коэффициент диффузии Бьф в поликристалле приближается к значению D, соответствующему достаточно совершенному кристаллу. С другой стороны, в случае D — f (с) две переменные — время t и расстояние у—связаны простым соотношением X =
Это дает возможность получить соотношение
с
Ddc/dk = — (1/2) J Хдс, (16)
Со
где с0—исходная концентрация; с—концентрация, при которой дс/дХ =0 [84].
Аналогичное соотношение получено экспериментально значительно позднее С. Матано, по имени которого и назван метод определения D = / (с). (Плоскость Матано проводят таким образом, чтобы площадь между кривой распределения и осями координат справа и слева от линии раздела была одинаковой.) Метод Матано может быть применен и для анализа экспериментальных результатов при образовании интерметаллидных прослоек.
При сварке не чистых металлов, а разнородных сплавов диффузия может происходить, когда градиент концентрации близок к нулю, при неравенстве нулю градиента термодинамического потенциала <5ФІду. Нарушение первоначального распределения углерода, возникшее вследствие сварки стали двух сортов различного состава, можно объяснить тем, что сродство углерода к железу больше, чем к кремнию. Подобные явления возрастания градиента концентрации дс/ду в ходе диффузионного отжига сварного стыка не могут быть объяснены в рамках классической теории диффузии. Необходимо - привлечение термодинамических представлений.
Фактическая сила, действующая на диффундирующий атом или ион в бинарном растворе, может быть представлена как отрицательный градиент химического потенциала д\,г1ду. Поток атомов i-то сорта
J j as — М іСідФі/dyN ~ — М iCidM t/dy, (17)
где Mi “Подвижность атомов і*го сорта, являющаяся функцией состава при постоянных температуре и давлении. Если учесть связь химического потенциала [А* с коэффициентом активности' yt при постоянном грамм-атомном объеме
{A* as const + RT In УіСі, (18)
то получим следующее выражение для парциального коэффициента гетеродиффузии атомов і-го сорта:
Dt = kTMt (1 + д In уг/д Inc,). - (19)
Впервые эти соотношения были использованы для анализа металлических систем Л. Даркеном. Он установил прежде всего связь коэффициентом гетеродиффузии Dt отдельных веществ и соответствующих коэффициентов самодиффузии D*. JI. Даркен принял, что подвижность атомов Afj, определяемая средней скоростью потока при диффузии в случае градиента термодинамического потенциала, равного единице при само - и гетеродиффузии, одинакова для любого вещества. Таким образом, различие между D* и D*t целиком сводится к равным значениям химического потенциала в обоих случаях. При самодиффузии
D* — kTMi* (20)
Из сопоставления (19) и (20) следует
Di = D*£(l+dnyi/dnci). (21)
В частном случае сварки двух разных металлов А и В можно связать коэффициенты самодиффузии DA и Db, определяемые с помощью радиоактивных изотопов, с общшм коэффициентом гетеродиффузии D бинарной системы, определяемым по кривой распределения концентрации одного из компонентов в зоне сварного стыка (метод Матано). Согласно соотношению Гиббса—Дюгема для двухкомпонентных систем
д In уА/д In сА = д In ув/д In св. (22)
Следовательно, если принять, что состояние микрообъема полностью описывается давлением, температурой и составом, то
D = (NaD*b + NBD) (1 + д In уА/д In сА). (23)
Это выражение позволяет объяснить еще одно явление, наблюдающееся при сварке пар металлов и сплавов, содержащих сильно отличающиеся, например по температуре плавления, компоненты. Это так называемый эффект Киркендалла. Сущность его заключается в следующем. Если между свариваемыми пластинами из разных металлов и сплавов поместить инертные метки (например, проволочки молибдена или вольфрама или же частицы тугоплавкого окисла), то после нагрева сварного стыка метки сдвигаются в сторону пластины, состоящей из вещества с более низкой температурой плавления. Сдвиг меток пропорционален квадратному корню из про* должительности отжига |/7, а скорость сдвига v возрастает с повышением температуры. Поскольку это явление связано с различием парциальных коэффициентов гетеродиффузии Dit то согласно (23)
v = (Di — Db) (1 + д In yjd In сА)дсА//ду. (24)
Неравенство парциальных коэффициентов гетеродиффузии приводит не только к смещению сварного стыка относительно первоначальной плоскости соприкосновения, но и к возникновению пор вблизи последней со стороны легкоплавкого металла, а также изменению поперечных размеров со стороны тугоплавкого металла.
Эффективный коэффициент диффузии в объеме реального металла отличается от коэффициента диффузии в достаточно совершенном монокристалле того же металла. Эти отличия еще более существенны в микроскопическом масштабе. Поэтому для правильного понимания начальных этапов формирования интерметаллидов необходимо учесть, что коэффициенты диффузии у границ зерен Огр и вдоль дислокации D0 существенно превышают коэффициенты объемной диффузии D0q. Так, отношение Drp/Do6 может достигать значения 106 [84]. Поэтому глубина проникновения за счет диффузии по границам зерен и вдоль дислокации больше, чем посредством объемной диффузии, а концентрация диффундирующего компонента окажется повышенной по границам зерен и вдоль дислокаций в зоне сварного стыка по сравнению со средней макроскопической концентрацией на данной глубине у. Этот эффект особенно существен в случае малой предельной растворимости диффундирующего компонента. Тогда перенос вещества (например, железа в алюминий) осуществляется в основном лишь за счет диффузии вдоль дефектов кристаллической решетки.
Возникший локальный объем твердого раствора с повышенной концентрацией может в дальнейшем эволюировать двумя путями: установление упорядоченного расположения атомов в кристаллической решетке твердого раствора; распад последнего на две фазы.
Если энергия связи между двумя атомами различного сорта U АВ больше, чем полусумма энергий связи атомов одного сорта UAB £> ї> (Uaa + Ubb)I2, то в твердом растворе установится упорядоченное расположение атомов по узлам кристаллической решетки. Если же, наоборот, UAB < (UAA + UBB)12, то твердый раствор будет распадаться на две фазы. Существует определенная термодинамическая вероятность локальной флуктуации состава из п-атомов растворенного компонента в одном грамм-атоме твердого раствора.
Энергия активации, необходимая для такой флуктуации,
TOC o "1-5" h z nW = n[ Ф8-Ф - (x's - х')дФ/дХі], (26)
где Xs и х' — концентрации, выраженные в атомных долях. ,
Начальную скорость выделения можно представить в виде
N exp (-E/RT) exp (nW/RT), (26)
где E — энергия активаций выделяющегося сорта атомов. Время образования первых скоплений
t'o^kз exp [(nW + E)/RT). (27)
Для возникновения интерметаллической фазы необходима еще перестройка кристаллической решетки, т. е. необходимо совершить работу для образования критического зародыша
Ак = aaW2Ap2, (28)
где a — коэффициент формы; а — удельная свободная поверхностная энергия зародыша; V — атомный объем; Ар — разность химических потенциалов в исходной решетке и зародыше.
Скорость^ образования зародышей новой интерметаллической фазы согласно А. Беккеру
N = 64 exp (-E/RT) -exp (-AJRT), (29)
Время образования зародышей новой интерметаллической фазы tQ —ks exp [(Лк - j - Е)/RTJ. (ЗО)
Экспериментальные исследования стареющих сплавов действительно показали, что механизм образования новой фазы довольно сложен. Так, в сплавах системы алюминий—медь при распаде пересыщенного твердого раствора меди в алюминии сначала возникают так называемые зоны Гинье—Престона—1, обогащенные атомами меди. Затем происходит частичное упорядочение в расположении атомов (зоны Гинье—Престона—2), и лишь после этого образуется метастабильная 0'-фаза с иной структурой. Равновесная же 0-фаза (СиА12) возникает на поздних стадиях процесса выделения.
Рассмотрим кинетику роста возникших за время t0 центров интерметаллической фазы. Скорость роста кристаллов G определяется выражением
G « G0Gd = aMt (дФJdy)/N, (31)
где G0 —частотный фактор, слабо зависящий от температуры и определяющий максимально возможную скорость роста; GD —диффузионный фактор, определяющий концентрацию атомов необходимого вида (по составу и энергии) на поверхности растущего кристалла; а — геометрический фактор (определяемый формой домена и условиями роста); Mt —подвижность дефицитных атомов в матрице; дФі/ду — градиент термодинамического потенциала в направлении роста.
Первоначально рост первых кристаллов интерметаллической фазы происходит преимущественно вдоль поверхности раздела обоих металлов вследствие большей скорости диффузии в этой плоскости. После встречи границ первых кристаллов интерметаллидов возникает сплошная прослойка, и происходит нормальный рост. Таким образом, зависимость размера у интерметаллической фазы от времени t может быть описана уравнением
уп = k(t — to), (32)
При п = 2 и f > t0 это уравнение переходит в уравнение Там* мана, которое, следовательно, пригодно лишь для описания поздних стадий роста интерметаллических прослоек.
Экспериментально исследовались ранние стадии процессов образования и роста интерметаллических прослоек в системах ниобий— железо [47], алюминий—медь, алюминий—латунь, алюминий— железо, алюминий—сталь [84].
Анализ микроструктуры зоны сварного стыка в исследованных системах позволяет представить начальные стадии образования и роста интерметаллических фаз следующей схемой: взаимная диффузия контактирующих металлов с различной скоростью; возникновение локально пересыщенных твердых растворов вокруг дефектов кристаллического строения; образование первых центров новой фазы в дефектных участках с повышенной концентрацией диффундирующего элемента; поперечный рост центров интерметаллической
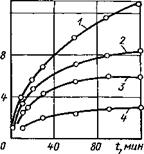
рис. 14. Зависимость толщины слоя интерметаллидов of времени нагрева при температуре, °С:
|
у, мкм
|
1 — 1200; 2 — 1100; 3 — 1000; 4 — 900
фазы вдоль плоскости стыка; смыкание и нормальный рост первой сплошной интерметаллической прослойки; образование первых центров второй интерметаллической фазы; продолжение нормального роста первой интерметаллической прослойки; смыкание центров второй интерметаллической фазы за счет поперечного роста и т. д.
Интерметаллиды на начальных стадиях развития, когда они не образуют еще сплошного слоя в контакте, практически не оказывают влияния на механические характеристики соединения. При наличии в контакте сплошного интерметаллического слоя (у ^ 5 мкм) пластичность и прочность соединений начинают быстро падать. Это обусловлено не только высокой хрупкостью новой фазы, но и внутренними напряжениями, возникающими вследствие объемных изменений.
В конкретных системах имеются свои особенности. В качестве примера рассмотрим закономерности образования и роста интерметаллического слоя в сварном соединении ниобия с железом [47 ]. Биметалл ниобий (НВ4) — железо характеризуется тем, что ширина переходной зоны (слоя интерметаллидов) не превышает 1 мкм. Толщина указанного слоя у изменяется в зависимости от температуры нагрева (900—1200 °С) и времени отжига соединений (момент появления интерметаллидов фиксировался при уж 1 мкм).
Математические выражения получены обработкой эксперимен - тальйых данных о росте слоя интерметаллидов в зоне соединения ниобия с железом (рис. 14). Зависимость толщины слоя интерметаллидов от времени нагрева можно описать уравнением
(33)
где у — толщина слоя; t — время отжига; t0 — латентный период, в течение которого интерметаллид вырастает до устойчивого размера; k — параметр, характеризующий скорость роста слоя, определяемый по формуле (15).
С учетом уравнения (15) выражение (33) можно записать
y* = k0e-V*T(t-t0). (34)
|
(35) 39 |
Уравнение (34) применимо для практических целей, если известны значения t0^R и Е. Латентный период t0 находят по формуле, учитывающей появление интерметаллидов размером меньше 1 мкм:
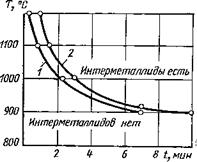
Рис. 15. Зависимость времени появления интерметаллидов от температуры в соединении ниобий— железо:
|
|
1 — расчетные данные; 2 — эксперимен-
где коэффициент А не зависит от температуры; Я — эффективная энергия активации процесса образования интерметаллида до устойчивого размера.
Для отыскания значений А и Я необходимо построить график
в координатах 1/Т — lg 4- Значения t0 определим из уравнения (33)
= (36)
где ts соответствует величине ys = V УНУ ті Уі и Ут — крайние значения переменной у на рис. 14.
Построение в координатах 1/Т — lg 4 показывает, что имеет место прямолинейная зависимость, которая подтверждает пригодность формулы (35) для оценки величин Я и Л. Тангенс угла наклона прямой к оси 1 /Т определяет энергию активации процесса роста интерметаллида, а отрезок отсекаемой прямой на оси ординат, — величину А.
Функция 4 (Т) после отыскания значений Л и Я выражается в виде
4 = 2,5- 10-7е14б>3/дг.
Зависимость времени появления интерметаллидов от температуры, рассчитанная по формуле (36), дана на рис. 15. Логарифмическая зависимость толщины слоя интерметаллидов от времени нагрева до исследуемого диапазона температур выражена прямыми, не проходящими через начало координат и имеющими примерно одинаковый угол наклона к оси lg (t — 4)- Величина lg k для каждой температуры нагрева определяется по отрезку, отсекаемому прямыми на оси ординат. Зная эту величину, путем построения зависимостей lg k — 1/Т легко найти значения Е и k0, а именно: Е = 96,3 кДж/моль, k0 = 6-Ю3 мкм2/мин. Подставив эти значения k0 и Е в выражение
(34) , получим
у2 _ 0. 103е-96,1(/-*о)/ЯГ
Исследовали также структуру переходной, зоны и определяли закономерность образования и роста интерметаллического слоя в зоне контакта ниобия с никелем [55]. Температуру отжига изменяли от 700 до 1000 °С. Длительность отжига при 700 и 800 °С составляла 10—200 ч, а при 900—1000 °С — 15—180 мин. Переходная зона ниобий—никель после отжига характеризуется двумя типами микроструктуры. При температуре отжига до 900 °С эта зона состоит из одного слоя. По данным микрорентгеноспектрального анализа, образуется соединение NbNi и твердый а-раствор на основе никеля. Другой тип микроструктуры переходной зоны наблюдается
при температуре отжига выше 900 °С. В этом случае переходная зона состоит из двух слоев: со стороны ниобия образуется NbNi, затем следует слой NbNi3, за которым располагается область твердого сс-раствора на основе никеля. Рентгеноструктурный анализ поверхностей разрушенного образца после отжига при 1000 °С в течение 2 ч показал, что переходная зона содержит интерметаллические фазы NbNi* NbNi3 и Nb5Ni. Микротвердость этой зоны 4000— 4700 МПа. Обработка экспериментальных данных выявила следующие зависимости:
t0 == 7,3 • 10-4е5*85/яг, у2 = 1,54- Юве-143*4<*--*о>/*г,
где t0 —латентный период, в течение которого интерметаллид вырастает до устойчивого размера (~1,5 мкм).
Взаимодействие твердой и жидкой фаз при сварке. Диффузионные процессы на границе между твердым и жидким телом обладают той особенностью, что скорость их определяется интенсивностью диффузии в твердом теле, так как она обычно во много раз меньше скорости диффузии в жидкости.
Процесс взаимодействия твердой и^жидкой металлических фаз при сварке и наплавке сопровождается той или иной степенью развития гетерогенной диффузии в зоне контакта. Составы фаз, находящихся в контакте, устанавливают в соответствии с требованием равенства их химических потенциалов, и даже незначительное время их сосуществования способствует протеканию процессов гетерогенной диффузии в направлении установления фазового равновесия. Интенсивность протекания этих процессов определяется температурой, длительностью контактирования, градиентом концентраций и диффузионной подвижностью атомов [105, 123].
С точки зрения развития процессов гетерогенной диффузии на границе раздела фаз определяющей является стадия взаимодействия твердого металла с жидким. Развитие диффузионных процессов на стадии охлаждения закристаллизовавшегося металла в основном определяется временем нахождения металла при повышенных температурах. Для большинства элементов замещения их подвижность при переходе из жидкого состояния в твердое резко падает (коэффициенты диффузии уменьшаются на три—пять порядков), и длительность пребывания при повышенных температурах в реальных процессах сварки и наплавки оказывается недостаточной для существенного развития процесов химической неоднородности.
Одним из основных требований, предъявляемых к соединениям разнородных металлов, является получение соединений с высокими механическими свойствами^ зоне контакта и с минимальным развитием процесса растворения твердой фазы, приводящего к переходу элементов основного металла в наплавленный металл. В большинстве случаев как наплавляемый металл, так и подложка являются сплавами, в связи с этим на свойства получаемых соединений также могут оказывать существенное влияние процессы гетерогенной диффузии примесей в зоне контакта.
В литературе имеются многочисленные сведения о влиянии развития процессов химической неоднородности на физико-механические свойства соединений, в частности на механические, коррозионные свойства, на поведение соединений при вибрационных испытаниях и т. д. Количественное решение задачи по гетерогенной диффузии примеси в зоне контакта твердой и жидкой фаз при частных граничных условиях приведено в работах [42, 120, 131]. Характер распределения примеси зависит от коэффициента распределения k, характеризующего различную растворимость элементов в твердой и жидкой фазах, от коэффициентов диффузии в твердой DT и жидкой Dm фазах, длительности процесса t и градиента концентрации примеси на границе сплавления.
Условия задачи диффузии примеси в двух средах при частных граничных условиях формулируются следующим образом:
1) dcjdt = DTd2c! dx2, х < 0; dcm! dt — Dmd2c/dx2, х ►> 0;
2) ст = ст0 при / = 0 и х<0; сж = сж0 при t — О и х>0;
3) DT (дст/дх)х==0 = Dm (дсж/дх)х=0 на границе раздела для всех t
0 сю
4) j* (Сто £т) dx = J (сжо сж) dx
—оо 0
5) ст/сж = k в равновесном состоянии.
Решение имеет вид
с™=с'"“^Йг[(1+егГ-5^г)] <37>
|
с7о — ксжо |
|
при х>0, (38) |
|
k--V Dm/DT |
|
-erf( - Д_ ) V 2f D^t / |
где ст (X, о и сж (*, t) — концентрации элемента примеси соответственно в твердой и жидкой фазах в момент і ►> 0 на различных расстояниях х (в см) от границы; сх0 и сж0 — начальные концентрации примеси в твердой и жидкой фазах (t = 0 с); DT и Ож — коэффициенты диффузии примеси в твердой и жидкой фазах; k — коэффициент распределения; t —длительность процесса, с.
Если градиент концентраций на границе сплавления при t — 0 отсутствует (наплавка, сварка однородного металла) — с0 = сж = = ст0, уравнения принимают вид
|
Cq — kco |
|
при x<0; (39) |
|
ст СМ) — Со — |
|
k]/ £>т/Dm - j - |
|
^[l+erf(—=Y 1 L ^ 2Jf DTt / |
= [l-rf-^)] „p„,>0. (40)
В том случае, если растворимость элемента в твердой и жидкой фазах одинакова (k = 1), возрастает роль градиента концентрации на границе сплавления Дс0 = ст0—ст0:
ІС' Гі+ЄГ'(ірЬ-)] "РИ^<0Г(41)
|
JГDt/^ж 4“ 1 Лео |
(x, t) — Ctq
|
при x>0. (42) |
1 _ erf (—
|
1 + ]^DT/Dm |
V 21/" Dmt )
В предельном случае, когда DT « Dm (отсутствует граница фаз, температура в металле постоянна), формулы преобразуются в известные уравнения, применяемые для расчета ряда диффузионных процессов:
С(х. о = с10 - + erf ( ) при х<0; (43)
|
при х>0. |
|
(44) |
Co(x, t) — Сио -[-
Значения коэффициентов диффузии DT зависят от температуры, концентрации, структуры, примесей, напряженного состояния и могут меняться в широких пределах (КГ7—КГ16 см2-с"1 и менее). Значения коэффициентов диффузии в жидкости в основном лежат в пределах 1(Г4—1(Г6 см2-с-1. Длительность контактирования в случае сварки и наплавки металлов меняется от 0,01—0,5 с (смачивание) до 0,5—10 с и более (наплавка, сварка) и зависит от погонной энергии и скорости сварки [120, 123].
Равновесный коэффициент распределения (k0 = ст/сж) в зависимости' от легирующего элемента может быть больше или меньше единицы- Если происходит снижение температуры, то k0 < 1 (1 — 0,001 для систем, относящихся к чисто эвтектическим). Если примесь повышает температуру плавления сплава, то k0 > 1 (1—3). В редких случаях (для бора в германии) k0 = 15 или даже больше. При наличии интенсивного перемешивания эффективные значения коэффициента распределения k могут сильно отличаться от равновесных и с увеличением интенсивности перемешивания стремятся к 1.
В общем случае значения эффективного коэффициента распределения определяются из уравнения, полученного К. Бартоном и др.
k = kj lk0 + (1 - ko) exp (1 - /бо/D*) ], (45)
где / — скорось увеличения толщины твердой фазы; 80 — толщина ламинарного слоя; Dm = 10_5-~1(Г4 см2*с-1.
Для большинства практических случаев неизвестны точные значения эффективного коэффициента распределения k, коэффициентов диффузии DT и Ож и длительности контактирования. Точное определение этихГ величин в реальных металлических системах связано с большими трудностями, так как их значения в значительной степени зависят от многочисленных побочных процессов.
Для большинства случаев диффузии элементов замещения эффективный коэффициент распределения k можно не учитывать при решении гетерогенных задач с точностью ~0,1—0,01 %, т. е. в пределах точности локального рентгеноспектрального микроанализа. В этих случаях для расчета можно использовать приближенные уравнения
Crj, = ctq A. CqBIi/~D^/Dyx - j— 1, (^6)
cm = сж0 + A c0B/j/" D mDT, (47)
ГДЄ ACq = Ctq ^жО*
Уравнения (37), (38) и (46), (47) для гетерогенной диффузии примеси неприменимы в случае контакта двух чистых разнородных металлов. В связи с этим рассмотрена задача развития химической неоднородности в зоне контактирования твердой и жидкой фаз разнородных металлов [123]. Решение имеет вид
ст = - Г-У°ж [l - f - ф(при х<0; (^8)
Vdt + Tdx L V2J/OV/J v сж= [l-<e/-JL=Y| при x>0. (49)
Уравнения гетерогенной диффузии примеси (37) и (38) и уравнения (48) и (49) не учитывают наличия двухфазной области, изменения коэффициентов диффузии от концентрации. Уравнения (48) и (49) могут быть использованы и при взаимодействии двух металлов в твердом состоянии. В этом случае
|
св |
С - VD‘
Vda + Vdb
V-Da _ Vda + Vdb
1+фЫЬ)]при *<0; (50>
‘-ф(-іИЬ)] nP“*>0’ <51)
где сА и св —соответственно концентрации элемента А в В и В в A; Da и Db —соответственно коэффициенты диффузии А в В и В в Л.
В тех случаях, когда при соединении металлов требуется свести к минимуму ширину зоны химической неоднородности, необходимые температуру и время процесса можно определить из (37), (38) или (50), (51), задавая значения ст, ст или сАу св равными нулю, а х — равным ширине допустимой зоны гетерогенной диффузии. При определении времени контактирования для соединения металлов в твердом состоянии необходимо учитывать дополнительное время, требуемое для достижения физического контакта на всем протяжении контактирующих поверхностей.
Разработана методика расчета [42, 154] толщины интерметаллической прослойки в зависимости от температуры процесса и времени контакта твердой и жидкой фаз. Для простоты расчета приняли диаграмму состояния взаимодействующих металлов А и В, приведенную на рис. 4. Как правило, опасные толщины интерметалличе
ских прослоек весьма малы в сравнении с толщинами самих взаимодействующих тел, поэтому при расчетах эти тела в ряде случаев можно считать полубесконечными. Тогда распределение концентрации по толщине жидкости при растворении в ней твердого тела с учетом нестационарности процесса можно найти по формулам, приведенным в работе [131]. Так как выпадение интерметаллида может происходить только в том случае, если концентрация А в некоторой части жидкости больше концентрации с19 то, зная закон насыщения жидкости атомами твердой фазы и используя диаграмму состояния, можно определить толщину интерметаллической прослойки, которая выпадет при кристаллизации, в зависимости от длительности контакта жидкой и твердой фаз.
Суммируя толщину прослойки при t± от каждого элементарного слоя, найдем полную толщину прослойки [154]
й. = 2>=2£Е£ Д.. (52)
i=l 1=1
или, выбирая толщину Дг бесконечно малой, придем к интегралу
<53>
О
где а — то значение я, при котором с{а) = сг.
Определяя у для разных значений времени при Т = const, получим зависимость толщины прослойки от времени контакта жидкой и твердой фаз.