СВАРКА И СВАРИВАЕМЫЕ МАТЕРИАЛЫ
Взаимодействие металла с газами
При дуговой сварке плавлением расплавленный металл, взаимодействуя с окружающей атмосферой, поглощает кислород, азот и водород, что существенно сказывается на свойствах металла шва.
Растворение двухатомного газа в металле описывается уравнением
|
1/гГ2(газ) з* [Г](раствор)1 аг _ /г Г% Г]
|
откуда следует известное правило квадратного корня (закон Сивертса)
|
(3.21) |
[% Г] = (V/r) рт 5-
где аг и —активность и коэффициент активности газа, зависящие от состава расплава [1].
Равновесие металл — газ зависит от температуры. Эта зависимость обычно выражается эмпирическими уравнениями вида
lg Кг = ЛІТ + В,
где А и В —-постоянные, определяемые из опыта.
При температурах, приближающихся к точке кипения металла, нужно учитывать встречное давление паров металла, вызывающее снижение реальной растворимости газа.
Окисление металла шва
Кислород в металле шва может находиться в зависимости от концентрации других присутствующих в нем элементов в нескольких формах: в виде оксида железа в твердом растворе и выделяющегося в самостоятельную фазу; в виде оксидных включений; в виде твердых растворов и эвтектик, образованных оксидными и сульфидными включениями, а также в виде самостоятельной фазы О.
Растворимость кислорода в железе в форме FeO невелика н может быть описана при контактировании жидкого железа со шлаками, состоящими практически только из оксида железа, уравнением
lg [О] = — 6320/Г + 2,734. <3.22)
где [О] — концентрация кислорода в жидком железе, % (по массе).
Последним представлениям на основе исследования химических равновесий типа МеО+Н2 = Ме +Н20, больше соответствует гипотеза о том, что кислород находится в железе в виде
|
ТАБЛИЦА 3.4 РАСТВОРИМОСТЬ КИСЛОРОДА В ЖИДКОМ ЖЕЛЕЗЕ ПРИ РАЗЛИЧНЫХ ТЕМПЕРАТУРАХ
|
TOC o "1-5" h z т <£ о 4
* хГ • ^
с 6 8 г
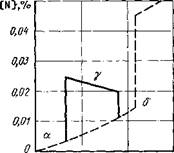
Рис. 3.4. Характерные типы включений в металле швов, выполненных сваркой плавлением: а — силикатные (изотропные); 6 — силикаты железа (анизотропные); в — силикаты с преобладанием марганца (изотропные, внутри светящийся крест); г — сульфиды, оксиды н пр. (изотропные)
самостоятельной фазы О. Существенно меньшая электроотрицательность железа по сравнению с кислородом позволяет предположить, что кислород может существовать в железе в анионной форме 0~z. Значительные размеры названных анионов обусловливают ничтожную их подвижность при пропускании через железо постоянного тока.
Вместе с тем практически все металлургические расчеты основаны на предположении о растворении кислорода в железе в форме FeO, и независимо от формы присутствия кислорода с большой достоверностью установлено, что растворимость его в твердом a-железе составляет 0,03%, а в у-железе ~ 0,003 %.
Результаты расчетов по уравнению приведены в табл. 3.4. При снижении температуры происходит перераспределение FeO между шлаком и металлом в соответствии с константой распределения
L = [FeO]/(FeO),
где [FeO] и (FeO) —концентрации оксидов в металле и шлаке соответственно.
Константа распределения изменяется в зависимости от температуры по формуле
lg [FeO]/(FeO) = — 6300/Г + 1,386.
Выделяющийся из раствора FeO может не только переходить в шлак, но и вступать во взаимодействие с элементами - раскислителями Мп, Si, Ті, А1 и др. при наличии таковых в жидкой сварочной ванне. И поскольку сродство к кислороду у названных элементов растет при снижении температуры, продукты раскисления реакций вида
п [FeO] + т [X] = п [FeO] 4 ХтОп (3.23)
частично переходят в шлаковую фазу, но остаются и в закристаллизовавшемся металле в виде неметаллических включений, повышая общую концентрацию в нем кислорода (рис. 3.4). Оксидные включения часто имеют неоднородный минералогический состав, а также могут образовывать сложные кислородосодержащие включения, например, оксисульфиды или кислородофторсодержащие включения.
Взаимодействие наплавляемого металла с азотом
Азот попадает в зону сварки главным образом из воздуха. В зависимости от температуры азот может находиться в газовой фазе в различных состояниях: молекулярном, атомарном и ионизированном. Растворимость атомарного азота при постоянной температуре определяется соотношением
1% N] = KPn.
При наличии азота в газовой фазе в молекулярной форме его растворимость определяется уравнением
[% Щ =
Последняя зависимость косвенно указывает на то, что процессу растворения азота предшествует диссоциация молекулярного азота на атомы.
Азот образует с железом химические соединения — нитриды: Fe2N (11,15 % N) и Fe4N (5,9 % N). Считается, что возможно и образование нитрида Fe8N [3].
Теплота образования Fe2N и Fe4N соответственно равна [4]:
2Fe -[- 0,5N2 = Fe2N 4 16,5 кДж/моль;
4Fe 4- 0,5N2 = Fe4N 4 18673,1 кДж/моль.
Fe2N начинает разлагаться в атмосфере чистого азота при температуре —550 °С. Дальнейшее повышение температуры
вызывает диссоциацию нитрида Fe4N. При относительно небольших концентрациях азота в металле нитрид железа довольно устойчив даже при высоких температурах.
|
700 1270 1770 Т, Н Рис. 3.5. Растворимость в железе азота при его парциальном давлении р jj — Ю5 Па |
Растворимость азота в железе при его парциальном давлении Pn, = 105 Па приведена на рис. 3.5. Изменение растворимости азота при кристаллизации железа происходит скачкообразно. Вместе с этим из диаграммы состояния железо— азот следует, что растворимость азота в твердом железе значительно превышает значения, приведенные на рис. 3.5. Поэтому кривую предельной растворимости азота в железе на рис. 3.5 следует рассматривать как растворимость азота, находящегося в равновесии с нитридами железа.
Взаимодействие наплавляемого металла с водородом
|
|
|
Рис. 3.6 Влияние температуры иа степень диссоциации молекулярного водорода |
Источниками водорода в газовой фазе зоны сварки могут служить атмосферная влага, влага покрытия электрода или флюса, конституционная влага ржавчины на свариваемых кромках и т. д. Образующиеся вследствие этого водяные пары диссоциируют и повышают концентрацию водорода в газовой фазе.
В зависимости от температуры газовой фазы водород может находиться в ней в различных состояниях: молекулярном, атомарном и ионизированном. При высоких температурах происходит частичная диссоциация молекулярного водорода на атомарный:
|
т* го3, к |
Н2 = 2Н — 434,6 кДж/моль,
а также на атомарный и ионизированный:
Н2 = Н + Н+ + е — 1747,9 кДж/моль,
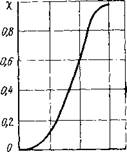
Степень диссоциации молекулярного водорода на атомарный в зависимости от температуры показана на рис. 3.6. Из приведенных данных следует, что в столбе сварочной дуги (7 = 5000—6000 К) подавляющее количество водорода находится в атомарном состоянии. Практически полное разложение водяного пара с образованием свободного
водорода или гидроксида происходит при его взаимодействии с железом, ферросплавами и расплавленным шлаком по реакциям:
Me 4- Н20 МеО 4 н2;
2FeO 4 Н20 ^ Fe203 + Н2;
Me 4 2Н20 МеО 4 ОН 4 ЗН;
СО 4 Н20 С02 + Н2.
Концентрация водорода в металле швов зависит от температуры, до которой нагревается в дуге металл, химического состава металла и парциального давления водорода в атмосфере дуги.
Значительное влияние на содержание водорода в швах оказывает парциальное давление его в атмосфере дуги. По данным работы [5], введение в зону сварки ржавчины и последующее увеличение ее количества приводят к возрастанию общего объема выделившихся газов. При этом количество выделившегося водорода растет значительно быстрее, чем объемы СО и СОг, в результате резко возрастает количество водорода в металле шва.
Если водород находится в атомарном состоянии, растворимость его в металле при постоянной температуре в состоянии равновесия подчиняется линейной зависимости
т = крн,
где [Н]—растворимость водорода, % (по массе); рн—парциальное давление атомарного водорода в газовой фазе; К — константа равновесия, зависимая от температуры и фазового (а также агрегатного) состояния металла.
Растворимость водорода, находящегося в газовой фазе в молекулярной форме, подчиняется закону квадратного корня из его парциального давления:
|
(3.24) |
[Н] = К Vph2 ,
где рнз—парциальное давление молекулярного водорода в газовой фазе.
Зависимость (3.24) косвенно указывает на то, что процессу растворения молекулярного водорода предшествует его диссоциация на атомы. Если в газовой фазе водород находится в атомарном и молекулярном состояниях, то его растворимость при постоянной температуре может быть выражена зависимостью
|
|
(3.25)
где рн2н — общее парциальное давление атомарного и молекулярного водорода; % — степень диссоциации водорода при данной температуре.
Константа растворимости водорода К зависит от температуры и состава металла, которая может быть определена уравнением
174е*
lg К= -------------------------- 1,72. (3.26)
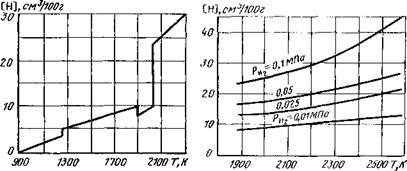
Растворимость водорода в железе при парциальном давлении рн. =0,1 МПа в зависимости от температуры показана на рис. 3.7.
Для приближенной оценки растворимости водорода в расплавленном железе при абсолютной температуре Т и парци-
|
Рис. 3.7. Растворимость в железе водорода Рис. 3 8 Влияние температуры и парци- при парциальном давлении МПа альиого давления водорода в газовой фазе на его растворимость в жидком железе |
альном давлении рНг в интервале температур до 2570 К можно пользоваться уравнением
lg V = 0,5 lg РН3— -^ + 0,888. см3/100. (3.27)
На основании расчетов по приведенному уравнению построены кривые (рис. 3.8).