Фазовый состав
При рассмотрении фазового состава клинкера следует учитывать условия его формирования. При обжиге сырьевой шихты содержащиеся в ней примеси и зола топлива распределяются неравномерно, что обусловливает переменный состав образующихся клинкерных фаз. Для них характерно образование твердых растворов, способных размещать в своих кристаллических решетках вовлеченные примесные атомы при условиях компенсации их зарядов. Компонентами твердых растворов являются щелочи, оксиды магния, хрома, титана, фосфора и др. В процессе цбжига происходит стабилизация моноклинного алита.^1 Наибольшей способностью к вовлечению примесных атомов в решетках обладают алюминаты (10%) и алюмоферриты кальция (13%); бе - литы (6%) и алиты (около 4,8%). По данным М. М. Сычева, даже при отсутствии примесей в двухкальциевом силикате содержится в нестехиометрической форме избыточное количество до 10% оксида кальция.
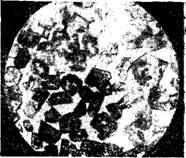
Признано называть клинкерные фазы по названию исходных минералов — фаза алита, фаза белита. Алит — Фаза трехкальциевого силиката C3S (рис. 1). Одним из наиболее важных в химии цемента соединений извести с кремнеземом является трехкальциевый силикат c3s. Он устойчив в интервале температур от 1523 до 2343 К, при которых расплавляется с разложением (инконгру - ентно), на СаО и расплав; он может образовываться путем первичной кристаллизации из трех - или четырехком - понентного расплава, содержащего алюминий и железо. В этом случае не удается получить чистые кристаллы C3S, ибо в их твердом растворе содержится небольшое количество алюминатов и ферритов кальция.
С. М. Рояк и О. К. Алешина наблюдали образование c3s при 1273—1473 К в зоне твердофазовых реакций в виде слоя толщиной около 1 мкм вокруг зерен СаО и в количестве менее 1% массы материала. Этот слой служит затравкой для основной массы алита, кристаллизующейся в жидкой фазе при 1723 К - Известен способ получения C3S из извести и кремнекислоты в расплаве хлористого кальция; после охлаждения расплав обрабатывается спиртом и водяным паром при 873 К. C3S может образовываться путем твердофазовой реакции между крсмнекислотой и известью при температурах
1723 — 1873 К; при 2073 К — реакция протекает с большей скоростью. Однако для осуществления этой реакции необходим многократный обжиг тонко измельченного промежуточного продукта. Только при этих условиях можно получить C3S, не содержащий свободной извести.
Структура алита сложена из тетраэдров (Si04) и
Отдельных ионов кислорода и кальция. Последние координированы между собой шестью кислородными ионами. Для этой структуры характерна нерегулярная координация ионов кальция и «пустот» между ними. Полагают, что такой координацией можно объяснить высокую энергию решетки трехкальциевого силиката. Алит в порт- ландцементном клинкере рассматривали как трехкаль - циевый силикат, в котором два атома кремния замещены двумя атомами алюминия, а для компенсации заряда в промежутках располагается атом магния. Такое замещение происходит в каждых 18 молекулах c3s, что позволило предложить следующую формулу алита — C54S16 AM. Предлагают также рассматривать формулу алита в виде C5jSi6 AM. Однако получить синтетический алит этого состава не удалось, продукт обжига содержал обычно некоторое количество свободного оксида кальция. Это дало основание считать, что растворимость глинозема значительно меньше, чем полагали ранее.
|
Рис. 1. Кристаллы алита |
Был определен предел растворимости А1203 в C3S в количестве до 1%, a MgO до 2,5%. Однако С. М. Рояк химическим методом установил содержание MgO в' алите всего лишь в количестве 1,4%. Возможны включения в состав алита помимо А1203 и MgO, содержащихся в расплаве, также оксидов хрома, железа, марганца и др., которые заметно влияют на условия полимор'фных превращений алита. Кроме того, при этом существенно изменяются химические и другие свойства. Особый интерес представляет, например, тот факт, что при наличии этих примесей увеличивается процент оксида кальция, растворенного в решетке C3S сверх количества, со
ответствующего стехиометрическому составу. Таким образом, по современным воззрениям алит можно рассматривать как твердый раствор трехкальциевого силиката цементного клинкера с алюминием, магнием, а также с примесями в исходной сырьевой шихте, находящимися в твердом растворе, — титаном, железом, хромом, натрием и др. При высоких температурах алит устойчив в триклинной форме, а при охлаждении переходит в низкосимметричную форму.
Белит — фаза двухкальциевого силиката (C2S) существует в четырех модификациях а, а', (3 и у. a-C2S кристаллизуется из расплава при 2403 К и устойчив до температуры 1720 К, при которой переходит в a'-C2S. Плотность кристаллов a-C2S, выделенных из шлака, составила 3,04 г/см3.
A'-C2S при нагревании начиная от 7-модификации устойчив в пределах 1123—1720 К - При охлаждении до 978 К происходит переход а' в |3-C2S.
Oc'-C2S отличается от других модификаций ортосили - ката своей высокой плотностью, составляющей 3,4 г/см;.
|3-C2S образуется при охлаждении a'-C2S. Эту модификацию рассматривают как метастабильную; чистый >|3-C2S при охлаждении до 793 К переходит в у-модифи - кацию; при содержании в кристаллической решетке примесей |3-C2S стабилизируется и перехода не происходит, либо он затягивается на неопределенное время. Плотность этой модификации белита — 3,28 г/см3.
7"C2S — наиболее стабильная модификация ортосили - ката кальция, она образуется только в результате охлаждения других высокотемпературных модификаций этого минерала; ее плотность — 2,97 г/см3. Кристаллические решетки всех модификаций ортосиликата кальция построены из изолированных тетраэдров (Si04) и ионов Са2+. Структуру C2S рассматривают в основном как образованную совокупность цепочек, сложенных из взаимно чередующихся ионов кальция и тетраэдров (Si04). У cc-C2S отмечается высокая координация ионов кальция по кислороду с последующим уменьшением при понижении температуры, при которой образуются другие модификации.
При переходе высокотемпературных модификаций C2S в устойчивую низкотемпературную модификацию 7-C2S двухкальциевый силикат обычно рассыпается в порошок. Это объясняется тем, что более плотная модификация p-C2S переходит в Y-C2S с плотностью 2,97, что приводит к увеличению объема примерно на 10%. В связи с низкой гидравлической активностью y-C2S необходима стабилизация модификации p-C2S с тем, чтобы предотвратить ее переход в Y-C2S. Стабилизация §-C2S может быть достигнута обычно, если этот минерал находится в плотной застывшей жидкой фазе, препятствующей объемным изменениям при охлаждении минерала |3-C2S и переходе его в 7-c2s. Стабилизация достигается также путем исключительно быстрого и резкого охлаждения, при котором происходит фиксация высокотемпературных модификаций C2S (а, а', |3) из-за недостатка времени для внутрикристаллических изменений.
Стабилизация |3-C2S происходит тогда, когда вводятся (или уже имеются в исходных сырьевых материалах) такие примеси, которые в виде твердых растворов входят в кристаллическую решетку и тем самым стабилизируют эту модификацию; количество примесей около 6%. Среди них имеются стабилизаторы, способствующие заметному повышению гидравлической активности C2S и, наоборот, вызывающие при известных концентрациях ее снижение. Стабилизаторами могут быть не только оксиды, но и ортосиликаты магния, железа, калия, марганца и ряда редкоземельных металлов. К ним относятся оксиды бора, хрома, фосфора, бария и др. Была выявлена стабилизирующая роль небольших количеств щелочей и оксида кальция.
Известно соединение К20 • 23Са • 12Si02, получающееся в результате взаимодействия калиевой щелочи с ортосиликатом кальция; предполагают, что щелочь входит в виде твердого раствора в состав двухкальциевого силиката. В случае появления при восстановительном обжиге углерода, он благодаря высоким диффузионным свойствам может входить в решетку C2S и тем самым предотвращать переход в ^-модификацию. Однако показано, что в восстановительных условиях обжига образующийся оксид железа (II) вызывает рассыпание синтетического C2S, характерное для процесса образования
Y-c2s.
Наиболее эффективна при низких температурах стабилизации |3-C2S с помощью комбинированных добавок: оксидов фосфора, бария и бора. При применении комбинированных добавок повышается степень разрыхления кристаллов двухкальциевого силиката, что способствует
увеличению запаса потенциальной энергии и соответственно гидравлической активности |3- двухкальциевого силиката. При этом температура стабилизации заметно снижается.
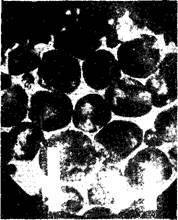
Таким образом, белит представляет собой |3-мо- дификацию двухкальци - евпго силиката (рис. 2), в кристаллическую решетку которого входят различные оксиды — В205, Р205, Na20 и АЬОз и др., причем возможно, что в состав белитовой фазы входит также некоторое количество стабилизованной а'-модифи- кации двухкальциевого силиката [136].
Промежуточное вещество. При исследовании портландцементного клинкера под микроскопом' можно видеть, что между кристаллами алита и бе - лита находится вещество, которое при высоких температурах обжига клинкера было в рас - Это, так называемое, при современном способе холодильниках находится в расплаве в тонких прорастаниях. Торнебом обозначил его целитом, сейчас же это название дается алюмо - ферритам кальция.
|
Рис. 2. Кристаллы бедита |

|
Рис. 3. Темное промежуточное вещество |
|
Плавленном состоянии, промежуточное вещество охлаждения клинкера в |
При исследовании путем травления некоторыми реактивами полированных шлифов портландцементного клинкера в отраженном свете заметно как светлое, так и темное призматическое промежуточное вещество. Обе эти составляющие различаются по отражательной способ
ности. Светлое промежуточное вещество, обладающее наибольшей отражательной способностью, представлено алюмоферритами кальция с высокими показателями преломления, а также сильно обогащенным железом стеклом. Темное призматическое промежуточное вещество (рис. 3) с меньшей отражательной способностью представляет собой трехкальциевый алюминат и клинкерное стекло, которое из-за быстрого охлаждения не успело закристаллизоваться. Промежуточное вещество отчетливо проступает при протравливании поверхности полированного шлифа в течение 1 с при 20°С специальным раствором серной кислоты в этиловом спирте. При помощи других реактивов можно различить в нем железосодержащие фазы, включая обогащенное железом стекло, трехкальциевый алюминат и др.
Алюмоферриты кальция. Кристаллы алюмоферритов кальция характеризуются призматической, либо округлой формой, они от желтовато-бурого до темно-бурого или даже черного цвета. Раньше считали, что химический состав алюмоферритпой фазы клинкера, названной по имени исследователя браунмиллеритом, C4AF. В 1937 г.' Н. А. Тороповым [144] впервые было установлено, что, алюмоферриты кальция в цементном клинкере являются твердыми растворами состава до СбА2Р и что C4AF следует рассматривать как один из промежуточных видов этих твердых растворов. В дальнейшем Н. А. Торопов и А. И. Бойкова определили предельный состав алюмоферритов в виде CsAgF.
Таким образом, по современным представлениям, в серии твердых растворов входят CsA3F, C6A2F, C4AF,' C6AF2. Образование того или иного твердого раствора' будет зависеть от химического состава обжигаемого клинкера. Характерное свойство алюмоферритов кальция— наличие небольшого количества кремнезема в кристаллической решетке твердого раствора и до 4% оксида магния, что придает портландцементному клинкеру темно-зеленую окраску. Общее содержание примесей достигает 13%. Кристаллы периклаза (MgO) можно видеть в полированных шлифах цементного клинкера,' даже не прибегая к травлению. Они образуют округлые' или прямоугольные зерна малых размеров: Если в его кристаллической решетке есть железо, то он приобретает желтую окраску.
Г. С, Рояк [103] показал, что в алюмоферритпой фа-' зе цементного клинкера содержатся щелочи. Введение фтористого кальция в шихту двухкальциевого феррита не изменяет фазового состава, а вызывает только снижение температуры плавления. Однако влияние фторидов на процессы кристаллизации алюмоферритов типа C6A2F и C4AF весьма Существенно и приводит к образованию смеси кристаллов пятикальциевого трехалюмина - та и алюмоферритной фазы, обогащенной оксидом железа.
Трехкальциевый алюминат — темное промежуточное вещество, появляющееся в присутствии щелочей в призматической форме, а если их нет — в прямоугольной. Несмотря на наличие травителей определение содержания трехкальциевого алюмината в клинкере связано с трудностями. О. М. Ас'треева и Л. Я. Лопатникова разработали количественный иммерсионный метод определения СзА в клинкере с помошью прокрашивания. Особо тонко измельченный порошок клинкера прокрашивается специальным спиртовым раствором органического красителя «кислотного ярко-голубого 3». В результате интенсивно окрашиваются только кристаллы С3А, что дает возможность определить их содержание.
Трехкальциевый алюминат неустойчив. Он образует CI2A7 в условиях обжига цементного клинкера при содержании в составе сырьевой смеси минерализатора — фтористого кальция, либо кремнефтористого натрия, кальция или магния, а также в присутствии минерализатора— сернокислого кальция. При этом появляется соединение 3(СаО-Al203)CaS04, которое впервые обнаружено советскими учеными [70]. Установлено образование щелочных соединений трехкальциевого алюмината. ?
Кристаллическая структура С3А еще точно не определена. Предполагают, что в С3А ионы А1+3 в центрах боковых сторон элементарного куба окружены в правильном порядке шестью ионами кислорода. Другие ионы А13+ в центрах граней охватывают плоское кольцо из четырех ионов кислорода. В структуре имеются два вида ионов Са2+: одни, расположенные в углах куба, правильно координированы шестью атомами кислорода, а другие, сгруппированные в небольшой куб внутри структуры, неправильно координированы девятью атомами кислорода. Для структуры в целом характерно наличие примесей в пустотах кристаллических решеток,
О
Имеющих размер около 1,7А. В промышленных клинкерах MgO содержится до 2,5% по массе, С3А растворяет до 9% Na20; наблюдается также способность к растворению незначительных количеств Si02. Для СзА характерно отсутствие полиморфизма.
Пятикальциевый трехалюминат. Это соединение в портландцементном клинкере в виде отдельной фазы не кристаллизуется. Оно растворяется в стекловидной фазе либо входит в состав алюмоферритов кальция. Установлено существование метастабильной фазы а'-5Са0-ЗА1203, которая присутствует в клинкере, полученном при исключительно быстром обжиге. В настоящее время установлено, что рассматриваемое соединение соответствует формуле 12Са0-7А1?03, весьма мало отличающейся по расчету от 5Са0-ЗА1203.
С5А3 = 47,78 % СаО, 52,22 % А1203;
С1гА? =48,53 % СаО, 51,47 % А1203.
С12А7 плавится при 1688 К, но кристаллизуется весьма быстро; он имеет вид округлых зерен или октаэдров и относится к кубической системе.
Стекловидная фаза. При резком мгновенном охлаждении (замораживании) жидкой фазы клинкера теоретически возможное содержание стекла может достичь примерно 25%; практически же стекловидной фазы в клинкере значительно меньше, потому что в реальных условиях она охлаждается со средней скоростью. Стекловидная фаза образуется в результате неравновесных условий кристаллизации клинкерного расплава при охлаждении. Из работ В. В. Тимашева следует, что содержание стекла в клинкере зависит от фактического состава клинкерного расплава (жидкой фазы), его вязкости, поверхностного натяжения. Существенно влияют на способность жидкой фазы к кристаллизации и образованию стекла примесные компоненты, растворяющиеся в жидкой фазе: щелочи, оксиды титана, марганца, хрома и др. Большое значение имеет содержание оксидов магния, уменьшающих количество образующегося периклаза. Состав стекловидной фазы близок к составу эвтектического расплава, %: СаО—54,8, SiO, — 6,0, АЬОз —22,7, Fe203— 16,5.
Присутствие стекловидной фазы можно установить, сопоставив теплоту растворения исследуемого клинкера с аналогичной характеристикой полностью закристаллизованного (отожженного) клинкера, а также под микроскопом при исследовании в иммерсионных жидкостях. Обломки стекла в одном и том же образце клинкера могут иметь различное светопреломление. Это объясняется микроскопической гетерогенностью структуры и неспособностью жидкой фазы достигнуть во время охлаждения равновесия с крупными кристаллами затвердевших фаз.
В полированных шлифах отражательная способность также меняется в зависимости от значения глиноземного модуля. Для того, чтобы отличить стекло от кристаллического темного промежуточного вещества, рекомендуется протравливать поверхность шлифа клинкера раствором едкого калия. Резкое охлаждение клинкера, способствующее образованию стекловидной фазы, создает вместе с тем в ней внутренние напряжения, что является причиной рассыпания клинкера в процессе последующего хранения, однако оно благоприятствует сохранению прочности цемента при его вылеживании.
Прочие составляющие клинкера. Свободный (н е - связа нный) оксид кальция практически всегда содержится в клинкерах в количестве, обычно не превышающем 0,75—1%. Это свидетельствует о неполноте реакций образования силикатов кальция. Свободный оксид кальция в клинкере представлен в виде скоплений или отдельных округлых зерен, часто примерно одинакового с белитом размера; его трудно обнаружить в прозрачном шлифе клинкера, но он хорошо виден в полированном шлифе, так как благодаря округлой форме заметно выделяется на поверхности шлифа. Содержание свободного оксида кальция может быть определено глицератным методом; он очень легко обнаруживается при образовании хорошо видимых фенолятов кальция.
Количество оксида магния частично в виде периклаза в клинкере составляет 1—4% в зависимости от его содержания в исходных сырьевых материалах, главным образом в известняковом компоненте. Теоретическая температура диссоциации углекислого магния при давлении 0,1 МПа составляет 913 К. Оксид магния в зависимости от температуры его получения имеет различную плотность. При обжиге при 1673 К и выше получается неактивная MgO, называемая периклазом, ее плотность 3,58 г/см3; низкотемпературный оксид магния (каустический) имеет плотность 3,3 г/см3.
Количество кристаллического оксида магния в клинкере йсегда меньше расчетного его содержания, так как MgO распределена в цементном клинкере в виде твердого раствора и входит в состав алюмоферритов кальция алита, белита, стекловидной фазы, а также нередко и V трехкальциевый алюминат. Остающийся несвязанным оксид магния является периклазом, содержание которого зависит от количества и состава жидкой фазы, режима обжига и скорости охлаждения клинкера.
Размер кристаллов периклаза в быстро охлажденных клинкерах со значительным содержанием стекловидной фазы меньше, чем в тех же клинкерах, но медленно охлажденных, т. е. близких к равновесной кристаллизации. Объясняется это тем, что растворимость оксида магния в стекле больше, чем в кристаллических алюмофсрритах. В полированных шлифах клинкера обычно применяемые травители на периклаз не действуют, он отчетливо наблюдается в виде светлых угловатых зерен, возвышающихся над поверхностью. Обычно зерна имеют вид прямоугольников или треугольников.
Щелочи. Содержание щелочей в клинкере составляет обычно 0,3—1% и в отдельных случаях достигает 1,5%; количество щелочей зависит от их содержания в исходных сырьевых материалах, а также от условий возгонки в процессе обжига. Подача в печь уловленной электрофильтрами пыли приводит к повышению содержания щелочей в клинкере. Обычно в пыли преобладает оксид калия, оксида натрия содержится, как правило, ■меньше.
Систематические исследования клинкерных систем, содержащих наряду с основными компонентами щелочные оксиды, показали, что эти оксиды прежде всего связывают серный ангидрид. При этом образуются щелочные сульфаты; возможно появление щелочно-суль - фатной фазы, содержащей оба щелочные оксида в примерном молекулярном соотношении К2О:Na20=3:1.
Избыток оксида натрия сверх количества, связанного в сульфате, может быть представлен в клинкере соединением Na20-8Ca0-3Al203 и входить в состав стекловидной фазы. Избыток оксида калия сверх количества, связанного с S03, может содержаться в клинкере как соединение К20-23СаО-12Si02 и находиться в стекловидной фазе. В то же время щелочи могут присутствовать в виде твердых растворов с другими клинкерными фазами. Исследования Г. С. Рояка [103] показали, что
/
/
/
Основное количество оксида калия находится Vj стекле н в трехкальциевом алюминате. К тем же выводам затем пришли и другие исследователи. Установлено также, что соединения натрия могут находиться в составе силикатов кальция, а также четырехкальциевого алюмоферрита. В клинкере, имеющем отношение R20:S03, близкое к единице, не все количество серного ангидрида связано со щелочами, часто оп присутствует в виде сульфата «альция.
Весьма существенно влияют щелочи на образование трехкальциевого силиката. Обычно при заметном количестве калия наблюдается избыток свободного оксида кальция. Объясняется это тем, что К20-23СаО-12Si02 не может вступать в реакцию с СаО и образовывать трехкальциевый силикат. Однако C2S может оказаться недостаточно для связывания этого свободного оксида кальция. При повышенном содержании соединений калия происходит даже разложение C3S по схеме 12(3Ca0-Si02) + К20 = К20-23СаО - 12Si02+13Ca0. Расчет показывает, что каждая десятая доля процента К2О, способная реагировать с силикатами, уменьшает максимально возможное количество C3S на 2,9% и высвобождает 0,77% несвязанного оксида кальция.
Оксиды марганца присутствуют в клинкере, если в качестве сырьевого компонента используют доменный шлак, содержащий обычно соединения марганца. Содержание Мп203 может достигнуть 3%; в этом случае цемент будет коричневым. Установлено, что Мп203 может замещать в клинкере Fe203. Исследования В. В. Тимашева показали благоприятное действие Мп на спекание клинкера. Клинкер из сырьевой смеси, в составе которой есть соединения марганца, нужно обжигать в окислительной среде.
Диоксид титана (ТЮ2) переходит в клинкер обычно из глинистого компонента; содержание его составляет около 1%. Исследования С. М. Рояка показали, что диоксид титана в количестве 1—3% оказывает минерализующее действие, однако только в интервале температур, при котором наблюдается появление жидкой фазы. В этом случае титанаты кальция положительно рлияют на скорость образования трехкальциевого силиката. В его состав они входят, по-видимому, в незначительном количестве, но при этом размеры кристаллов алита увеличиваются. Отмечено также положительное влияние Ti02 на скорость клинкерообразования. М. М. Сычев и В. И. Корнеев, Федоров Н. Ф. [136] обнаружили ТЮ2 в трехкальциевом силикате, а также установили факт образования наряду с алитом второй неизвестной фазы, также содержащей некоторое количество диоксида титана. Они наблюдали рассыпание клинкера, содержащего до 2% диоксида титана, и выявили, что гидравлическая его активность повышается. При содержании 10% ТЮ2 полученный спек полностью Теряет гидравлическую активность.
Пентаксид фосфора (фосфорный ангидрид) содержится в клинкере, полученном из обычного цементного сырья в весьма незначительных количествах (порядка 0,2—0,3%), которые ускоряют процесс твердения портландцемента. Опыт работы некоторых цементных заводов показал, что при попадании в состав сырьевой смеси оксидов фосфора резко понижалась прочность цемента. Часто было трудно установить причину существенного снижения гидравлической активности, так как при обычном химическом анализе оксид фосфора осаждается с полуторными оксидами и тем самым меняет химическую характеристику состава клинкера. Однако при более детальном анализе удавалось обнаружить заметное (около 2%) количество Р205 в клинкере.
Установлено, что фосфаты кальция являются стабилизаторами p-C2S. Известны соединения ЗСаО-Р205- • 4СаО • Р205, а также 5СаО • Р205• Si02, 7СаО • Р205 • 2Si02. При взаимодействии двукальциевого силиката с трех - кальциевым фосфатом, который часто содержится в карбонатном компоненте сырьевой шихты, при температуре около 1673 К образуются твердые растворы благодаря близким размерам ионных радиусов кремния —
О о
0,39 А и фосфора — 0,36 А. Считают, что образующиеся твердые растворы имеют переменный состав: отношения 3Ca0-P205:2Ca0-Si02=l:l, 1:2 и 1:3.
Было выявлено, что алит, вторично обожженный в присутствии фосфата кальция, разлагается на двухкаль - циевый силикат, в твердом растворе которого содержится фосфат кальция и свободный оксид кальция. При стабилизации C2S фосфатами двухкальциевый силикат уже не может вступать в реакцию с оксидом кальция и, следовательно, образовывать алит. А. Е. Шейкин пока - /
Зал, что содержание Р2О5 в алите не должно превышать 0,5%, причем необходимо быстро охлаждать клинкер, чтобы зафиксировать алит в наиболее активной форме. Вредное действие фосфора уменьшается при содержании его в сырьевой шихте в виде фторапатита, либо при введении в состав шихты фтористого кальция. В этом случае также образуется не гидратирующийся фтор- апатит 3(3CaO-P205)-СаР2. Некоторые исследователи считают возможным получение низкоалитового цемента, содержащего до 2,5% фосфорного ангидрида, при быстром обжиге и резком охлаждении.
Сернистые соединения обычно содержатся в глинистом компоненте цементной сырьевой шихты и, особенно, в том случае, если сырьевым компонентом является доменный шлак. Количество серы в пересчете на серный ангидрид (S03) не превышает обычно 0,75— 1%. В исходном сырье сера встречается как пирит, реже в виде сульфатов или органических соединений. Она может поступать в обжигаемую шихту с твердым топливом, либо сернистым мазутом. В процессе обжига, который, как правило, всегда является окислительным, сульфиды окисляются и вступают в реакцию со щелочами, образуя сульфаты щелочей и некоторое количество сульфата кальция. При высоких температурах сульфат кальция может разлагаться, однако появляющийся серный ангидрид взаимодействует с обжигаемой высокоизвестковой шихтой и вновь образует сульфаты. Поэтому в отходящих газах вращающихся печей количество серного ангидрида обычно незначительно; в улавливаемой из отходящих газов пыли содержатся, как правило, сернокислые соединения.
Таким образом, в цементном клинкере (рис. 4) [62] имеется алит, основой которого является C3S; двухкаль - циевый силикат — основа белита; трехкальциевый алюминат и четырехкальциевый алюмоферрит, образующие промежуточное вещество и в том числе стекловидную фазу. Присутствуют диоксид титана в виде твердого раствора в трехкальциевом силикате; оксид магния в виде периклаза, а также в составе твердого раствора в алите, белите, алюмоферрите и трехкальциевом алюминате (кроме того, он входит в состав стекловидной фазы), серный ангидрид в виде сульфатов щелочных металлов, а также сернокислого кальция; щелочи в виде новообразований, являющихся продуктами взаимо-
Действия с двухкальцие - вым силикатом, трехкаль - циевым алюминатом и сульфатом кальция; несвязанный — не вступавший в реакцию, так на - ■ зываемый свободный оксид кальция; примеси фосфорного ангидрида в составе белита и, возможно, алита; оксиды марганца преимущественно в составе алюмоферритов; оксиды хрома в составе силикатов кальция; нерастворимый (в кислоте) остаток, содержащий преимущественно не вступавший в реакцию кремнезем; возможны примеси фтора и хлора. Кроме того, при ненормальном ходе печи могут появиться сульфиды.
Количественное содержание важнейших составляющих клинкера таково (%):
C3S —40—68, QjS — 15—35, С3А — 3—15, C4AF — 10—18, СаОсв<1, MgO—0,5—4,5; S03<1; R20<1; нерастворимый остаток <0,5.
|
Рис. 4. Микроструктура полированного шлифа клинкера, травленного спиртовым раствором азотной кислоты (по данным В. Курдовски) |
Минералогический состав клинкеров для производства специальных портландцементов устанавливается в зависимости от профилирующих свойств, которыми должен обладать данный цемент. Для сравнительной оценки минералогического (фазового ) состава клинкера были предложены эмпирические модули — силикатный и глиноземный. Одним из таких показателей является также коэффициент насыщения кремнезема известью. Для расчета сырьевой шихты на цементных заводах задаются значением КН, а также одного из модулей •— силикатного либо глиноземного. КН определяют в зависимости от совокупности ряда факторов — физико - химических свойств сырья, условий его переработки и обжига клинкера и, главным образом, в зависимости от специального назначения портландцемента, который будет изготовлен ИЗ этого клинкера.
С повышением КН увеличивается при соответствую - щем обжиге содержание алита в клинкере. При высоком численном значении КН, в равной степени как и при высоком значении силикатного модуля, затруднен процесс обжига; чтобы обеспечить полноту реакции образования алита, необходима повышенная температура обжига. Практически удается этого достигнуть не всегда, в клинкере остается повышенное (>1%) содержание свободной извести, соответственно увеличивается количество белита. При высоком значении глиноземного модуля, при прочих одинаковых характеристиках сырьевой шихты, также затруднен процесс обжига клинкера из-за повышенной вязкости жидкой фазы, что замедляет формирование трехкальциевого силиката. Понижение силикатного, а также глиноземного модуля делает обжигаемый клинкер относительно легкоспекаемым и легкоплавким, что может затруднить обжиг. Могут образоваться свары, комья обжигаемого клинкера и настыли на футеровке в зоне спекания.
При расчете сырьевой шихты для производства специальных портландцементов обычно учитывают весь комплекс изложенных обстоятельств и пользуются следующей несколько упрощенной формулой КН, поскольку не всегда можно точно предусмотреть количество свободной извести, которое окажется в клинкере, а также содержание серного ангидрида (S03), так как частично он может улетучиваться с отходящими из печи газами.
Для расчета состава сырьевой шихты пользуются следующей формулой:
Са0 — 1 -65 А12°з — 0 - 35 Fe203 К п — .
2,8 Si02
При обжиге клинкера на твердом топливе присаживающаяся к сырьевой шихте зола несколько понижает КН, так как состав золы обычно характеризуется небольшим количеством оксида кальция при высоком содержании кислотных оксидов — Si02, А1203 и Fe203. Поэтому при расчете сырьевой шихты исходят из повышенного КН в расчете на его снижение в клинкере до нужного предела. Опытный специалист на основе получаемых результатов может безошибочно заранее определить размер снижения КН в этом случае. При применении же беззольного топлива — газа, мазута — значения КН и одного из модулей сырьевой шихты прак-
Тически такие же, как и для клинкера. Клинкеры по минералогическому составу характеризуются как али - товые при содержании более 60% трехкальциевого силиката, нормальные — при 42—60% и белитовые при содержании трехкальциевого силиката менее 42%.
Расчет состава сырьевой шихты можно вести также по заданному минералогическому составу клинкера. При расчете значения КН исходят из того, что образуется алюмоферрит кальция состава c4af. Но это условно, так как состав образующегося алюмоферрита кальция зависит от глиноземного модуля «р» (табл. 1).
|
Таблица 1. Зависимость состава алюмоферритов кальция от величины р
Для пересчета химического состава клинкера на минералогический предложены следующие формулы: % C3S = 4,07C-7,6S — 6,72 А — 1,42 F; % C2S = 8,6S + 5,07A + 1,07F — 3,07 С; % С3А = 2,65 (А —0,64 F) и %C4AF = 3,04F, когда р> 0,64; % С2 (A, F) = 1,10 А + 0,70 F, когда р==с0,64; % CaS04 = 1,70 S03> Где С — содержание СаО за вычетом свободной и связанной в CaSCV, S — содержание Si02, только связанного. КН следует рассчитывать в зависимости от значения р. При р>0,64 расчет ведется по формуле |
(Са0общ—СаОсвоб)—(1,65 А1.203+0,35 Fe203 +0,7 S03) КН= ' (Si02O6Ui-SiOw) '
При р<0,64 образующийся при обжиге алюмоферрит кальция характеризуется переменным составом от C4AF до C6AF2 и C2F. Общей формулой для него может быть С2(А, F), причем его состав можно арифметически представить в виде суммы жС2А и t/C2F, тогда соотношение С : А по массе будет равно 1,1 и С : F == 0,7. КН для такого клинкера рассчитывают по следующей формуле:
(СаОобщ - СаОсвоб) - (1,1 А1203 + 0,7 Fes03 + 0,7 S03) ЯЯ= 2,8 (Si02o6ui-Si02cw^ •
Сопоставление расчетного состава клинкера с фактическим, который определяли новыми методами, в том числе рентгеноструктурным, петрографическим в отраженном свете, либо рациональным химическим показывает, что полученные результаты зачастую существенно различаются. Это объясняется следующими причинами. При расчете минералогического состава исходят из того, что при обжиге достигается равновесное состояние, клинкер полностью закристаллизован и после охлаждения не содержит стекла. Такое допущение неверно, потому что в клинкере содержится стекловидная фаза в количестве, зависящем от химического состава сырьевой шихты, а также от того, насколько резко и быстро произошло охлаждение. Присутствие стекла и примесей изменяют количественное содержание отдельных кристаллических фаз клинкера. Затем, как уже было отмечено, клинкер может содержать в зависимости от значения глиноземного модуля, железосодержащие соединения (алюмоферриты кальция) разного состава от С8АзР до C6AF2. Это обстоятельство, естественно, должно повлиять на количество СзА, а также силикатов кальция. Показано, например, что в зависимости от состава алюмофер - ритов колебания в содержании C3S могут в этих случаях составить от —3 до +5%. Немаловажное значение имеют и щелочи, фосфорный ангидрид и другие примеси. Поэтому расчетный метод позволяет определить только потенциальный (возможный) минералогический состав клинкера.