СОСТОЯНИЕ ВОДЫ В ОРГАНИЧЕСКИХ И НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Вода в кристаллогидратах
Спектроскопическое изучение состояния воды в кристаллогидратах
Изучение состава и строения сольватных оболочек ионов в растворе путем анализа свойств одних только растворов затруднено вследствие наличия других химических процессов (для примера укажем гидролиз и комп - лексообразование). В связи с этим результаты разных авторов, использующих для этих целей ИК-спектроско - пию, часто находятся в противоречии и не могут дать сколько-нибудь определенных сведений о межмолекулярном взаимодействии с водой. Этот вопрос можно также решать путем изучения состояния воды непосредственно в кристаллогидратах.
Основными факторами, влияющими на структуру кристаллогидратов, следует считать водородную связь молекул воды. Однако из довольно большого количества работ, посвященных изучению структуры кристаллогидратов методами колебательной спектроскопии, лишь незначительное число приходится на долю исследований по изучению состояния кристаллизационной воды и образуемых ею связей с ионами. Основная же часть работ посвящена разбору и интерпретации полос анионов как в области их валентных, так и деформационных колебаний [165—178].
Наличие водородной связи воды с анионом не только приводит к изменению колебательных частот самой воды [179], но и вызывает изменение симметрии аниона, что приводит к несовпадению частот одного и того же аниона в различных кристаллогидратах [177—180]. Введение молекул воды в решетку изменяет также упаковку и структуру кристаллогидрата.
Изучение взаимодействия воды с ионами можно проводить, наблюдая поведение полос поглощения в инфракрасном спектре, относящихся к колебаниям молекул воды. Существенны при этом как положение полосы, т. е ее частота, так и форма, ширина и интенсивность. Следует отметить, что полоса деформационных колебаний воды (1600—1700 см-1) оказывается менее чувствительной величиной к образованию водой различных по прочности водородных связей, чем полосы ее валентных колебаний (3000—3800 см-1) [181]. Подобный вывод сделан и Чидамбарамом [182], который на основе анализа структурных данных, полученных методами ЯМР и нейтронографии, для ряда гидратов показал, что в то время как угол между кислородом воды (донор электронов) и двумя атомами-акцепторами электронов при образовании молекулой воды водородной связи изменяется в широком интервале от 80 до 130°, соответствующий угол Н—О—Н колеблется в пределах 105—110°. Расчет энергии деформации угла Н—О—Н показал, что для изменения угла на 50° необходима энергия 0,017 эв. В то же время энергия образования водородной связи О—Н...0 равна 0,0024 эв.
Полоса деформационных колебаний все же смещается, однако незначительно и причем в противоположную сторону по сравнению с полосой валентных колебаний [183].
Частота валентного колебания ОН-группы воды в кристаллогидратах солей с кислородсодержащими анионами коррелирует с расстоянием Н20—О при образовании водородного мостика (О — атом кислорода аниона) [72, 184]. Установлено также, что если для раствора воды в органических соединениях это расстояние составляет в среднем 2,80 А, то в неорганических соединениях оно короче и равно 2,75 А [72].
В большинстве работ по изучению ИК-спектров воды в области ее валентных колебаний (3000—3800 смг1) наблюдается либо одна широкая полоса, либо слабо выраженные максимумы на общей полосе поглощения [185, 186]. Широкая полоса, характеризующая возмущенное колебание О—Н-связи, при понижении температуры до 100°К распадается на ряд отдельных узких полос [186]. Возможно, в кристаллах, которые содержат несколько молекул кристаллизационной воды, расстояния между ОН-группами воды и возмущающими кислородными атомами неодинаковы, что и обусловливает наличие нескольких полос в спектре воды. Однако корреляция между поведением и свойствами полос поглощения валентных и деформационных ОН-колебаний и количеством молекул воды в гидратах не обнаружена [187].
Исследованиями колебательных спектров воды в гид - ратированных кислородсодержащих солях установлено, что частоты колебаний воды в них не совпадают, а изменяются при переходе от одного соединения к другому. Это приводит к выводу о том, что вода находится в связанном состоянии и что на ее колебательное движение оказывает. влияние природа аниона, структура кристалла, сила образуемых водой Н-связей, заряд катиона.
На отсутствие полностью свободных ОН-колебаний и на существование связанных водородной связью молекул воды указывается в работах [187, 188], авторы которых исследовали ИК-спектры неорганических фосфорных соединений и нашли, что частоты выше 3450 смг1 в них отсутствуют.
Для гидратированных перхлоратов Na и Mg, напротив, вода поглощает на частоте выше 3500 см-1 [180], что, по мнению авторов этой работы, свидетельствует о существовании слабых водородных связей.
Частота 3530 см~ найденная Андреевым и Баличевой [189] для перхлоратов типа Ме(С104)2-6Н20, интерпретирована ими как валентное О—Н-колебание молекулы воды в группе Me—Н2О...ОСЮГ. Для сульфатов типа MeS04-7H20 и MeS04-6H20 наблюдается смещение в низкочастотную область полосы поглощения ОН-группы воды, связанной водородной ^вязью с анионом. Из этого следует, что при замене СЮ4 - иона на S042- образуется более прочная водородная связь типа Н20...анион. Аналогичный вывод сделан Пандом [190] при изучении гидратированных солей уранила.
Относительно влияния катиона на колебание ОН-свя - зей воды в кристаллогидратах и спектрального проявления такого влияния в литературе имеются разноречивые данные. Одни либо полагают, что такое влияние незначительно, либо, не изучая этого вопроса, молчаливо принимают, что оно отсутствует [27, 187]. Другие в результате исследований нашли, что в зависимости от природы ка- тиона-комплексообразователя (его заряда и ионного радиуса) изменяются валентные частоты колебаний «связанной» воды [189]. Зависимость степени поляризации связи О—Н в координированных молекулах воды от природы связи Me—Н20, определяемой строением электронной оболочки катиона и величиной его ионного радиуса, установлена Баличевой и Гришаевой [191].
Краткий обзор приведенных данных показывает, что с точки зрения положения молекул воды и образуемых ею водородных связей с анионом и координационных связей с катионом кристаллогидраты изучены крайне недостаточно.
Энергия водородной связи воды
С кислородсодержащими анионами в кристаллогидратах
Кристаллогидраты — довольно обширный класс соединений. Вследствие этого они позволяют изучать изменение структуры молекул воды, составляющих ближайшее окружение катиона, при образовании ею водородной связи с самыми различными ионами и в первую очередь с анионами. Многообразие анионов позволяет, кроме того, выбрать для исследования те из них, которые в качестве про - тоноакцептора содержат функциональные группы С = 0, S = О, Р = О, N = 0, т. е. группы, входящие в состав исследованных нами органических соединений. В таком случае представлялась возможность не только сопоставить между собой прочность образуемых ими водородных связей, но и сравнить протоноакцепторные свойства одних и тех же групп, входящих в состав как органических, так и неорганических соединений.
Наряду с преимуществами указанный метод имеет, однако, ряд недостатков. Это методические трудности по выращиванию монокристаллов, возможные обменные взаимодействия при прессовании таблеток, обнаруженные нами взаимодействия солей с вазелиновым и особенно фторированным маслами [192]. Наконец, при исследовании кристаллогидратов, как и всяких кристаллов, необходимы сведения о кристаллической структуре анализируемого вещества.
Помимо этого изученные кристаллогидраты в ряде случаев имеют сложную картину спектра в области валентных О—Н-колебаний воды. Причины этого явления были обсуждены в главе I.
Обращает на себя внимание тот факт, что спектр всегда упрощается для кристаллогидратов, содержащих в качестве катиона Na и К, т. е - элементы, обладающие от
носительно малым зарядом и большим ионным радиусом. Поэтому подбором именно таких катионов мы старались свести возможное влияние катиона до минимума вследствие того, что полностью исключить или учесть это влияние на взаимодействие воды с анионом в настоящее время не представляется возможным.
Сведений относительно кристаллической структуры изученных нами кристаллогидратов в литературе мало, поэтому строгий учет влияния этого фактора на состояние воды для всех соединений не проводился. Вместе с тем мы сочли возможным, выбирая для рассмотрения и расчета энергии наиболее простые спектры и усредняя результаты, все же изучить возмущающее действие различных анионов на молекулы воды. Анион в таком случае представлял собой некоторую изолированную, усредненную, т. е. гипотетическую единицу, поэтому расчет энергии взаимодействия воды с анионом следует считать приближенным. Однако, как и в случае органических соединений, интерес может представлять и относительное изменение прочности водородной связи для различных анионов.
Рассмотрение ИК-спектров поглощения кристаллов показало, что полосы поглощения в области валентных колебаний воды для некоторых солей имеют сложную структуру.
|
|
|
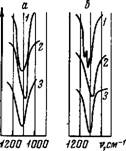
Рис. 25. Полоса поглощения валентных колебаний ClCVrpyn - пы в спектрах некоторых пер - § хлоратов | А — NaC104, б-Мв(СЮ4)2 /-без - водные соли; 2 — кристаллогидрат § Ме(СЮ4)п-Н20, 3 — водный рас - ^ твор |
Анализ характера изменения полос поглощения валентных колебаний С104-групп в спектре безводного NaC104 и кристаллогидрата NaC104H20 (рис. 25, табл. 11) показывает, что при переходе от безводной соли к кристаллогидрату происходит понижение симметрии перхлорат-иона. Заметное расщепление рассматриваемой
|
Таблица 11 Частоты максимумов полос поглощения валентных колебаний С104-групп некоторых перхлоратов (слт1)
|
Полосы в спектрах безводных перхлоратов других металлов, связанное с деформацией иона вследствие координационной связи между катионом и одним или несколькими атомами кислорода, уменьшается при переходе к кристаллогидратам. Характерно, что спектры анионов большинства исследованных кристаллогидратов аналогичны спектрам NaC104-H20 и содержат низкочастотную компоненту, положение которой не зависит заметным образом oi природы катиона соли. Это можно объяснить не только ослаблением влияния поля катиона в присутствии воды, но и образованием связи между анионом и водой, что подтверждается исследованием спектров поглощения воды.
В спектрах водных растворов полосы поглощения С104-групп перхлоратов различных металлов симметричны и заметно не отличаются от соответствующей полосы в безводном NaC104. Это свидетельствует о высокой локальной симметрии ионов в водных растворах и отсутствии сильных связей между молекулами воды и перхлорат - ионом. Исчезновение низкочастотной компоненты рассматриваемой полосы поглощения при переходе от кристаллогидратов к водным растворам указывает на ослабление взаимодействия между молекулами воды и анионом. Это, по-видимому, можно объяснить различием в расположении молекул воды вблизи аниона в кристаллогидратах и водных растворах. Действительно, исследования кристаллогидратов рентгеноструктурными и ней - тронографическими методами [193, 194] показывают, что молекулы воды располагаются в кристаллической структуре лишь в строго определенных положениях. Указанные стерические препятствия приводят к осуществлению в кристаллогидратах водородной связи между водой и анионом, хотя она и менее энергетически выгодна, чем связь вода — вода. В водных же растворах стерические затруднения, связанные с кристаллической структурой, снимаются и более энергетически выгодная связь вода — вода реализуется в значительно большей степени, чем связь вода — анион.
Как известно, для каждого типа молекул воды в области 3100—3800 смгх должны наблюдаться по крайней мере три полосы поглощения (симметричные, асимметричные валентные колебания и обертон деформационных колебаний). Сдвиг частот валентных симметричных колебаний и валентных асимметричных колебаний ОН-групп молекул воды в растворах относительно соответствующих частот полос поглощения в спектре водяного пара зависит от величины энергии связи между молекулами воды и молекулами растворителя. Разность между частотами симметричных и асимметричных валентных колебаний определяется симметрией образующихся комплексов. В чистой воде, находящейся в жидком состоянии, все ОН-группы молекул воды приблизительно равноценны, разность частот симметричных и асимметричных колебаний близка к 100 см-1, но так как полосы имеют большую полуширину, то структура суммарной полосы проявляется весьма слабо. Однако даже при небольшой асимметрии в энергиях связи ОН-групп молекулы воды с окружением разность частот симметричных и асимметричных колебаний заметно увеличивается, и структура суммарной полосы фиксируется достаточно четко. При увеличении энергии связи молекул воды с окружением происходит не только сдвиг полос, но и изменение их относительной интенсивности и полуширины.
Сопоставление полученных спектров кристаллизационной воды в перхлоратах со спектрами молекул воды, различным образом связанных с окружением [140], позволяет отнести более интенсивную высокочастотную полосу поглощения (3640—3520 см-1) к асимметричным, а низкочастотную (3450—3440 см-1) к симметричным колебаниям ОН-групп молекул воды. При переходе к концентрированным растворам на низкочастотную полосу на-
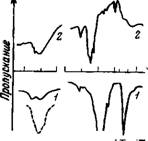
Рис. 26. ИК-спектры поглощения прессованных таблеток перхлоратов (1) и нитратов (2) (пунктиром показано поглощение жидкой воды)
Кладывается полоса поглощения жидкой воды. Интенсивный рост поглощения в области 3460—3480 см~1 при повышении содержания воды в растворе свидетельствует о правильности такого отнесения. Проверку интерпретации можно сделать также с помощью концентрированных водных растворов, что было проведено в работе [27] для перхлоратов.
Аналогично можно приписать наблюдаемые полосы воды в ИК-спектрах сульфатов, фосфатов, карбонатов и т. д. симметричным и асимметричным колебаниям молекулы воды.
Рассмотрение спектров поглощения перхлоратов и нитратов главным образом щелочных металлов дает возможность сделать следующие заключения. В их спектрах имеются все разрешенные по симметрии полосы, соответствующие колебаниям анионов N03~ и ClOI [173, 195— 200] (рис.26).
В спектре нитратов также имеет место расщепление колебательных частот аниона. В результате наблюдаются следующие полосы: 835 см~1 (V2); 1065 см~х (vi); 1360, 1390, 1460 см-1 (v3).
|
L-J—1—I I—I—H III i, 3800 3000WOO 800 500 цсм~* |
Широкая полоса в области 3400—3640 см~1 и для перхлоратов, и для нитратов имеет два слабо разрешенных максимума. Полосы воды в ИК-спектрах перхлоратов смещены в высокочастотную область, и расчет энергии водородной связи молекул воды по формуле [126] дает два значения (табл. 12), одно из которых совпадает с энергией связи вода — вода (в среднем 4,6 ккал/связь), а другое меньше его (~2,0 ккал/связь). Перхлораты двухвалентных катионов Mg, Zn, Fe, Са, Со и др. изучены в ра-
|
Таблица 12 Энергия водородных связей воды с различными аннонамн в кристаллогидратах
|
|
Примечание. Ejj рассчитано по [126], ец — по [104]. |
Боте [173]. Полученные авторами значения энергии водородной связи воды с перхлорат-анионом лежат в пределах 1,4—3,4 ккал/моль, что близко к значению, определенному нами.
По своему возмущающему действию на молекулы воды нитраты ведут себя аналогично перхлоратам. Энергия более прочной Н-связи воды для них около 4,2 ккал/связь, менее прочной в среднем 2,3 ккал/связь. Последнее значение оказывается меньше величины энергии связи между двумя молекулами воды, но несколько больше или равно значению энергии такой же связи в перхлоратах (средняя ошибка определения энергии составляет 3—5%, поэтому разница в значении 0,3 ккал/связь сопоставима с относительной ошибкой подсчета энергии).
Ввиду отсутствия гидратированных кристаллических хлоридов Na и К изучение влияния иона С1~ на ИК-спектр кристаллизационной воды проведено нами для соединений с двухвалентными катионами. При этом в спектре
|
I II. , I _| L Mo Z6qo mo 700 m зоо |
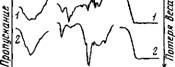
Рис. 27. ИК-спектр поглощения хлоридов щелочноземельных металлов (пунктиром показано поглощение жидкой воды)
Рис. 28. ИК-спектры поглощения и термогравиограммы гидратиро - ванных солей натрия
/ — карбонат; 2 — вольфрамат
Воды (в области валентных ОН-колебаний) четко обнаруживаются два максимума у 3440 и 3600 смг1 (рис. 27). Имеется неявно выраженный перегиб 3270 смг1, который, возможно, представляет собой обертон деформационного колебания молекулы воды. Как показал расчет, энергия менее прочной Н-связи составляет 2,3—2,6 ккал/связь. Такая малая величина энергии хорошо согласуется с известным фактом о длине связи НгО—С1 в кристаллогидратах с двухвалентными катионами Mg, Со [201]. Она велика и составляет 3,18—3,21 А.
Таким образом, анионы СГ, С ЮГ', N07 образуют водородные связи с кристаллизационной водой с энергией, лежащей в пределах 1,8—2,6 ккал. Такие ионы, согласно с теорией растворов Самойлова [15], называются отрицательно гидратирующимися, так как приводят к разупорядочению структуры воды.
|
|
|
I 'V ' I. I ' ■ ............... ....................... |
|
400 3000 ZOOO 800600 V, CM- |
В ИК-спектрах вольфраматов (W042-) (рис. 28) в области валентных колебаний воды отсутствует высокочастотная компонента (выше 3450 смг1), которая наблюдалась в спектрах рассмотренных выше перхлоратов, нитратов, хлоридов. Однако максимум у 3450 смг1 на широкой полосе поглощения воды сохраняется. При расчете энергии оказалось, что величина ее для одной Н-связи, как и прежде, составляет 4,5—4,7 ккал, а для другой 6,0— 6,3 ккал. Таким образом, Н-связь молекулы воды более прочная, чем водородная связь между двумя молекулами воды. Ионы, которые укрепляют связь молекул воды, составляющих ближайшее окружение иона, с молекулами второго гидратного слоя, т. е. обусловливают упдрядоче-
ние структуры воды, называются положительно гидрати - рующимися ионами.
В спектре карбонатов щелочных металлов интересующая нас широкая полоса валентных колебаний ОН-групп заметно смещена в область низких частот (см. рис. 28), что свидетельствует об упрочнении водородной связи воды с анионом. Характеристические полосы поглощения аниона СОз2- в изученных кристаллогидратах Na и К имеют частоты при 690, 700 (сл.) см~1 (v4), 875, 910 см~1 (V2), 1030, 1075 (обе сл.) смгх (vi), 1415, 1450 смг1 (v3), которые совпадают или близки к частотам, наблюдаемым в работах [202, 203].
Для расчета энергии Н-связи воды нами были использованы частоты, лежащие в интервале значений 3260— 3290 и 3420—3450 см~х. Полученные значения энергии приведены в табл. 12. Как и для вольфраматов щелочных металлов, уход воды из карбонатов тех же элементов происходит одной порцией, что на термограмме (см. рис. 28) отражено в виде одной ступени. В качестве сульфатов нами были выбраны и изучены соли двухвалентных щелочноземельных элементов, а также Mg, Be, Fe, Zn и Al.
|
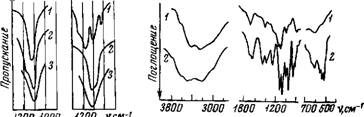
Рис. 29. Полоса поглощения валентных колебаний S04-rpynnH в спектрах некоторых сульфатов A — Na2S04; б —MgS04; /—безводные соли; 2 — кристаллогидрат MenSOr ■ 7НгО; 3—водный раствор |
|
Рис. 30. ИК-спектры поглощения таблеток BeS04 • 4Н20 (/) и Na3P04 - • 12Н20 (2) |
Проведенные исследования спектров безводных солей и кристаллогидратов некоторых сульфатов (рис. 29, табл. 13) показали, что локальная симметрия иона S04 при переходе от безводного Na2S04 к кристаллогидратам понижается, но для сульфатов некоторых других метал-
А 0
|
Таб лица 13 Частоты валентных колебаний S04-rpynn некоторых сульфатов (см-1)
|
Лов (Mg, Zn, Li, Ni) происходит повышение симметрии. В растворах всех исследованных сульфатов в области валентных колебаний S04-rpynn наблюдается одиночйая симметричная полоса поглощения, но она несколько смещена относительно соответствующей полосы в безводном Na2S04. Характер изменения спектров позволяет сделать выводы о связи анион — вода в сульфатах, аналогичные выводам, полученным при анализе спектров перхлоратов, с той лишь разницей, что в водных растворах связь вода— анион ослабляется для сульфатов в меньшей степени, чем для перхлоратов.
Для расчета энергии водородных связей, образуемых водой с сульфат-анионом, были использованы наблюдаемые в спектрах частоты 3200—3290 и 3440—3470 смг1 (рис. 30). Полосы воды с аналогичными частотами наблюдались Баличевой и Андреевым для кристаллических сульфатов Mg, Ni, Zn, Fe, Co [189]. Они, кроме того, наблюдали полосу 3240—3160 см~ которая, очевидно, представляет собой обертон деформационного колебания молекулы воды.
Результаты проведенного расчета энергии Н-связи для кристаллогидратов, содержащих сульфат-анион, показывают, что ион S042- сильно связывает воду (см. табл. 12). Эта энергия в среднем равна 7,4—8,4 ккал/связь, что совпадает со значениями, приведенными в работах [27,140]. Полученным значениям энергии соответствуют водородные связи H20...0S032- длиной 2,82—2,58 А [204—206].
Следует, однако, ожидать, что для рассмотренного случая будет велико влияние катионов, которые имеют эффективный радиус (Tie/R, где е — заряд, г — ионный радиус элемента) значительно больший, чем у Na. Следовательно, катион будет сильно поляризовать ОН-связи молекулы воды. Поэтому следует полагать, что энергия взаимодействия воды с сульфат-анионом для щелочных металлов близка к соответствующей энергии для карбонат-аниона. Наблюдаемые нами полосы аниона имеют те же частоты, что и в работах [174, 177, 196].
ИК-спектры поглощения фосфатов, в том числе и область поглощения ОН-групп, изучались ранее [167, 187]. При этом авторы отмечали отсутствие частот, соответствующих полностью свободным ОН-группам.
Колебания аниона характеризуются следующим набором характеристических частот: 525, 545, 618 см (v4); 955 см-1 (vi); 1080, 1160 смг1 (v3). Расщепление частот происходит вследствие нарушения симметрии тетраэдра РО43- и снятия вырождения [197, 207].
Валентные колебания ОН-групп воды в спектре фосфатов характеризуются широкой полосой, охватывающей область 2700—3800 см-1, причем она сильно смещена в область низких частот (см. рис. 30). Интенсивными являются полосы, относящиеся к колебаниям несвязанных гидроксильных групп (3600 см-1) и ассоциированных друг с другом молекул воды (3470 см-1). Такую же интенсивность имеют и полосы 3180 и 3400 смг1.
Необходимо заметить, что если во всех предыдущих случаях наиболее простые ИК-спектры в области валентных ОН-колебаний наблюдались для натриевых и калиевых солей, то для трехзамещенного фосфата натрия (Na3P04- 12НгО) в изучаемой области наблюдается широкая полоса с несколькими максимумами. На термограмме этой соли также обнаруживается более чем одна ступень при дегидратации. Не исключена возможность того, что усложнение спектра происходит из-за большого числа 'молекул воды, входящих в структуру кристаллогидрата.
За основу для определения энергии образуемых водой Н-связей были взяты частоты 3380—3410 и 3170— 3200 см~1. Частота, Относящаяся к ассоциатам ёодй — вода (около 3470 см~1), хотя и имеется в спектре, однако для расчета энергии не учитывалась.
При расчете оказалось, что, как и в предыдущих случаях, молекула воды образует двумя атомами водорода неравноценные по прочности Н-связи. Энерлия наиболее прочной связи оказалась самой большой — в среднем около 8,8 ккал/связь — по сравнению с соответствующими связями типа НгО... анион в кристаллогидратах с другими. анионами. Энергия другой связи в среднем 5,6 ккал/связь. Таким образом, среди рассмотренных анионов, вступающих в водородную связь с молекулами воды, фосфат-анион является самым сильновозмущаю - щим (см. табл. 12). В таблице представлены приближенные значения энергии Н-овязи, рассчитанные по формулам, приведенным в работах [99] и [126]. Эти значения практически совпадают между собой. Это и не удивительно. Оба соотношения учитывают одно и то же свойство: смещение частоты ОН-колебания воды при образовании ею водородных связей.
Из сопоставления результатов, представленных в табл. 12, следуют два вывода. Первый заключается в том, что молекула воды в изученных кристаллогидратах образует неравноценные по ОН-связям водородные связи. Для нитратов, хлоридов, карбонатов, вольфраматов и фосфатов энергия одной из связи совпадает с энергией водородной связи, образуемой между собой молекулами воды. Другая же связь в нитратах, хлоридах и перхлоратах слабее, а в карбонатах, фосфатах, вольф - раматах и сульфатах прочнее, чем связь Нг0...Н20.
Поскольку исследованы кристаллогидраты с различными анионами и катионами, с несовпадающими типами кристаллической структуры, можно полагать, что в любом кристалле, содержащем воду, независимо от числа входящих молекул воды имеют место дза типа водородных связей: НгО...НгО и НгО...анион. На основании этого можно сделать предположение о существовании в кристаллогидратах комплексов типа
^Н... А
Где А — анион.
Второй вывод состоит в том, что хотя приведенные в табл. 12 результаты являются весьма приближенными и усредненными для ряда солей с одинаковым анионом, но различными катионами и другими параметрами, можно по возмущающему действию на воду изученные анионы расположить в определенной последовательности. Анионы, разрушающие структуру воды (отрицательно гидратирующиеся ионы):
CI07<N0~<CI -
Анионы, укрепляющие структуру воды (положительно гидратирующиеся ионы):
WO*" < СО*- < SOf <POJ-
Каковы же причины того, что кислородсодержащие анионы, образующие водородную связь с протоном воды посредством неподеленной пары электронов атома кислорода, образуют разные по прочности связи? Вероятной причиной может быть увеличение эффективного отрицательного заряда аниона при переходе от перхлоратов, нитратов к карбонатам, сульфатам и затем к трех - зарядным фосфатам.
Возможно, влияние на прочность водородных связей оказывает природа анионообразующего элемента (S, C1, Р и т. д).
В работе [208] при изучении взаимодействия солей алкиламина было высказано предположение, что смещение полосы поглощения гидроксила метанола зависит от характера связи между катионом и анионом соли, от степени ионности связи аниона с катионом алкиламмо - ния. Было найдено, что с увеличением ионности связи увеличивается смещение полосы ОН-группы.
Сопоставим величину энергии Н-связи различных анионов с их степенью ионности, предварительно введя определение этого понятия. Под степенью ионности связи будем понимать смещение электронной плотности связи от середины межатомного расстояния в сторону одного из партнеров. В литературе имеются указания на связь между степенью ионности связи Э—О и электроотрица - тельностями этих элементов (204]. Уменьшение электро - отрицательности элемента (Э) соответствует увеличению степени монности связи Э—О, следовательно, эффективного отрицательного заряда на атоме кислорода. В ряду анионов С107—*N07-+C032-—>S042-—*Р043- электроотрицательность анионообразующих элементов CI—>-N—>-С, S—>-Р изменяется в последовательности 3,1—>-3,0—>-2,6—>-2,1. Электроотрицательность атома О 3,5. Таким образом, в ряду элементов С1—»-Р электро - огрицательность их уменьшается, следовательно, разность электроотрицательностей (%0—%э) увеличивается. Это и обусловливает увеличение ионного характера связи Э—О, при котором электронная плотность все больше смещается к атому кислорода, который ответствен за водородную связь с водой.
По величине энергии водородной связи с водой анионы N03~, РОГ", СО32", S042- располагаются в последовательности N0r<C032-^S042-<P043-. Оказывается, что она полностью совпадает с аналогичной последовательностью для групп NO2, СО, SO, РО органических соединений.
Если же сопоставить энергию взаимодействия с водой этих групп, в органических соединениях, с одной стороны, и в кристаллогидратах — с другой, то обнаруживается, что для соответствующих функциональных групп энергия Н-связи в кристаллогидратах в 2—2,5 раза выше, чем в органических соединениях. Очевидно, в случае кристаллогидратов сказывается влияние кристаллического поля решетки, а также координация атома кислорода молекулы воды к катиону.
Наряду с частотой валентных ОН-колебаний воды представляет интерес проанализировать положение полосы деформационного ее колебания для изученных кристаллогидратов [27, 181, 183]. Частоты этих полос приведены в табл. 14. Из таблицы следует, что деформационные частоты чувствительны к изменению прочности образуемых водой водородных связей. При переходе от перхлоратов к фосфатам они испытывают смещение, хотя менее значительное, чем частоты валентных колебаний. Таким образом, для изученных нами кристаллогидратов с увеличением прочности водородных связей воды с анионом происходит смещение частот и валентных и деформационных колебаний молекулы воды. Смещения имеют, однако, противоположные направления.
|
Таблица 14 Частоты колебаний молекулы кристаллизационной воды (слг1), Возмущенной водородными связями с различными анионами
|
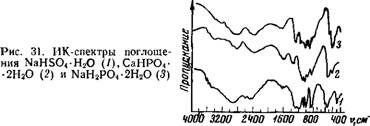
Для более полного рассмотрения влияния анионов на состояние воды в кристаллогидратах следует изучить кислые гидратированные соли, в которых не все протоны замещены катионами. ИК-спектры поглощения гидрати - рованных кислых сульфатов, одно - ,и двухзамещенных фосфатов очень сложны и имеют много полос (рис. 31),
|
|
Это происходит в результате того, что анионы в данных солях имеют низкую симметрию. Если симметрия тетра - эдрических групп Р043~ и S042-—Td, то у HS04 И НР042-— С3„ [242, 243]. В спектре двухзамещенного фосфата полосы, относящиеся к колебаниям аниона, еще больше расщепляются, так как_ симметрия НгРС^-иона С2», т. е. еще ниже, чем у HSOT и НР042- [209].
В спектрах указанных солей имеется интенсивное поглощение в виде широкой полосы в области 2600— 3100 см~х для фосфатов и 2700—3300 см~х для сульфата. Наиболее разумное объяснение существования этих полос, на наш. взгляд, следующее: имеет место сильное взаимодействие молекул (воды с протоном аниона. Существование двух типов молекул воды, входящих в кристаллическую решетку СаНР04-2Н20, было обнаружено и в работе [210]. Не исключена возможность образования сильной внутримолекулярной водородной связи. Однако авторы работы [211] склонны рассматривать полосы в области 2000—3000 смг1 для кристаллов, содержащих группы НгХОГ, HCQi, ШОГ, как проявление составных частот этих групп.
Вызывает интерес тот факт, что при взаимодействии анйона с водой происходит гидратация протона аниона с образованием «она гидроксония НзО+. О наличии ©го можно судить по имеющемуся в спектрах кислых солей поглощению в области 2700—3100 и — 1750 см-1 и слабому поглощению при 2100 и 2200 см-1 [140].
Влияние природы катиона
И места расположения в кристаллической решетке молекул воды на ее энергию взаимодействия с анионами. Кристаллографическая и термогравиометрическая характеристика кристаллогидратов
Известно, что кристаллогидраты — один из наиболее сложных объектов исследования. Несмотря на то что проведены многочисленные исследования этих соединений, полученные результаты в большинстве случаев не однозначны, особенно если речь идет об изучении состояния воды. Дело в том, что в работах, появившихся в печати в последнее десятилетие, было показано, что на состояние воды в кристалле оказывает влияние целый ряд факторов: донорно-акцепторное взаимодействие между анионами и молекулами воды, кристаллическая структура и место расположения воды в кристаллической решетке, природа и свойства катиона.
Относительно катиона установлено, что такие его характеристики, как заряд, радиус и строение электронных оболочек, оказывают влияние на поляризацию О—Н-связи молекул воды, образующих ближнее гидратное окружение катиона [189, 191].
Вместе с тем при изучении ИК-спектров кристаллогидратов нами было обнаружено, что при взаимодействии воды с анионом посредством. водородной связи су-
|
3600 Z800 цсм-1 3800 3000 1Б00 BOO 700 Vtcnri Рис. 32 ИК-спектры поглощения валентных колебаний воды в соединениях: / — A12(S04)s-18H20. 2 — ZnS04-7H20; 3 — А1Р04-ЗН20, 4 — KSC03-2H20 |
Рис. 33 ИК-спектры поглощения семиводных сульфатов магния (/), железа (2) и цинка (3)
Щественным оказывается не только величина эффективного заряда катиона (пе/г), не только строение его электронной оболочки, но и способность к гидролизу [213]. Так, в ИК-спектрах поглощения ZnS04-7H20 и A12(S04)3- 18Н20, приведенных на рис. 32, наблюдаются очень широкие полосы валентных колебаний воды, причем они, почт, и не разрешены, и поглощение в области 2900—3700 см-1 представляет собой огибающую многих полос. Катионы Zn и А1 как раз обладают склонностью к гидролизу. Для сравнения на том же рисунке приведен ИК-слектр образца К2С0з-2Н20.
Уширение полосы поглощения воды может быть обусловлено наличием большого количества молекул воды, различным образом расположенных относительно катиона и аниона, следовательно, набором различных по прочности ассоциатов. Однако обсуждаемое уширение имеет место и в случае А1Р04-ЗН20, где содержание воды весьма мало. Более того, в спектрах семиводных сульфатов магния, железа и цинка число молекул кристаллизационной воды одинаково, координационное число катиона в этих солях также одинаково, однако в случае ZnS04-7H20 суммарная полоса поглощения воды значительно шире, чем для соответствующих кристаллогидратов Mg и Fe (рис. 33).
Экспериментальные данные свидетельствуют о том, что природа катиона, в частности его эффективный радиус, ответственна за несколько различную добавочную поляризацию окружающих катионы молекул воды Это обуславливает небольшое отличие ® энергиях водородных связей воды с анионом для различных катионов. Так, для сульфатов Be, Mg, Fe, Zn, Zr, А1 эта энергия лежит в интервале значений 7,2—8,4 ккал/связь. Однако вывод нельзя считать строго обоснованным, ибо для изученных соединений изменяется не только природа катиона, но изменяются также и другие параметры - кристаллическая структура, число содержащихся молекул воды. Имеются два пути некоторого преодоления указанных трудностей. Первый — выращивание большого числа изоструктурных монокристаллов с различными катионами. Это успешно осуществлено и описано в работах Баличевой с соавторами. Второй — исследование тройных систем вода — органический растворитель — соль В этом случае также устранено влияние поля кристаллической решетки
Прочность водородных связей воды существенно зависит от расположения ее в кристаллической решетке, и более удаленные от ионов молекулы воды обладают меньшей энергией Н-овязи Однако относительно влияния структуры кристаллов на колебательный спектр водородной связи, в литературе имеется незначительное число работ В частности, в работе (214] были изучены спектры комбинационного рассеяния шести - и семивод - ных сульфатов магния, никеля и цинка Найдено, что спектры изоструктурных семиводных сульфатов сходны, в то же время спектр шестиводного сульфата никеля отличается от спектра семиводного аналога этой соли
В других работах [189, 191] этот вопрос не был предметом специального изучения, однако для исследования авторы выбирали изоструктурные кристаллы
При определении энергии водородных связей, образуемых водой с анионами в кристаллогидратах, ,в ряде случаев мы столкнулись с трудностью выбора частот для этих целей. Трудность эта была связана с тем, что в области валентных ОН-колебаний наблюдалась сложная картина спектра В частности, это имело место в случае семиводных сульфатов магния, железа и цинка, для которых ib ИК-спектрах в области валентных ОН-колеба ний наблюдается четыре полосы.
Проведенное нами сопоставление ИК-спектров воды с расположением ее 'молекул в кристаллической решетке позволило показать, что ©ели молекулы воды рентгенографически не равноценны, то их ИК.-спектры усложняются. Кристаллическая структура для указанных соединений установлена и достаточно подробно изучена [205, 206], и на их примере отчетливо видна эта зависимость В качестве примера рассмотрим поглощение воды в случае FeS04-7H20.
Это соединение относится к группе кристаллогидратов, в которых имеются дополнительно молекулы воды кроме тех, которые координированы вокруг металла [215]. Эти добавочные молекулы воды действуют как вторичные цепи, соединенные посредством Н-связей, с одной стороны, с молекулами воды, координированными катионом, а с другой — с атомами кислорода анионов. Кристаллогидрат FeS04-7H20 имеет моноклинную син - гонию [205]. Ион Fe2+ окружен октаэдрически шестью молекулами воды каждый Эти шесть молекул воды образуют водородные связи с атомами кислорода тетраэд - рической сульфатной группы и седьмой молекулой воды, не координированной катионом На рис. 34 изображена схема водородных связей рассматриваемой системы
В ИК-спектре этой соли в области 3000—3700 емт1 наблюдаются четыре полосы (см. рис. 33) вместо обычных двух. В свете ранее изложенного можно полагать, что существование четырех полос в ИК-спектре валентных ОН-колебаний воды свидетельствует о наличии более чем двух различных по прочности водородных связей По всей вероятности, две из них относятся к ОН - колебаниям шести (молекул воды, координированных катионом и расположенных на расстоянии 2,12А, а две другие— к колебаниям кристаллографически неравноценной седьмой молекулы воды, которая отстоит от катиона на расстоянии 2,19А Это предположение было проверено данными по термогравиометрии.
При нагревании образца до 500° С на термогравио - грамме появляются две ступени, которые также можно отнести за счет существования двух типов связанной воды Ступенчатая дегидратация образца привела к последовательному удалению сначала слабосвязанной, а за-
|
(Q) 0 Воды Qoаниона ©S OFe ^—^— Рис. 34. Схема водородных связей кристалла FeS04-7H20 |
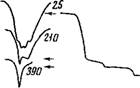
Тем и сильносвязанной воды из кристалла. При этом после частичной дегидратации записывался ИК-спектр, который упрощался после удаления первой, менее связанной порции воды, соответствующей первой ступени термограммы. ИК-спектры, полученные для FeS04-7H20 исходного, прогретого до 210 и 390° С (т. е. после удаления наиболее связанной воды), приведены на рис. 35,
Следует отметить, что первый этап нагревания привел к исчезновению двух ПК-полос поглощения с частотами 3380 и 3560 еж-1, ,в результате чего, в слектре остались лишь полосы 3260 и 3460 смгх. По частотам двух оставшихся полос был проведен расчет энергии Н-связи наиболее прочно связанных с анионом молекул воды. Она оказалась в среднем равной 7,5 ккал/связь. Энергия же менее сильной Н-связи воды была найдена равной около 5,6 ккал/связь.
|
|
|
3800 "3000 |
|
100 |
|
300 500 T,°c |
|
Из I |
|
I I I |
Рис. 35. ИК-спектры поглощения воды при различных температурах и термогравиограм - ма FeS04-7H20 (цифры на кривых — температура в °С)
Присутствие полосы 3460 см~х обязано колебаниям ОН-связей молекул воды, ассоциированных друг с другом с энергией 4,5 ккал/связь. Интересно отметить, что эта полоса после прогревания образца до 120° С хотя и остается, но изменяется по форме. В виде очень резкой, узкой и интенсивной полосы она остается в спектре образца, прогретого до 390° С, когда уходит даже наиболее прочно связанная вода, что видно из рис. 35. Остается предположить, что она относится к гидроксильной группе, природа появления которой неизвестна. Полоса в ИК-спектре исчезает при нагревании образца до температуры около 600° С.
На основании проведенных определений энергии и рентгенографических данных для кристаллогидрата FeS04-7H20 схему взаимодействия воды можно представить следующим образом:
/Н...OSOf /Н...О(
Fe»+...o/ Nh NH...OSOf"
Таким образом, удачное сочетание методов рентгенографии, термогравиометрии и ИК-спектроскопии позволя
ет решать вопрос о состоянии воды и энергиях образуе - мых ею водородных связей в кристаллогидратах. Более того, полученные такими методами результаты в ряде случаев позволяют установить или уточнить структуру кристаллогидратов.
Состояние воды в легкогидролизующихся соединениях циркония и гафния
В предыдущем разделе рассматривался вопрос о влиянии катиона, в частности его гидролизующей способности, на прочность водородных связей вода — анион в кристаллогидратах. Цирконий и гафний также являются легкогид - ролизующимися элементами, и более детальное изучение состояния воды и ее связи с анионом и катионом в соединениях Zr и Hf может дать дополнительные сведения по структуре этих кристаллов.
Структура соединений циркония и гафния исследовалась ранее в целом ряде работ. Методом рентгеноструктур - ного анализа изучена кристаллическая структура двуокиси и гидрата окиси циркония [216, 217], оксихлорида цир кония [218, 219], сульфата циркония [220] и других соединений [221, 222].
Определенный вклад в изучение строения этих веществ внес и метод инфракрасного поглощения [223—228]. В результате исследований в ряде работ было показано наличие связи Ме = 0 в некоторых соединениях Zr и Hf [229—231]. Однако в большинстве соединений, и главным образом в простых (не комплексных), таких группировок не обнаружено.
В качестве объектов исследования нами были взяты Zr(S04)2-4H20 (ч. д.а.); Zr(0H)2S04-4H20 (получен по методу, описанному в работе [224]); НЮС12-8Н20; Zr0Cl2-8H20, Zr0(N03)2-2H20 и Hf0(N03)2-2H20 (получены по методу, использованному в работе [232]).
Образцы, взятые в виде порошков, прессовались в таблетки с КВг. Были также получены спектры для эмульсии изучаемых веществ в вазелиновом масле. Но вследствие того, что существенных различий в спектрах при этих способах подготовки образцов обнаружено не было, в дальнейшем рассмотрение будет проведено для спектров прессованных таблеток.
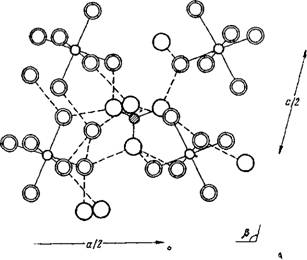
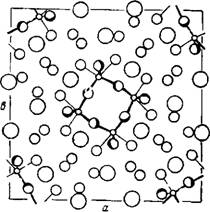
Согласно рентгенографическим данным, структура Zr(S04)2-4H20 слоистая [220]. Атомы кислорода воды и тетраэдра SO42-, координированные к атому Zr, образуют искаженную антипризму Архимеда. Атомы циркония связаны между собой сульфатными группами, так как каждая сульфатная группа находится в контакте с двумя атомами Zr, при этом каждый атом координирует четыре группы S042-. Каждый атом Zr присоединяет, кроме того, четыре молекулы воды, а каждая молекула воды координируется только к одному катиону (рис. 36).
Молекулы воды образуют водородные связи с атомами кислорода SC>4-rpynnbi. При этом существует два вида такой связи: одна лежит в плоскости основания анти - призмы, другая же связывает два близлежащих слоя. Длины этих водородных связей соответственно равны 2,623 и 2,685 А.
Определено еще одно расстояние, равное 2,531 А, между молекулой воды и атомом кислорода сульфатогруппы, расположенными в одной плоскости. Однако авторы считают маловероятной возможность образования столь короткой водородной связи.
|
Рис 36. Элемент структуры кристаллогидрата Zr(S04)2-4H20 |
|
Os О тетРаэ%ю s°r |
Рассмотрение ИК-спектра анализируемого соединения подтверждает схему расположения водородных свя-
Зей, которая следует из рентгеноструктурных йссЛедойй ний. Действительно, в области валентных ОН-колебаиий в спектре наблюдаются две полосы 3200 и 3370 сиг-1, которые можно отнести к колебаниям молекул воды, образующих различные по силе водородные связи с кислородом сульфатной группы (рис. 37).
Рис. 37. ИК-спектры поглощения прессованных таблеток че - тырехводных сульфата циркония (I) и дигидроксисульфата циркония (2)
По частотам валентных колебаний координированных молекул воды мы рассчитали энергию этих водородных связей, которая оказалась равной 8,5 и 5,6 ккал/связь. Однако разницу в значениях энергии примерно в 3,0 ккал вряд ли можно отнести за счет различной длины водородных связей 2,685 и 2,623 А. Более вероятно, что водородная связь с энергией около 8,5 ккал характеризует связь длиной 2,531 А. Это подтверждается и тем фактом, что в кристаллогидрате BeS04-4H20 вода образует водородную связь с сульфат-анионом примерно с такой же энергией (8,4 ккал/связь). В то же время ее длина 2,58 А [233].
Таким образом, можно полагать, что наиболее прочная связь с энергией около 8,5 ккал образуется между молекулами воды и S04-rpynnaMH, лежащими в плоскости одного слоя на расстоянии 5,531 А друг от друга. Другая же водородная связь с энергией в среднем 5,6 ккал/связь Может характеризовать как связь длиной 2,623 А, лежащую в той же плоскости, так и связь длиной 2,685 А, соединяющую два слоя структуры.
|
|
|
I-1 |
Наличие в спектре соединения малоинтенсивной полосы 3600 см~1 указывает на присутствие не связанных водородной связью (свободных) гидроксильных групп, появление которых можно объяснить как результат возможного процесса гидролиза.
В опектре гидратированного сульфата циркония, кроме того, имеются интенсивные полосы поглощения 1030, 1100 и 1160 см~х, которые относятся к валентным колебаниям (v3) иона S042- [197]. Расщепление полосы v3 на три компоненты говорит о понижении симметрии SO42-- группы, входящей в кристаллическую решетку в результате координации ее к катиону. Менее отчетливые и малоинтенсивные полосы 660, 600—590 см~1 можно интерпретировать как валентные (V4), а 440 см~1 — как деформационные (гг) колебания координированной сульфатогруп - пы. Такая интерпретация, однако, не является однозначной, ибо в этой же области находятся полосы поглощения связи Me—О.
Что касается дигидроксисульфата циркония, то известна лишь кристаллическая структура безводной соли. Она представляет собой бесконечные зигзагообразные цепи, в которых атомы Zr связаны между собой мостиковыми ОН-группами [222]. При этом одна сульфатная группа удерживает три такие цепочки.
В ИК-спектре Zr(0H)2-S04-4H20 (см. рис. 37) одной из самых интенсивных является полоса 3420—3430 см~1, Которая относится к колебаниям молекул воды, образующих водородные связи друг с другом или с гидроксиль- ными группами (энергия такой связи около 4,7 ккал/связь).В этой же области имеется размытая полоса с нечетко выраженным максимумом у 3200 см~1, Свидетельствующая о том, что некоторое количество молекул воды образует сильные водородные связи с кислородом сульфат-аниона. Однако подобного рода молекул воды в этом соединении меньше, чем в Zr(S04)2-4H20, что следует из сопоставления интенсивностей указанных полос в ИК-спектрах поглощения сульфата и дигидрокси - сульфата циркония. Полоса у 3600 см~1, однако, интенсивнее в случае последнего.
Полоса, соответствующая деформационным колебаниям молекулы воды, как и в случае гидратированного сульфата циркония, находится у 1650—1660 см-1.
Наряду с частотами колебаний воды в ИК-спектре рассматриваемого соединения в области 900—1300 см~1 Обнаруживаются четыре полосы 990, 1010, 1170 и 1270 см~1. Они относятся к валентным колебаниям поли - дентатной сульфатогруппы, существование которой в без
водном соединении было обнаружено с помощью рентге ноструктурного анализа [222].
В спектрах указанных кристаллогидратов в области 800—1100 см-1 отсутствуют интенсивные полосы, что говорит о невозможности существования связей Zr = 0 или длинных цепочек типа...Zr—О—Zr... [234].
ИК-спектры соединений Zr0(N03)2-2H20 и Hf0(N03)2-2H20 обладают большим сходством (рис.38).
|
3800 3000 20001200 400 V.см 800 |
|
,-t |
Рис. 38. ИК-спектры поглощения оксинитратов Zr0(N03b - •2Н20 (1) и Hf0(N03)2-2H20 (2)
Среди многочисленных довольно интенсивных и резких полос, имеющихся в спектрах, выделим те, которые принадлежат колебаниям N03--rpynn. Это 1560 и 1515; 1300 и 1280; 1030; 810 и 780 см-1. Их обычно относят к координированным монодентатным нитратогруппам (соответственно V4, vi, v2, ve), обладающим симметрией С2« [197, 225]. Вместе с тем этот же набор частот характеризует и бидентатный нитратный комплекс [235, 236].
Следует отметить, что в спектрах дигидратов оксинит - ратов наряду с полосами координированной нитратогруп - пы имеется также очень интенсивная полоса 1400 см~ Которую можно интерпретировать только как валентное колебание v3 нитрат-иона. Подобный факт отмечался для гексагидратов оксинитратов циркония и гафния в работе
[219].
В области 2800—3700 смв спектрах обеих солей имеется широкая полоса, максимум которой лежит у 3400—3450 см-1. Это частота валентных колебаний жидкой воды. Соответствующая ей полоса деформационных колебаний наблюдается у ~1620 см~х.
Помимо полос воды, в спектрах обнаруживаются также резкие и очень интенсивные полосы с частотами ~3620 и ~3560 см-1, которые принадлежат гид - роксильным группам, не связанным и связанным
водородными связями. Указанные полосы отчетливее и интенсивнее в спектре оксинитрата циркония. Если предположить, что их присутствие связано с происходящим процессом гидролиза в данных соединениях, то можно объяснить наблюдаемую разницу в интенсивности полос большей склонностью к гидролизу циркония по сравнению с гафнием.
В этой же области валентных ОН-колебаний в спектре оксинитрата циркония, кроме того, намечается перегиб у 3190—3220 см.-Который, возможно, характеризует наличие прочного донорно-акцепторного взаимодействия молекулы воды и кислорода оксинитрата (как показано выше, энергия такого взаимодействия, рассчитанная по смещению частоты, составляет ""8,5 ккал/связь).
В спектрах изученных нитратных солей имеется еще полоса 870 см~1, которую не наблюдали в работе [221]. По всей вероятности, ее можно отнести к колебаниям длинных цепочек...Me — О — Me... [234].
Не упомянуты еще три полосы в самой низкочастотной области, это 460, 520—540, 610 см~К В этой области обычно располагаются полосы, характеризующие связь Me — О. Полосы с такими же частотами были найдены в спектрах оксиацетатов и окснформиатов Zr и Hf [237].
Таким образом, как и в случае сульфата циркония, молекулы воды в обсуждаемых соединениях находятся я
|
|
|
Рис. 39. Проекция (001) единичной ячейки структуры Zr0Cl2-8H20 |
|
О Zr Qd OD |
Напряженном состоянии за счет образования прочных водородных связей с анионом.
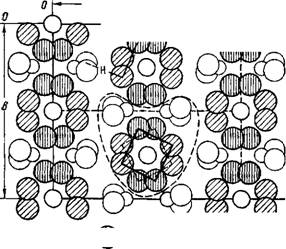
Кристаллическая структура оксихлорида циркония октагидрата [218] предполагает в качестве единичного элемента решетки существование [Zr4(OH)8"16H20]8+. Атомы циркония в такой ячейке образуют слегка искаженный квадрат. Связь между соседними атомами осуществляют две ОН-группы, расположенные одна над,
|
|
|
Звоо зооо то воо т V,Cm- |
Рис. 40. ИК-спектры поглощения оксихлоридов Zr0Cl2-8H20 (I) и HfOCI2-8H20 (2)
А другая — в плоскости этого квадрата (рис. 39). Кроме того, около каждого атома Zr располагаются четыре молекулы воды, которые искажают квадрат антипризмы.
При сопоставлении спектров оксихлоридов Zr и Hf (рис. 40) оказывается, что самые интенсивные полосы лежат в области 3000—3700 см~х. Это прежде всего полоса валентных колебаний молекул воды, ассоциированных друг с другом, определяемая частотой ~3420 см~1. Для соли циркония (как это отмечалось и для рассмотренных выше соединений) она и более интенсивна, и лучше разрешена. Интенсивная полоса 3530 см~х Относится к колебаниям связанных гидроксильных групп. Не менее интенсивны в этой же области и две слабо разрешенные полосы с частотами 3170 и 3280 см~1. Они принадлежат молекулам воды, образующим энергетически прочные водородные связи, очевидно, с ионом хлора. Следует заметить, что такие же частоты были зафиксированы нами в спектрах гидратированных хлоридов редкоземельных элементов.
Спектры оксихлоридов Zr и Hf различаются в области частот 800—1200 см~х. Для соли Hf здесь наблюдаются три полосы: 840, 970 и 1050 см~х, а для Zr —пять: 860, 930, 970, 1040 и широкая 1100 см~х. Поглощение в области 1000—1100 см~х можно интерпретировать как деформационные колебания гидроксильных групп Me —ОН.
Образующих мостики между двумя атомами металла [238]: Полоса с частотой, лежащей в Me—О... Me.
Этом же интервале, имеется и в спектрах сульфата, гидро - ксисульфата и оксинитратов. Но там она перекрывается более интенсивным поглощением на этой же частоте сульфатной и нитратной групп.
По поглощению 840—860 см~[4] можно утверждать наличие в структуре изучаемых соединений цепочек...Me—О—Me..., а полосы 930 и 970 см~1 отнести к колебанию связи Ме = 0 [234].
В спектрах насыщенных водных растворов оксихло - рида Zr, однако, групп Ме = 0 обнаружено не было. Возможно, это происходит в результате перехода в водном растворе групп Zr = 0 в Zr — ОН. Аналогичное явление было обнаружено в работе [231] при изучении карбонатных соединений циркония. Для некоторых из указанного класса соединений, находящихся в твердом состоянии, были найдены цирконильные группировки. Однако при растворении этих соединений происходило разрушение группы Zr = 0.
Сопоставление спектров воды для кристаллогидратов Zr и Hf с соответствующими спектрами воды в соединениях с гидролизующимися элементами Al, Zn показывает, что обнаруженное ранее (для Al, Zn) возмущающее действие катиона на состояние воды в данном случае несколько ослаблено. Это следует из того факта, что спектры солей Zr и Hf в области валентных колебаний воды несколько упрощаются. Это может быть следствием того, что эти элементы сильно гидролизованы и образовавшиеся ОН-группы, окружающие катион, ослабляют его влияние на воду.
Состояние воды в гидратах уранилнитрата
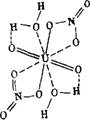
Структура гидратов уранилнитрата была предметом ряда исследований. Рентгеноструктурными методами установлено, что первые две молекулы воды в гидратах уранилнитрата координируются через свои кислородные атомы непосредственно к урану [239—243]. Что касается атомов водорода воды, то их положение до сих пор не установлено. Гейтхауз и Коминз [239] сочли возможным для молекулы дигидрата уранилнитрата предложить структуры, в которой обе связи О—Н координированной воды равноценны
0
1
/N
О о
■ЧоЛС. ос»
О о
N/ I
О
Такая структура не может полностью объяснить особую прочность удержания воды в молекуле дигидрата уранилнитрата, которая настолько велика, что из дигидрата уранилнитрата воду нельзя удалить простым нагреванием, так как параллельно отщеплению воды происходит разложение уранилнитрата с выделением окислов азота и образованием основных солей уранила и U03 {244, 245].
Эта особая прочность удержания двух молекул воды ионом уранила была даже использована некоторыми исследователями [246—248] в качестве доказательства того, что ион уранила имеет структуру U(OH)42+, а не общепринятую структуру UO|+ [248].
Однако, несмотря на эту высокую прочность удержания двух молекул воды уранилнитратом, Вдовенко, Суг - лобов и Красильников [250], изучавшие ИК-спектры ряда комплексных соединений уранилнитрата, показали, чтэ вода принадлежит к числу наиболее слабых аддендов, т. е. связь первых двух молекул воды через их кислородные атомы с ураном отличается меньшей прочностью, чем связь, образуемая атомом урана со многими другими аддендами (в том числе и с трибутилфосфатом).
В связи с этим были изучены спектры гидратов уранилнитрата и его экстрактов в трибутилфосфате в области валентных колебаний ОН-групп воды и интерпретация их с учетом данных, полученных методом теоретического моделирования [140]. В работе использован очищенный гексагидрат уранилнитрата. Тригидрат ч дигидрат уранилнитрата получены по методу Вдовенко и Суглобовой [251] дегидратированием мелкорастертого гексагидрата нитрата уранила над 63%- и 96%-ной серной кислотой соответственно. Трибутилфосфат очищали по методике, описанной в работе [252].
Экстракты уранилнитрата в трибутилфосфате получали контактированием органической фазы с твердым
|
100
Рис. 41. Дифференциальный ИК-спектр поглощения экстракта ypj - нилнитрата в трибутилфосфате по отношению к безводному трибу - тилфосфату ЗВОО 3200 v.cm-1 ЗВОО 2800 ЮМ-1 |
Рис. 42. ИК-спектр поглощения кристаллического дигидрата уранилнитрата
Гексагидратом уранилнитрата. В результате перехода уранилнитрата в органическую фазу остающаяся гидрат - ная вода образовывала водную фазу. В связи с этим для экстракции брали такое количество гексагидрата уранилнитрата, которое обеспечивало получение водной фазы, содержащей избыток нерастворившегося гексагидрата уранилнитрата в условиях насыщения органической фазы уранилнитратом. Экстракцию проводили в делительных воронках при (21 ±1)°С до достижения равновесия, которое устанавливали фотометрическим методом но прекращению возрастания оптической плотности экстрактов при дальнейшем продолжении экстракции.
На рис. 41 приведен дифференциальный ИК-спектр поглощения экстракта нитрата уранила в трибутилфосфате по отношению к безводному трибутилфосфату. Спектр состоит из двух полос поглощения воды, имеющих максимумы при 3140 и 3660 смгх. Это указывает на то, что одновременно с уранилнитратом экстрагируется в какой-то kepe также и вода2. Наличие двух Полос поглощения указывает на асимметрию нагрузки молекул воды.
Исходя из зависимости между положением полос поглощения и энергией связи молекулы воды с окружением [126], рассчитаны значения энергии обеих связей. 9,5±0,3 и 1,2±0,3 ккал! моль.
Спектр экстракта уранилнитрата содержит еще одну полосу поглощения при 3500 смг1, которую следует отнести к молекуле воды, связанной с трибутилфосфатом, с энергией водородной связи 3,5±0,3 ккал/моль, так как указанная величина хорошо совпадает с энергией связи воды, растворенной в трибутилфосфате [140]. Она исчезает, если экстракт осушить молекулярным ситом 4 или 5 А. Аналогичные спектры поглощения имеют кристаллические ди - и тригидраты уранилнитрата (рис. 42), содержащие полосы поглощения при 3140 и 3520 см~1 (9,5±0,3 и 3,4±0,3 ккал/моль3). В спектре поглощения гексагидрата уранилнитрата имеется очень широкая полоса поглощения, в которой нельзя однозначно определить положение отдельных полос.
На основе полученных нами данных о неравноценности обеих связей О — Н каждой из двух координированных молекул воды дигидрата уранилнитрата можно сделать следующий вывод относительно структуры его молекулы: обе молекулы воды в дигидрате уранилнитрата координируются каждая своим кислородным атомом к атому урана и одновременно одним из атомоз водорода к кислороду уранильной группы с образованием очень сильной водородной связи в 9,5 ккал/моль.
Следует отметить, что эта водородная связь проявляется также и в растворах уранилнитрата в трибутилфосфате. Это указывает на то, что уранилнитрат экстрагируется не только в виде дисольвата типа U02(N03)2-2TBO, как это принималось ранее [254], но частично также и в виде смешанных гидратосольватов. Другая связь О — Н воды, содержащейся в молекуле уранилнитрата, растворенного в трибутилфосфате,
Г Николаев, Дядин и Яковлев [253] дали количественную оценку содержания воды в трибутилфосфатных экстрактах, полученных в тех же условиях, но при различных температурах. 4 Полосы поглощения тригидрата несколько более широкие по сравнению с соответствующими полосами дигидрата уранилнитрата.
Характеризуется намного меньшей энергией, составляющей 1,2 ккал/моль. Увеличение энергии этой связи в кристаллическом дигидрате уранилнитрата можно связать с образованием водородной связи с одним из кислородных атомов нитратогруппы соседней молекулы.
Подтверждением изложенных выше выводов является также значительное изменение частот симметричных (vi) и асимметричных (v3) колебаний уранильной группы при присоединении к безводному уранилнитрату двух молекул воды и слабое при дальнейшем увеличении числа присоединившихся молекул воды. Приведенные данные (табл. 15) взяты из [250, 255]. Резкое изменение частот
|
Таблица 15 Частоты симметричных и асимметричных колебаний ранильной группы (сл-1) безводного уранилнитрата его гидратов
|
Колебаний уранильной группы при переходе от безводного уранилнитрата к дигидрату можно объяснить только образованием водородных связей между обоими кислородными атомами уранильной группы и одним из атомов водорода каждой из двух координированных молекул воды.
На основании полученных данных полную структуру дигидрата уранилнитрата можно представить следующим образом [256]:
|
|
Точно так же может быть представлена структура три гидрата уранилнитрата с той разницей, что третья молекула воды входит в комплекс вследствие образования водородной связи с внешним атомом кислорода одной Hi нитратогрупп, как это было показано Вдовенко с сотрудниками [243].
Так как вода удерживается в молекуле дигидрата нитрата уранила не одной, а дв^мя связями, то это обусловливает довольно большую прочность удержания первых двух молекул воды в координационной сфере уранилнитрата.
Кислородсодержащие органические растворители, координирующиеся через свой кислородный атом и не способные к одновременному образованию водородной связи с кислородными атомами уранила, удерживаются уранилом менее прочно. Так, например, уранилнитрат намного слабее удерживает две молекулы диэтилового эфира, чем две молекулы воды. Вследствие этого нитрат уранила при экстракции такими растворителями в органическую фазу, как правило, переходит в виде смешанных гидратов-сольватов, содержащих две молекулы воды и две молекулы растворителя, присоединяющихся своим кислородным атомом к одному из атомов водорода координированной воды с образованием водородной связи. И только трибутилфосфат и ему подобные экстраген - ты, содержащие сильно поляризованную фосфорильную группу, способны вытеснять воду с образованием безводного дисольвата общей формулы U02(N03)2-2S (где S — молекула экстрагента). Это вытеснение не является полным, и уранилнитрат частично экстрагируется в виде сольвата, содержащего воду, как это показано в настоящей работе, а также в работе [253].