СОСТОЯНИЕ ВОДЫ В ОРГАНИЧЕСКИХ И НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Механизм и энергия взаимодействия воды с молекулами протоноакцепторных органических растворителей
Известно, что при образовании водородной связи типа АН...В между двумя различными молекулами АН и В в ИК-спектре наблюдаются изменения в области полос поглощения и донора, и акцептора протона. Это спектроскопическое проявление водородной связи служит предметом изучения с целью выяснения механизма межмолекулярных взаимодействий. Наиболее чувствительно к внешним межмолекулярным воздействиям и потому весьма удобно для использования в качестве индикатора таких взаимодействий колебание групп О—Н.
Поведение полос валентных и деформационных ОН - колебаний воды при ее взаимодействии через Н-связь с органическими соединениями было предметом изучения многих авторов. Тем не менее ввиду сложности наблюдаемого поглощения ОН-групп, особенно в области их валентных колебаний, до настоящего времени спорным является отнесение полос поглощения воды в системе вода— растворитель. ОкончательНо не решен вопрос о типах ас - Гоциятов, обрязурмых водОй, растворенной в органических соединенияХ - Ранее Чулановским [132] высказывалось мнение, что даже при концентрации воды ниже 1 % в четыреххлористом углероде, ацетоне, диэтиловом эфире образуются не смешанные комплексы, а комплексы самой воды. К такому же выводу пришел и Буланин [133], анализируя поведение полосы 2100 см~1 воды, растворенной в диоксане, ацетоне, метилэтилкетоне (содержание воды варьировалось в пределах от 50 до 5%).
На существование же ассоциированных с растворителем молекул воды указывали Сомань и Жозьен [37], изучая влияние осушенных растворителей на сдвиг частоты валентного колебания воды (анализируемая область частот 3350—3800 см.-1). Они считают, что в случае малых количеств воды (содержание воды в бинарной системе 0,05 моль/л) каждая молекула ее взаимодействует с двумя молекулами протоноакцепторного растворителя (аце- тонитрил, диоксан, пиридин). Это положение в случае ацетонитрила находит подтверждение в работе Щербы [134].
Существование комплексов вода—растворитель предполагается также в работах Грейнахера, Люттке, Меке [40], Сидорова [41, 135], Мора и др. [136], Эрреры [137], Карякина и др. [138], Дудорова и Розынова [139], однако в них нет единства взглядов на интерпретацию наблюдаемых полос воды и природу образующихся комплексов.
Наиболее вероятным следует считать представление, согласно которому в любых растворах, смесях и матричных суспензиях, состоящих из молекул воды и взаимодействующих с ними протоноакцепторных молекул, возможно образование большого числа самых разнообразных комплексов, обладающих своими специфическими спектрами поглощения. В результате наблюдаемый суммарный спектр таких систем всегда будет состоять из большого числа полос, а их отнесение будет чрезвычайно сложным. Так, когда 1) раствор настолько разбавлен, что молекулы воды не образуют даже димеров, 2) возмущение всех молекул воды через их неподеленные пары электронов атомов кислорода одинаковое, 3) молекулы растворителя не имеют собственных полос поглощения в интервале частот 3800—3000 см~ т. е. не содержат в себе ОН-, NH- и СН-групп,—в области валентных ОН-колебаний должны наблюдаться четыре полосы поглощения. Последнее вызвано тем, что каждая молекула воды может оказаться связанной с одной или двумя молекулами растворителя.
Наложенные ограничения не являются очень жесткими, поэтому число систем, удовлетворяющих предъявленным требованиям, оказывается весьма большим. Действительно, второе и третье требования в основном аналогичны. Так, если выполнить третье требование, которое обязательно для любого спектрального исследования и анализа, а именно отсутствие посторонних полос поглощения в исследуемой области, то тем самым автоматически исключаются растворители с сильными протоноакцеп - торными свойствами. Следовательно, в тех системах рас - fBOpoB, tfofdpbie могут быть изучены спектрально, вообще не может возникнуть существенного взаимодействия с неподеленной парой электронов кислорода молекулы воды, если в растворе не присутствуют катионы. Таким образом, реально все разбавленные растворы воды (при отсутствии в них солей) в растворителях, не имеющих собственных полос поглощения в области валентных ОН - колебаний, можно принять за те наиболее простые системы, спектры которых можно объяснить, исходя из результатов теоретического моделирования [140].
Исследуя поведение частот валентных колебаний молекул воды, можно судить только об изменении силовых постоянных ее ОН-связей {Qon). Очевидно, имея только один этот параметр, нельзя судить о том, чем вызвано это изменение —водородной связью, образованной атомом ъодорода ОН-связи, или воздействием на неподеленную яару электронов атома кислорода этой связи, тем более что механизмы обоих взаимодействий еще не известны. В то же время при большой подвижности молекул, какую мы имеем в растворах, возмущение молекулы воды через ее неподеленную пару электронов не может исказить симметрии силового поля молекулы воды. Поэтому, если даже такое возмущение и существует, оно будет проявляться в виде регулярного искажения спектра и существенно не повлияет на те изменения, которые возникают вследствие нарушения симметрии силового поля молекулы воды при ее взаимодействии с двумя различными про - тоноакцепторами.
Чтобы оценить суммарное поглощение, вызываемое молекулами воды, связанными с одной и двумя молекулами растворителя, необходимо учесть два следующих фактора. Во-первых, нужно знать количественное соотношение этих двух ассоциаций, кОторое в реальных системах может быть самым различным. Во-вторых, Весьма суЩеСтвенной является относительная интенсивность всех возможных полос поглощения, котоРая также резко отраЗится на наблюдаемом суммарном спектре. Строгий учет этих величин в общем виде не представляется возможным, поэтому мы ограничимся качественным описанием спектральных изменений, происходящих вследствие уменьшения #он.
Каковы же самые общие изменения, которым должен подвергнуться спектр молекулы воды при взаимодействии
Ее с молекулами окружения? При образованиИ моле - ку^й_воды_Двух симметричных Водородных свяЗей увелиЧатся интенсивности обеих ее полос валеНтных колебаНий. Это произойдет независимо от того, является ли уве - лиЧение интенсивности полос ОН-колебанИй г-прдртм^м- Изменения электрооптического параметра самой ОН-связи [141] или вклада в интенсивность этого колебания электрооптического параметра водородной связи [141а]. При асимметричном возмущении молекулы воды увеличится интенсивность только одной ее низкочастотной полосы поглощения, которая обусловлена в основном колебанием возмущенной ОН-связи [141]. Полуширина этих полос поглощения с усилением водородной связи, как правило, тоже увеличивается.
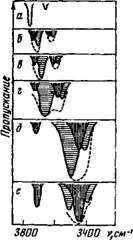
Учитывая эти зависимости и полагая полуширину полос невозмущенной молекулы воды равной 25 см~х (такая полуширина была зарегистрирована у молекул воды, находящихся в наиболее инертной среде [1416]), можно оценить характер спектра воды в растворах, представляя его как аддитивную сумму полос поглощения, найденных методом теоретического моделирования, для ассоциаций молекул воды с одной и двумя молекулами растворителя. Результаты таких оценок для случая, когда число таких ассоциаций одинаковое, а уменьшение силовой постоянной ОН-связи, сопровождающее образование водородного мостика, происходит на 0,0; 1,8; 3,6; 5,4 и 15,0%, что соответствует энергиям взаимодействия 0,0; 0,6; 1,2; 1,8 и 5,0 ккал/связь [126], представлены на рис. 6.
В реальном растворе между молекулами воды и растворителя возникают различные слабые взаимодействия, определяемые природой «инертных» атомов молекулы растворителя. Относительно сильное взаимодействие обычно бывает обусловлено одним-единственным или несколькими, но тогда, как правило, одинаковыми (диок- сан, нитробензол) протоноакцепторными атомами молекулы растворителя.
Поскольку все слабые возмущения малы настолько, что вызываемые ими смещения соответствующих полос поглощения меньше полуширин этих полос, то подразделять по величине эти взаимодействия при спектральных исследованиях не имеет смысла. Поэтому молекулу растворителя целесообразно представить в виде молекулы R—В, у которой В—атом, обладающий сильным протоно-
|
|
Рис. 6. Спектры поглощения воды в растворах, полученные расчетным методом в предположении, что число молекул воды, связанных с одной (вертикальная штриховка) н с двумя (горизонтальная штриховка) молекулами растворителя, равны между собой
Энергия взаимодействия молекул воды и растворителя, ккал/связь - Я —0.0; 6 — 0.6, в—1.2; г—1,8; Д — 5,0. е —5.0 (число молекул воды, связанных с одной молекулой растворителя, составляет 80%)
Акцепторным свойством, a R — произвольный инертный радикал. В этом случае в растворе могут реализоваться следующие ассоциации:
НОН ... RB (I), НОН... BR (II), BR ... НОН... RB (III),
BR ...НСН ... BR (IV) и RB...HOH...BR (V).
Однако если учесть, что первые две ассоциации вообще маловероятны в жидкостиа равновесие между тремя оставшимися вследствие разной энергии взаимодействия с В и R будет смещено в сторону ассоциаций (IV) и (V), то получается, что спектр этой более сложной и довольно полно описывающей реальные свойства раствора модели имеет такой же вид, что и спектр первой, более простой модели (см. рис. 6). Отличие состоит лишь в том, что узкая высокочастотная полоса ассоциации (IV) вследствие слабого взаимодействия ОН-группы молекулы воды с радикалом R смещена по сравнению с первой моделью на 20—40 см~[1] в сторону меньших частот, а на
ее крыльях проявляются две слабые полоски маловероятной ассоциации (III).
Рассмотрение предложенной модели не позволяет получить каких-либо абсолютных числовых значений. В То Же ар.£мя_абшеЕ поведение частот, полученное таким~мо- Дёлированием, отражает истИНные зАкономерности, приСущие сПеКтрам реальных_рАстворов. Как видно из рис. 6, при сохранении равновесия между ассоциациями типа (IV) и'(У) по мере ослабления <7он (моделируется усиление Н-связи) полосы заметно сближаются, а при смещении на 300 см-1 они совершенно сливаются, образуя общий максимум. Отдельные компоненты этого максимума могут оказаться и неразрешенными, хотя истинное расстояние между ними осталось неизменным.
Из вычисленных спектров следует также, что при увеличении доли ассоциаций типа (IV) должна усиливаться, узкая полоса около 3700 см~1 и ослабевать более высокочастотная полоса интенсивного дублета (см. рис. 6, а—г), которая обусловлена колебаниями воды, ассоциированной по типу (V). Одновременно в сторону больших частот должна сместиться вторая полоса интенсивно^ го дублета. Это смещение будет наибольшим (20— 40 см-1), когда три интенсивные полосы проявляются в виде одного неразрешенного максимума (см. рис. 6,
<3, е).
Поскольку спЕктры симметричной (V) и асимметричНой ТГУ) ассоциации различны нАстолько, что это Можно заметить экспериментаЛьно, То появляется "воЗможность пРоверки предложенной модели, а именно, действительно ли все разбавленные растворы воДы_содержат только ja - Кие типы яггопИяний Проиерку мож!Гб~осуЖёствить,~резко изменив характер сил, действующих в растворе (десятикратное разведение первоначального раствора другим растворителем или изменение температуры), или проведя неполный дейтерообмен молекул воды, что по-раз - ному отразится на спектрах ассоциированных молекул воды. Для симметрично ассоциированных молекул в области валентных ОН-колебаний останется одна полоса,, для асимметрично ассоциированных спектр практически не изменится. В Случае экспериментального подтвержде- ниЯ_предложенной модели появилась бы воЗможность, во - йе^вых, определять долю каждой из реализую1ЩШ&_ас: Социации^ а во-вторых, регистрировать энергию взаимодейСтвия молеку^Н в»"» с ря^и^ыми ятоМами молеку - ХьГрастворителя2.
Используемая нами модель молекулы воды в растворе учитывает только уменьшение силовых постоянных ее ОН-связей (#он)- Хорошо известно, что основной эффект водородной связи, проявляющийся на валентных колебаниях ОН-связи, состоит именно в таком уменьшении ее - силовой постоянной. В то же время нет никаких оснований полагать, что какие-либо другие взаимодействия, например взаимодействие через неподеленную пару электронов атома кислорода, не отразятся на величине той же силовой постоянной. Поэтому было очень важно проверить, действительно ли допущенное в расчете игнорирование отдельных черт природы взаимодействия молекул не уменьшит правильность найденных закономерностей.
Такая проверка была произведена сопоставлением полученных зависимостей с результатами эксперимента. Кроме известных литературных данных [40, 41], в работе были исследованы 0,5%-ные бинарные растворы воды в ацетоне, метилэтилкетоне, метилизобутилкетоне, диэтил - кетоне, циклогексане, ацетофеноне, диоксане, дипропило - вом эфире, амилацетате, нитробензоле, трибутилфосфа - те, ацетонитриле и пиридине, а также тройные смеси этих растворов с четыреххлористым углеродом, растворы полутяжелой воды и спектры растворов при разных температурах. Для составления растворов использовались растворители марки ч. д. а., которые дополнительно еще осушались цеолитом типа А до 0,005 вес.%.
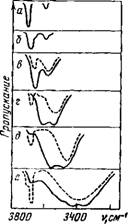
В качестве первого этапа проверки расчетные спектры слабых растворов воды были сопоставлены со спектрами 0,5%-ных растворов, полученных экспериментально. На рис. 7 (сплошные линии) приведены некоторые спектры, типичные для соответствующих групп растворителей. Как хорошо видно, они полностью совпадают с расчетными спектрами (см. рис. 6). Следует обратить особое внимание на то, что столь резкое различие спектров поглощения молекул воды, взаимодействующих с совершенно разными по природе и свойствам растворителями (активны-
S В тех случаях, когда молекула растворителя имеет два или более атомов, обладающих большим, но различным протоноакцепторным свойством, полученная спектральная картина оказывается неГодной, и необходимо заново рассмотреть все возможные ассоциации аналогично тому, как это было сделано выше.
Ми и инертными, полярными и неполярными, содержащими сильный и слабый протоноакцепторный атом азота или кислорода), оказалось следствием монотонного изменения только одного параметра — qon.
Второй этап проверки заключался в сопоставлений расчетных и экспериментальных спектров таких растворов, в которых при сохранении природы молекул растворителя тем или иным способом изменен характер их взаимодействия с молекулами воды. Одно из таких изменений характера взаимодействия в растворе было осуществлено разбавлением Исследованного ранее бинарного раствора воды в протоноакпепторном растворителе десятикратным объемом четыоеххлористого углерода. Очевидно, такое разбавление резко уменьшает концентрацию в Растворе атомов, обладающих сродством к протону, и, Следовательно, понижает вероятность образования ассоциаций типа (V). Следовательно, при разбавлении раствора четыреххлористым углеродом должно возрастать число ассоциаций типа (IV), а спектр раствора должен принять вид, изображенный на рис. 6 полосами с вертикальной штриховкой.
|
|
Действительно, как видно из рис. 7, разбавление любого раствора десятикратным объемом ССЦ сопровождается появлением или резким усилением полосы около 3700 см~ обусловленной асимметричным колебанием асимметрично возмущенной молекулы воды. Одновременно с усилением этой полосы в случае растворов, имеющих
Рис. 7. Спектры поглощения воды в бинарных растворах (сплошные линии, с=0,5 об.%, толщина слоя 0,25 мм) и в тройных смесях (пунктирные линии, концентрации соответственно воды, органического растворителя и ССЦ 0,05, 9,95 и 90%, толщина слоя 2,5 мм)
А — в азотной матрице; б — в СС1«; В — в нитробензоле, в нитробензоле и СС1«; г — в метилэтилкетоне, в ме - тилэтилкетоне н ССЬ; д — в трибу - тилфосфате, в трибутилфосфате и СС1<; е — в пнрндиие, в пиридине и СС1,
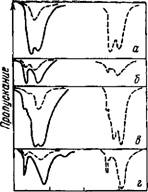
Рис. 8. Спектры поглоще» ия легкой (сплошные линии) и содержащей 90% дейтерия (пунктирные) воды в различных растворителях
А —|в метнлэтилкетоне (содержание воды 0,5 об. %); б— в метнлэтилкетоне и СС14 (соотношение концентраций 0,05 9,95 : 90); в —в трибутил - фосфате (содержание воды 0,5 об %); Г — в трибутилфосфате и СС14 (соотношение концентраций 0,05 : 9,95 ' 90)
Хорошо разрешенные полосы (вода в метилэтилкетоне и Трибутилфосфате), как и следует из развиваемого представления, наблюдается почти полное исчезновение более высокочастотной полосы интенсивного дублета (3620 и 3570 см~1 соответственно). В случае пиридина, когда аналогичная полоса поглощения образует общий максимум поглощения с двумя полосами симметричных колебаний, разбавление в ССЦ, как и ожидалось, приводит к смещению максимума этой сложной полосы на 30 см~1 в сторону больших частот (см. рис. 7, е). На крыльях узкой высокочастотной полосы заметны две слабые полоски, что указывает на присутствие в этом растворе ассоциаций типа (III).
|
3800 3000 VjCM'1 |
Сохранение симметрии почти у всех молекул воды в бинарных растворах и утрата ее при переходе к тройным смесям однозначно доказываются и опытами по неполному (90%) дейтерозамещению водорода воды (82% D20 и 16,5% HDO и 1,5% Н20) в растворе (рис. 8). Действительно, для всех растворителей спектры бинарных растворов полутяжелой воды в области валентных ОН-колебаний содержат только одну полосу поглощения (см. рис. 8, а, в, Пунктирные линии), лежащую между полосами поглощения аналогичного раствора легкой воды (см. рис. 8, а, в, Сплошные линии). В случае же тройных смесей спектры легкой и полутяжелой воды в области ОН-колебаний остаются неизменными (см. рис. 8, б, г). Эти изменения
Позволяют сделать окончательное заключение О тои<, что в разбавленных растворах вода находится в виде ассоциаций типа (IV) и (V). При этом по мере разбавления раствора инертным растворителем число ассоциаций типа (IV) быстро растет.
Другим способом нарушения характера взаимодействия между молекулами в растворе является изменение его температуры. Рассмотрим, как изменится модель раствора, если его температуру несколько повысить. Очевидно, чем прочнее связь, возникающая между данными молекулами, тем дольше такие ассоциации не распадаются. Следовательно, преобладать должны, казалось бы, ассоциации типа (V). С другой стороны, концентрация в растворе атомов, обладающих заметным сродством к протону (атомов В), очень мала, а следовательно, мала и вероятность участия их в образовании комплексов. Поэтому более вероятно образование ассоциаций типа (IV). Таким образом, соотношение между ассоциациями типа (IV) и (V) оказывается обусловленным двумя конкурирующими факторами: вероятностью образования ассоциации и временем ее существования. Повышение температуры раствора приведет к уменьшению последнего для комплекса (V), так как увеличивает вероятность его разрушения, и никак не повлияет на вероятность его образования (концентрация атомов остается неизменной). Следовательно, исходя из предложенной модели, повышение температуры должно всегда смещать равновесие в сторону асимметричных ассоциаций типа (IV). Спектрально это должно проявляться в уменьшении интенсивности более высокочастотной полосы интенсивного дублета и появления (или усиления) узкой полосы около 3700 см~х, Характерной для ассоциаций (IV).
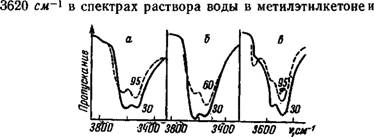
Как видно из полученных спектров (рис. 9), повышение температуры раствора воды в метилэтилкетоне на 30° уже приводит к существенному ослаблению указанной полосы, характерной для симметричной ассоциации. В случае раствора воды в циклогексане, более высокая температура кипения которого позволила повысить температуру раствора на 65°, кроме ослабления полосы около 3620 см~ наблюдается усиление поглощения около 3700 см~1. Такое же повышение температуры раствора воды в трибутилфосфате, как и в циклогексаноне, вызывает ослабление высокочастотной полосы интенсивного дублета й значительное усиление полосы около 3700 см~х. Последнее однозначно указывает на увеличение числа ассоциаций (IV).
В тех случаях, когда полосы поглощения разных ассоциаций достаточно хорошо разрешены, можно оценить численное отношение этих ассоциаций в реальном растворе. Так, по интенсивности полос поглощения 3690 и
|
Рис. 9. Спектры поглощения воды при различных температурах А — в цнклогексане; 6 — в метилэтнлкетоие; в — в трибутилфосфате (цифры иа кривых — температура в °С) |
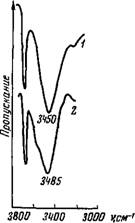
Их тройной смеси с CCU (молярное отношение 1: 40 :380) можно заключить, что в тройной смеси около 90% молекул воды через атом кислорода С = 0-группы связаны только с одной молекулой растворителя. В бинарном же растворе ассоциированных таким образом молекул воды (IV) присутствует не более 9%.
Такое же рассмотрение спектров бинарного раствора и тройной смеси воды с трибутилфосфатом и ССЦ (молярное соотношение 1:13 :380) показывает, что в тройной смеси практически все молекулы воды сильно (т. е. через атом кислорода Р = 0-группы) связаны только с одной молекулой трибутилфосфата. В бинарном растворе воды в трибутилфосфате такие ассоциации составляют около 19—20%. Это различие хорошо согласуется с очень сильной разветвленностью молекул трибутилфосфата по сравнению с более простыми по строению молекулами ме- тилэтилкетона. Такое же объяснение следует дать и появлению слабого перегиба около 3700 см-1 в спектрах бинарных растворов воды в амилацетате, ацетофеноне и ме - тилизобутилкетоне, которого не было обнаружено в спектрах более простых кетонов.
Полученные результатЫ с полной очевидностЬю noKSb
Зывают, "чтп~прр"плОженняя могтрль ря ч^ я шиНного раствора воды хорошо описывает спектры не только исходных растворов, но и позволяет предсказывать, как будут ме: няться эти спектры при переходе от одного раствора к: другому. Последнее приводит к заклюЧенИю, что исполь - Зуемое Представление раствора как совокупности моле"^ кул воды, связанных с одной или двумя молекулами растворителя, отРажает основные черты природы раствора.
Проведенные исследования позволяют использовать найденные закономерности для оценки энергии водородных связей воды, что в ряде случаев необходимо для выяснения химизма процессов, постоянным компонентом которых является вода Влияние воды на ход реакций обусловлено главным образом способностью ее молекул образовывать водородные связи. Поэтому оценка энергии водородной связи воды приобретает особый смысл.
Как известНо, вплорпЛную связь образуют атомы, обладающие неподеленными парами электронов (П-элек - ТРоны). ПодвиЖность электронной пары протоноакцеп- Торного атома, способного к образованию донорно-ак - цепторнои связи, тем выше, чем больше электронная плотность в молекуле сдвинута к атому-акцептору протона. Сдвиг же электронной плотности зависит от индукционных эффектов радикалов, входящих в состав молекулы исследуемого соединения. В этой связи представляет интерес оценка прочности межмолекулярного взаимодействия воды с органическими соединениями, в которых водородную связь образуют атомы N, Р, О, S либо функциональные группы типа NO2, РО, SO и др.
В табл. 4 представлены значения энергии водородных связей для соединений, содержащих в качестве протоно - акцептора атомы О, N, Р. Энергия водородных связей определялась по смещению частот валентных колебаний воды[2] [126] для тройной системы четыреххлористый углерод — органическое вещество — вода Соотношение концентраций для такой системы 90,0:9,95:0,05 об.%. ИК-спектры воды для некоторых из указанных систем приведены на рис. 10—12.
|
Таблица 4 Энергия водородной связи некоторых органических соединений с водой
|
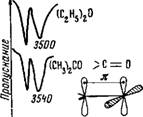
Причину различия в энергиях для соединений, содержащих эфирную и карбонильную группировки, следует отнести за счет я-связи группы С = 0. Присутствие ее приводит к изменению типа гибридизации атомных орбит кислорода от яр3-формы в эфирах до Sp2 в кетонах [142]. Увеличение доли 5-характера связи сопровождается
2* 35
Рис. 10. ИК-спектры поглощения воды в диэтиловом эфире и ацетоне (тройная система Н20—ССЦ — растворитель). Содержание воды 0,05 об.%, толщина слоя 2,5 мм
Упрочнением химической связи. Это также приводит и к изменению прочности водородной связи типа О...Н—О—Н.
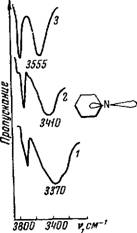
Для азотсодержащих соединений имеет место аналогичное явление. Для триэтил-, диэтил - и этиламина поглощение ОН-групп воды сильно смещено в область низких частот, что свидетельствует об образовании прочной водородной связи типа Н—О—H...N. Значения энергии Н-связи лежат в одних и тех же пределах 5,7— 5,9 ккал/связь. При переходе от этиламинов к пиридину в результате сопряжения атома азота с ароматическим кольцом происходит изменение гибридизации орбит атома N (отS/?®в алкиламинах дояр2в пиридине) [143]. При 5/72-гибридизации неподеленная пара электронов гетеро - атома (в данном случае атома N) имеет 33,3% S-харак - тера [144], что сопровождается упрочнением химической связи. Схематично это можно представить следующим образом: орбиталь неподеленной пары электронов атома азота лежит в плоскости кольца [145]. Облако га-электронов частично мигрирует в систему сопряжения (см. рис. 11), в результате чего их взаимодействие с водой посредством Н-связи уменьшается.
В молекуле ацетонитрила из пяти валентных электронов атома азота один участвует в образовании ст-связи, два — я-связи, а оставшиеся два являются га-электронами (см. рис. 11, 3) [146]. При переходе от пиридина к ацето - нитрилу происходит максимальное перекрывание орби - талей, следовательно, дальнейшее увеличение вклада S-характера связи и изменение типа гибридизации до Sp [147], что приводит к последующему уменьшению энергии водородной связи с водой.
|
3900 3100 У, см-' |
Для соединений, содержащих группы SO, РО, ЫОг, значения энергии водородных связей представлены в
табл. 5. Приведенные в таблице результаты показывают, что для соединений типа RSO, RPO, RN02 замена метальных радикалов арильными сопровождается уменьшением (правда, в ряде случаев незначительным) протоно - акцепторной способности групп SO, РО, N02. Это можно объяснить индукционным эффектом ароматических радикалов, которые смещают электронное облако молекулы от протоноакцепторного атома и поэтому снижают энергию связи Н—О—Н...В (B = N02, SO, РО).
|
|
Изменение прочности ассоциатов происходит также при уменьшении чисЛа эфирных групп (—О—) в молекуле взаимодействующего с водой соединения. В качестве примера можно привести трифенилфосфин -»■ трифе - ноксифосфин, трибутилфосфат трибутилфосфинат -»• -►трибутилфосфинокись и трифенилфосфат->• трифенил - фосфинокись. Эгот факт можно объяснить изменением числа электронофильных атомов, которое приводит к смещению электронного облака молекулы.
|
|
Рис. 11. И К спектры поглощения воды в азотсодержащих соединениях (тройные системы). Растворитель — ССЦ, концентрации воды 0,05 об.%, толщина слоя 1,0 мм
1 — триэтилачии; 2 —пиридин; 3—ацетонитрил
Рис 12. ИК-спектры поглощения воды в системе НгО—ССЦ—сульф - оксид
1 — диметилсульфоксид, 2 — дифенилсульфоксид Концентрация ВОДЫ 0,05 об °'о, толщина кюветы 2,5 мм
|
Таблица 5 Энергия водородной связи типа Н—О—Н...В (B=N02, СО, SO, РО)
|
Для соединений, содержащих фосфорильную группу, увеличение прочности Н-связи происходит в той же последовательности, что и уменьшение частоты vp=0 (табл. 6), что в какой-то степени свидетельствует об увеличении поляризации связи Р = 0. Увеличение энергии водородной связи типа Р = О...Н—О—Н также происходит в резуль-
|
Таблица 6 Положение ИК-полос фосфорильиой группы (vp=0, см*1) в бутилфосфорных соединениях
|
Тате увеличения электронной плотности на атоме кислорода группы Р = 0.
Согласно значениям энергии водородной связи с водой, рассмотренные классы соединений располагаются в последовательности
RNO2<RCO<RCOC<RSO<RP и RPO < RN.
Этот ряд совпадает с рядом, построенным Горди [125] в соответствии со смещением полосы OD-колебания тяжелого метилового сп|ирта CH3OD в результате возмущения его различными растворителями путем образования дейтериевой связи. При этом фиксировалось смещение относительно мономолекулярной полосы 2681 см спирта CH3OD, наблюдаемой в растворе бензола. Данные по смещению частот OD-колебаний дейтерометанола и валентного колебания (vj) воды, находящейся в растворен образующей водородную связь с растворителем, приведены в табл. 7. Для воды смещение определялось относительно ее частоты 3657 см в газовой фазе.
|
Таблица 7 Смещение частот (см'1) воды и дейтерометанола при их растворенни в различных растворителях и образовании донорно - акцепторных связей —ОН.. В и OD... В
|
Таким образом, величины сдвига частоты vi воды возрастают при переходе в ряду растворителей от нитробензола до алкиламинов. В такой же последовательности изменяются и частоты другого акцептора электронов — дейтерометанола при образовании им межмолекулярных связей с теми же растворителями, что свидетельствует об усилении протоноакцепторных свойств растворителей в приведенном в табл. 7 ряду.
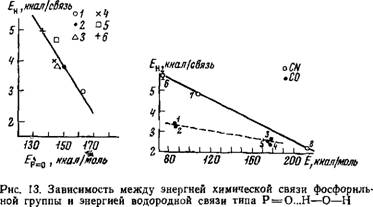
Анализ прочности водородной связи с водой различных соединений позволяет утверждать, что величина энергии Н-связи чувствительна к электронному строению взаимодействующего с водой соединения. Она реагирует на изменение степени гибридизации орбиталей протоноакцеп - тора, на присутствие ароматических колец, изменение числа электронофильных атомов кислорода эфирных групп, следовательно, является показателем электронодонорной способности функциональных групп и соединений в целом. В связи с этим представляет интерес проведение сопоставления энергии Н-связи с другими параметрами, также характеризующими электронодонорные свойства. Одной из главных характеристик молекулы, определяющих особенности ее строения и многие свойства соединений, является длина связей и энергия химических связей [150]. Результаты сопоставления величин энергии водородных связей с водой типа А—В... Н—О—Н и энергии
|
Таблица 8 Энергетическая характеристика связей органических группировок
|
Химических связей А — В в пределах функциональных групп одного класса представлены в табл. 8. Соответствующие графические зависимости изображены на рис. 13, 14.
Приведенные данные показывают, что значения энергии связи достаточно постоянны. в пределах одного класса соединений и заметно меняются при переходе к другому классу. При этом с укорочением связи возрастает энергия ее химической связи. Это сопровождается и изменением энергии Н-связей, образуемых с водой рассматриваемыми функциональными группами.
По величинам энергии химической связи функциональные группы располагаются в ряд
С=0>С—О и С = N > C=N> С—N.
В то же время по величине энергии Н-связи, образуемой с водой, эти же группы располагаются в обратном порядке:
С=0<С — О и C = N<C^^N<C —N.
Для связей РО и CN эта зависимость достаточно хорошо укладывается на прямую линию (см. рис. 13 и 14).
|
T — трифеиилфосфат, 2— трнэтилфосфат; 3—трипропилфосфат; 4 — трибутил - фосфат, 5 — трифенилфосфииокись; б — трибутилфосфинокись 'Рис. 14. Зависимость между энергией химической связи функциональных групп CN н СО и энергией их водородных связей с водой / —диэтиловый эфир, 2 —диоксан; 3 —ацетон; 4 — метилэтилкетон, 5 —бенз - адьдегид; 7 — пиридин; 8 — ацетоиитрил |
Относительно связей СО доказательство такой зависимости становится практически невозможным, так как имеются данные только для двух классов соединений, содер жащих эти группы. Если допустить, что линейная зависимость между указанными параметрами справедлива и для СО-групп, то получающаяся прямая обладает другим наклоном по сравнению с аналогичной прямой для CN - групп (см. рис. 14).
Мерой энергетической связи электронов в атомах, .молекулах и радикалах может служить потенциал ионизации, характеризующий энергию отрыва наименее прочно связанного электрона (п-электрона) [151]. В табл. 9
|
Таблица 9 Потенциалы ионизации и энергия Н-связи с водой некоторых кислород - и азотсодержащих соединений
|
Приведены значения ионизационных потенциалов, характеризующих подвижность неподеленной пары электронов атомов азота и кислорода. Там же для сопоставления даны значения энергии Н-связи с водой некоторых кислород - и азотсодержащих соединений. Представленные в таблице данные свидетельствуют о том, что с ростом потенциала ионизации происходит уменьшение энергии водородной связи, образуемой этими соединениями с водой. Таким образом, между этими величинами наблюдается обратная корреляционная зависимость.
Водородную связь Н — О — Н...В можно рассматривать как кислотно-основное взаимодействие между водой (кислота) и донором электронов (основание). Поэтому сила взаимодействия воды с основаниями (энергия водородной связи) должна зависеть от основности последних.
|
Таблица 10 Характеристика кислотно-основных свойств растворителей и энергия их водородной связи с водой
|
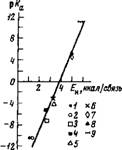
Величина, характеризующая основность соединения, использовалась ранее для изучения взаимодействия тяжелого метилового спирта с основаниями различной силы [125], а также кислотности гидроксильных групп поверхности окисных катализаторов [151а]. В обоих случаях между ИК-смещением полосы и основностью взаимодействующего соединения (р/Сь) отмечались линейные зависимости. Проведенное нами сопоставление между кислотной константой ионизации оснований р/Са (значения взяты из [1516]) и величиной энергии Н-связи (табл. 10) показало, что зависимость между этими параметрами линейная (рис. 15).
Рис. 15. Зависимость энергии водородной связи органических растворителей с водой от их кислотной константы ионизации
|
|
1 — C6HsN02; 2 —Ch3No2, 3 —(СНзЬ - СО; 4 — С6Н5СНО; 5— (CjHsbO; 6— С4Н802; 7 - С10Н,8; 8 — C5H5N; 9 — (CnHshN, (C2HshNH, (CjH5)NH2