СОСТОЯНИЕ ВОДЫ В ОРГАНИЧЕСКИХ И НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Изучение гидратации ионов в водных растворах
В большинстве работ, посвященных исследованию спектров поглощения воды в растворах электролитов, основное внимание уделяется определению положения максимума поглощения, а изменения формы полос почти не рассматриваются. Однако имеются основания предполагать, что полосы поглощения, наблюдаемые в спектрах, представляют собой результат наложения полос различных ассО' циатов молекул воды, одновременно присутствующих в растворе [140, 265]. И хотя современные методы не позволяют изучать характер изменения полос поглощения отдельных ассоциатов, по перераспределению интенсивно - стей в различных областях суммарной полосы поглощения, по изменению ее формы все же можно получить определенную информацию о характере взаимодействия ионов с молекулами воды и молекул воды друг с другом в гидратной оболочке ионов.
Исследование разбавленных водных растворов в области основных частот валентных колебаний ОН-групп затруднено вследствие очень сильного поглощения жидкой воды, поэтому спектры растворов исследовались нами в основном в обертонной области (7300—5000 см-1). В спектрах растворов соли NaCl изменений полосы поглощения по сравнению с чистой водой не наблюдается [266, 267], однако при замене катиона на магний или калий можно зафиксировать изменение формы полосы поглощения. Наличие в растворе катионов магния вызывает появление дополнительного поглощения в области частот более низких, чем соответствующие максимуму полосы поглощения жидкой воды без соли. Катионы калия создают противоположный эффект: поглощение в низкочастотной области уменьшается, но несколько возрастает в области частот больших, чем частоты максимума поглощения жидкой воды [266].
Приписать наблюдаемый эффект лишь действию поля катиона на ближайшие молекулы воды нельзя, так как образование связи по кислороду вызывает, по-видимому, малые изменения в спектре поглощения ОН-групп. Некоторые авторы считают, что такое взаимодействие вообще в спектрах не проявляется [52]. В связи с этим, вероятно, следует приписать наблюдаемые эффекты изменению энергии связи ОН-групп молекул воды, составляющих ближайшее окружение иона, с молекулами второго Гид - ратного слоя, т. е. «дальнему» действию поля катиона.
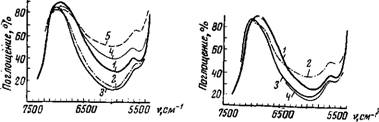
Изменение формы полосы поглощения воды наблюдается и при изменении аниона соли. Присутствие анионов Re04-, С104~, J-, N03~, SCN~ вызывает деформацию полосы поглощения воды аналогично К+, хотя и в значительно большей степени, a S042~, F~, С032-, ОН~ действуют аналогично Mg2+, А13+ (рис. 49, 50).
|
6500 5500 7500 6500 5500 V,C*-1 Рис. 49. ИК-спектры поглощения воды в растворах некоторых сульфатов (концентрация солн 1,5 моль/л по SO42-) |
|
|
|
^ 7500 |
|
3 I------ 1----- 1___ I___ i_ 1500 6500 5500 V, См-' |
|
40 |
|
J____ I___ L |
Во
А: / — раствор Ah(SO<)3; 2—раствор Cr2(SO<)3; 3 — Н20; б: /—раствор ZnS04; 2 — раствор CdS04; 3 — Н20; в: 1 — раствор Li2S04; 2 — раствор Na2S04; S—H2O
По воздействию на спектр воды катионы можно разделить на две группы.
1. Катионы, увеличивающие прочность связи ближайших к иону молекул воды с молекулами второго гидрат - ного слоя:
А18+ > Сг8+; Be2+>Cda+>Zn2+>Mg2+; Li+>Na+.
2. Катионы, уменьшающие прочность связи ближайших к иону молекул воды с молекулами второго гидрат - ного слоя: Cs+>K+.
Соответствующим образом можно разделить на группы и анионы.
1. Анионы, вызывающие деформацию полосы поглощения воды аналогично Mg2+ и другим катионам первой группы:
СО|- > SO2"; ОН" > F-.
2. Анионы, вызывающие деформацию полосы поглощения воды аналогично К+ и другим катионам второй группы:
ReO~ > СЮ" > J - > NO" > SCN - > С1".
В случае, если в растворе присутствуют катионы и анионы, характер действия которых на спектр воды одинаков, деформация полосы поглощения воды заметно усиливается. При наличии в растворе катиона первой группы и аниона второй группы деформация низкочастот
ного крыла полосы поглощения уменьшается. При этом могут одновременно проявляться два эффекта: увеличение поглощения в области 7000—7025 см~[5], как это свойственно всем растворам, содержащим анионы второй группы, и повышение, хотя и относительно меньшее, интенсивности низкочастотного крыла полосы поглощения, как это свойственно растворам, содержащим катионы первой группы (рис. 51).
Несомненно, что наблюдаемые изменения полосы поглощения воды связаны с влиянием ионов на структуру воды, однако вряд ли будет правильным объяснять эти изменения лишь появлением низкочастотной компоненты, относящейся к более сильно связанной воде, и высокочастотной компоненты, принадлежащей воде, водородные связи которой с окружением ослаблены. Возможно, немалую роль в изменении формы полосы поглощения играет и время пребывания молекулы воды в поле иона. Интерпретация наблюдаемых изменений осложнена и тем, что полоса поглощения первого обертона является составной полосой с неразрешенной структурой, в которую вносят вклад по меньшей мере три компоненты: 2vi, 2v3 и (vi + +v3).
Как изменяется частота и интенсивность каждой из этих компонент, на данном этапе исследования сказать невозможно. Однако несомненно, что катионы и анионы первой группы, вызывающие увеличение прочности свя-
|
Рис. 50. ИК-спектры поглощения воды в солевых растворах (концентрация солн 4 моль! л по СЮ4—) / —НгО; 2 — раствор А1(СЮ,)3; 3—раствор LiClO.; 4 — раствор NaCIO,; 5 — раствор КОН |
Рис. 51. ИК-спектры воды в солевых растворах (концентрация соли 4 моль/л)
|
Таблица 18. Сопоставление спектральных и термодинамических характеристик
|
|
Примечание. Отношение D; /Он, О для воды равно 1,00. |
Зей молекул воды, составляющих ближайшую гидратную оболочку ионов и молекул последующих гидратных слоев, упорядочивают структуру воды вблизи ионов. Действие же анионов и катионов второй группы вызывает противоположный эффект и разрыхляет структуру воды. Такая интерпретация изменений спектров воды в растворах электролитов по сравнению со спектром чистой воды подтверждается и анализом влияния на спектры воды изменения температуры [268].
Полученные данные хорошо согласуются со структурной теорией растворов, развиваемой Самойловым [15]. Если в качестве приближенной оценки изменения формы спектра под действием электролитов взять отношение плотности раствора при v = 5900 См~1 (низкочастотное крыло полосы поглощения) к оптической плотности воды при том же волновом числе, то можно провести сопоставление полученной величины /)»//>н2о с данными других физико-химических методов исследования (табл. 18).
В качестве характеристик, с которыми проводится сопоставление этого приближенного и весьма произвольно выбранного критерия наблюдаемых эффектов изменения формы полосы поглощения, были взяты электроотрицательность в водных растворах (%г), энергия активации выхода воды из первой гидратной оболочки (А£,), отношение времен релаксации молекулы воды в поле иона и в поле структуры воды (тг/т) ,■ неоднородность плотности воды в поле катионов (U) и изменение энтропии на границе первой и второй гидратных оболочек (— А5ц) для простых ионов и (—AS») для составных. В табл. 18 соответствующие значения, взятые из работ [18, 204, 269, 270], приводятся в графах для анионов с индексом «А», для катионов — с индексом «К».
Как видно из представленных данных, как для анионов, так и для катионов имеется вполне удовлетворительное соответствие выбранного нами параметра /?гД)н2о, характеризующего упорядочивающее или разупорядочи - вающее влияние ионов на структуру воды, с данными других физико-химических методов.
Наблюдаемые изменения свидетельствуют, по-видимому, о том, что присутствие ионов в растворе нарушает собственную структуру растворителя. Величина этого раз- упорядочивающего эффекта связана с радиусом ионов и различна для катионов и анионов. Вместе с тем вслед ствие поляризации молекул в поле ионов и образования связей между молекулами воды и ионами вблизи последних возникает новая структура воды. Эта структура в присутствии ионов, гидратирующихся слабо положительно или слабо отрицательно, неотличима от структуры чистой воды, но заметно отличается от структуры воды вблизи ионов с сильно положительной или сильно отрицательной гидратацией. В случае положительно гидратирующихся ионов молекулы воды прочнее связаны друг с другом в поле иона, чем в чистой воде, в случае отрицательно гидратирующихся ионов — слабее. Подтверждением изложенных выше представлений является наличие двух состояний воды в растворах с сильно положительно гидратирующимся катионом (Н+, Mg2+, Al^) и сильно отрицательно гидратирующимся анионом (J-, СЮа ). В спектрах таких растворов проявляется и эффект упорядочения структуры и разупорядочения ее, причем эти эффекты проявляются независимо друг от друга, что свидетельствует о существовании вокруг ионов довольно больших областей с измененной структурой воды.
Эффект упорядочения структуры связан не только в величиной заряда иона, но в значительной степени зависит и от его электроотрицательности. Анализ спектров показывает, что высокие значения Z),/Z)h2o наблюдаются для ионов с большой величиной электроотрицательности (/,). В случае же ионов щелочных металлов уменьшение значений Ог/Dн2о в ряду от лития к цезию протекает сим - батно изменениям %i.
Полученные результаты хорошо согласуются с современными представлениями структурной теории электролитов, развиваемой О. Я. Самойловым, но находятся в значительном противоречии с данными Байиса и Чоппина [52]. На основании данных этих авторов, исследовавших большое число растворов электролитов в неудачно выбранной спектральной области (0,8—1,3 мк), ионы цезия должны оказывать такое же влияние на структуру воды, как и ионы лития, вода в растворе фтористого калия должна находиться примерно в таком же состоянии, как и в отсутствие электролитов, и т. д. Результаты работы Чоппина и Байиса были подвергнуты весьма серьезной критике Хорнигом [50]. Данные, полученные нами, подтверждают ее справедливость.
Влияние ионов на упорядочивание или разупорядочи - вание структуры воды обнаружено также при изучении тушения флуоресценции в присутствии солей [28]. Так, при комнатной температуре тушение флуоресценции красителей наиболее сильно в присутствии тех солей, ионы которых разрушают связи в гидратной оболочке красителя. Присутствие же ионов, упрочняющих связи, приводит к очень слабому тушению, либо к полному отсутствию тушения. При температуре жидкого азота для веществ, упрочняющих структуру воды, не только отсутствует тушение флуоресценции, а даже наблюдается сильное «возгорание» ее.
Наблюдаемый эффект можно объяснить тем, что структура воды не может не сказаться на вероятностях излучательных и безызлучательных переходов красителей в водных растворах. В том случае, когда структура воды под воздействием ионов разупорядочивается и, следовательно, создаются условия для более сильного взаимодействия между возбужденной молекулой и средой вследствие ослабления жесткости ее окружения (возможно, с увеличением гидратации молекулы), увеличивается вероятность отвода энергии от возбужденной молекулы (с синглетно-возбужденного и триплетного уровней). Это приводит к тушению флуоресценции как при комнатной, так и при низких температурах.
Если же введенные ионы упорядочивают структуру воды, т. е. ослабляют взаимодействие красителя со средой, должно наблюдаться увеличение интенсивности флуоресценции, которое реализуется только при низких температурах. При комнатной температуре, по-видимому, недостаточны условия для возгорания флуоресценции, поэтому отмечается лишь слабое тушение или даже отсутствие его.