СОСТОЯНИЕ ВОДЫ В ОРГАНИЧЕСКИХ И НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Исследование взаимодействия молекул воды ‘,с ионами в тройной системе Вода — органический растворитель — соль
Одним из основных, но наименее изученных вопросов теории растворов является вопрос о природе сил, обусловливающих взаимодействие между молекулами воды и ионами. Несмотря на многочисленные работы в этом направлении [27, 161, 258—260], проблема является актуальной и в настоящее время еще далека до-завершения.
Изучение природы гидратации ионов по полосам поглощения жидкой воды оказывается крайне затруднительным, так как многочисленные процессы, протекающие в воде при введении ионов, такие, как взаимодействие ионов с молекулами воды, разрыв связей вода — вода и образование новых, отличных от первоначальных, нередко сопровождаются эффектами, носящими противоположный характер. Это усложняет и без того сложную картину спектра жидкой воды и затрудняет интерпретацию наблюдаемых явлений.
Более перспективными для изучения природы взаимодействия воды с ионами являются исследования, использующие какой-либо органический растворитель в качестве среды, в которой протекают взаимодействия между ионами и молекулами воды [161, 258]. Интерпретация спектров поглощения воды в указанных системах невозможна без правильного понимания природы спектров поглощения воды, растворенной в органических растворителях, и характера связей между молекулами воды и молекулами растворителя. Этот вопрос подробно рассмотрен в главе II.
В качестве органической среды использовались ацето - нитрил, пиридин, метилэтилкетон и трибутилфосфат. Эти растворители обладают различными протоноакцептор - ными свойствами, что позволило исследовать влияние последних на характер взаимодействия ионов с молекулами воды.
Перед работой соли и органические растворители тщательно очищались и осушались. Осушка растворителей производилась синтетическими цеолитами типа 4 А, что позволило получить остаточное содержание влаги в них около (1ч-8)-10-3 моль/л. Соли осушались нагреванием при непрерывной откачке вакуумным насосом в течение 24 час.
Выбор солей ограничивался требованиями их хорошей растворимости в указанных органических растворителях. В случае ацетонитрила и пиридина использовались иоди - стые соли (C4H9)4NJ, NaJ, LiJ, BaJ2, CaJ2, MgJ2 и LiClO',. Для системы вода — метилэтилкетон (или трибутилфосфат) — соль были выбраны перхлораты: LiC104, Mg(C104)2, Al(C10*)s, NaClOi.
Исследования указанных растворов Проводились 6 широком диапазоне концентраций воды. Это позволило установить, что в растворах воды в ацетонитриле в пределах концентраций воды 0,1—0,7 моль/л присутствуют смешанные комплексы вода — ацетонитрил [261]. СвЯзь между отдельными молекулами воды отсутствует. Взаимодействие между молекулами воды и ацетонитрила осуществляется за счет образования слабой водородной связи в основном по одной группе О — Н, колебаниям которой соответствует полоса поглощения 3540 см-1. Вторая О — Н-группа молекулы воды не образует прочной связи с молекулой ацетонитрила и находится под поляризующим влиянием ближайших молекул растворителя. Ей соответствует полоса поглощения 3630 см-1. Возможно присутствие в системе ацетонитрил — вода и симметрично нагруженных комплексов, когда молекула воды связана с двумя молекулами ацетонитрила, однако благодаря малой величине энергии водородной связи молекул воды с ацетонитрилом (1,7—2,3 ккал/моль) Равновесие между двумя видами комплексов (симметрично и асимметрично нагруженных), по-видимому, в значительной степени смещено в сторону образования последних.
В системе пиридин — вода в тех же концентрационных пределах также предполагается отсутствие связей вода — вода. Имеет место равновесие между симметрично и асимметрично нагруженными молекулами воды [262]. Значительная величина энергии водородной связи между молекулами воды и пиридина (4,5—5,0 ккал/моль) способствует сдвигу равновесия в сторону образования симметричных комплексов вода — пиридин. Колебаниям О — Н-групп молекул воды, связанных с молекулами пиридина, соответствует широкая полоса поглощения с максимумом 3420 см~К Колебаниям относительно свободной группы О — Н воды в асимметрично нагруженных комплексах отвечает слабая и узкая полоса поглощения 3670 см-1. Исследования тройных смесей ССЦ— CH3CN — вода и ССЦ—C5H5N — вода с различным содержанием компонент позволили проверить и подтвердить эти выводы [261, 262].
Разбавление неполярным растворителем должно привести к уменьшению числа симметрично нагруженных комплексов вода — органический растворитель. В системах ССЦ—CH3CN — вода и ССЦ—C5H5N — вода в спектре фиксируются две полосы поглощения: узкая высокочастотная с максимумом около 3690 смдля ацетонитрила и 3675 см-1 для пиридина, принадлежащая связи О — Н-группы воды с молекулой ССЦ, и широкая низкочастотная, положение которой определяется про - тоноакцепторными свойствами растворителя (3545 смг1 Для ацетонитрила и 3400 см-1 для пиридина), принадлежащая связи О — Н-группы воды с молекулой органического растворителя.
Разбавление неполярным растворителем в большей степени сказывается на спектре поглощения воды в пиридине. Оно приводит к значительному перераспределению интенсивностей полос 3400 и 3675 см-1. Если в растворе воды в пиридине отношение оптических плотностей £>3400/^3675 равнялось 10, то в растворе, содержащем только 10 об.% пиридина, оно равно 1, что свидетельствует об увеличении содержания асимметрично нагруженных молекул воды.
Для уменьшения числа возможных равновесий в тройной системе были выбраны для работы следующие условия:
1) молекулы воды не взаимодействуют друг с другом, для чего использовались разбавленные растворы воды в пиридине и ацетонитриле;
2) был взят некоторый избыток соли по отношению к воде, так чтобы отношение числа молекул воды к общему числу ионов было меньше единицы; это давало возможность ограничить число возможных ассоциаций между ионами и молекулами воды.
В условиях существующего в системе органический растворитель — вода — соль недостатка воды, по-види - мому, происходит образование смешанных гидратно-соль - ватных оболочек вокруг ионов, причем, учитывая, что воды в растворе меньше, чем ионов, представляется маловероятным взаимодействие ионов более чем с одной молекулой воды.
Изучалось влияние солей (CJig^NJ, NaJ, LiJ, BaJi, CaJ2 и MgJ2 на положение и интенсивность полос поглощения воды 3540 и 3630 смрастворенной в ацетонитриле. Исследовались растворы с концентрацией воды, равной 0,45 моль/л. Концентрация солей менялась в пределах от 0,1 до 0,8 моль/л.
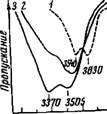
При введении иодистых солей в систему ацетонитрил — вода в области поглощения валентных колебаний молекул воды со стороны меньших частот появляются две новые широкие и достаточно интенсивные полосы поглощения (рис. 43). Положение их в спектре не зависит от концентрации соли, но зависит от природы катиона. Одновременно с появлением новых полос в спектре сохраняются полосы, принадлежащие молекулам воды,
Рис. 43. ИК-спектр поглощения воды в системе ацетонитрил — вода — LiJ
Содержание воды 0,45 моль/л; концентрация LIJ, М: 1 — 0,0; 2 — 0,3; 3 — 3,1
То 3400 3600 V,CM~1
Связанным с молекулами ацетонитрила. Это свидетельствует о том, что при введении солей в систему ацетонитрил — вода часть молекул воды вступает во взаимодействие с ионами. Увеличение концентрации соли вызывает рост интенсивности новых полос и уменьшение интенсивности полос 3540 и 3630 см~х. В ряде случаев эти полосы практически не наблюдаются ■ в спектре. Следует отметить, что концентрация соли, при которой эти полосы перестают наблюдаться, различна для разных солей. Она наименьшая для MgJ2 (около 0,1 моль/л) и наибольшая для NaJ (около 0,8 моль/л).
Положение в спектре обеих полос поглощения, принадлежащих молекулам воды, вступившим во взаимодействие с ионами, как было указано выше, в значительной степени зависит от природы катиона. В табл. 16 (колонки 1 и 2) приведены значения волновых чисел этих полос. Смещение полос поглощения воды в область низких частот растет в ряду Na+<Li+~Ba2+<Ca2+<Mg2+, что свидетельствует об усилении взаимодействий в растворах иодистых солей при увеличении обобщенного момента катиона (пе/г).
|
|
Сосуществование в спектре полос поглощения, принадлежащих молекулам воды, связанным с ионами и свободным от взаимодействия с ними, свидетельствует о
|
Таблица 16 Частоты (смг1) валентных колебаний воды в растворе
|
|
• R — растворитель. |
Том, что в растворах протекает процесс комплексообра - зования.
Предполагается, что образование комплексов происходит за счет возникновения водородной связи между одной из О — Н-групп молекулы воды и анионом иода и донорно-акцепторной. связи между катионом и кислородом воды благодаря наличию у последнего неподеленных электронных пар. Зависимость положения обеих полос поглощения воды, связанной с ионами, от природы катиона подтверждает этот вывод. Чем больше эффективный заряд катиона, тем прочнее донорно-акцепторная связь, что в свою очередь способствует образованию более прочных водородных связей по О — Н-группам молекул воды. Отсюда и наблюдаемое смещение одновременно обеих полос воды в область низких частот.
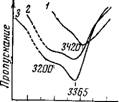
Был снят спектр воды в системе ацетонитрил — вода — LiC104. В спектре присутствуют две близко расположенные полосы поглощения 3490 и 3520 см~1. Полоса 3370 см~ которая наблюдается в спектрах растворов LiJ, отсутствует. Это позволило отнести полосу 3370 см~1 В растворах LiJ к колебаниям группы О — Н молекулы воды, связанной с анионом иода. Аналогично более смещенная полоса поглощения в спектрах растворов иоди - стых солей была отнесена к колебаниям группы О — Н воды, связанной с анионом иода, а менее смещенная — к колебаниям группы О — Н, связанной с молекулой ацетонитрила. Обе связи возбуждены донорно-акцепторной связью с катионом.
Предлагаемый механизм взаимодействий в системе ацетонитрил — вода — иодистая соль подтверждают исследования в области деформационных колебаний молекул воды (1600—1700 см_1). В отсутствие солей в спектре наблюдается полоса поглощения воды 1629 смгх. Введение в раствор иодистых солей приводит к смещению этой полосы в область высоких частот, что свидетельствует об изменениях во взаимодействии воды с окружением в при-
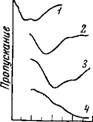
Рис. 44. ИК-спектр поглощения воды в системе пиридин — вода — LiJ
Содержание воды 0,35 моль/л; концентрация LiJ, М: 1 — 0,0; 2 — 0,3; 3 — 0,8
Сутствии солей. Степень смещения полосы к высоким частотам растет в том же самом ряду Na+<Li+~Ba2+< <Ca2+<Mg2+, что и смещение полос воды в области валентных колебаний к низким частотам. Увеличение смещения в зависимости от эффективного заряда катиона свидетельствует об образовании донорно-акцепторной связи по атому кислорода, приводящей к усилению водородных связей по О — Н-группам воды.
|
3000 3400 V,Cm |
Исследования спектров поглощения воды в системе пиридин — вода — иодистая соль показали, что в присутствии соли появляются новые очень широкие и интенсивные полосы, смещенные к низким частотам по сравнению с полосами поглощения воды, растворенной в пиридине (рис. 44). Значения волновых чисел этих полос приведены в табл. 16 (колонки 3 и 4). Их поведение в спектре в зависимости от концентрации соли аналогично тому, что мы наблюдали для полос поглощения воды в системе ацетонитрил — вода — иодистая соль, что позволяет отнести их также к колебаниям молекул воды, иступивших во взаимодействие с ионами. Положение максимумов полос поглощения воды, связанной с ионами, в пиридине не зависит от концентрации соли, но в значительной степени зависит от природы катиона. Смещение их в область низких частот растет в том же самом ряду Na+<Li+~ ~Ba2+<Ca2+<Mg2+, который был установлен для
Сйстемы ацетонитрил — вода — иодистая соль. На осйо - вании полученных данных делается предположение об образовании в изученных системах комплексов типа
/Н... J-
Men+ ...0( (I)
^Н... А
(где A —NCCH3 или NC5H5) за счет образования водородной связи между J--AHHOHOM и молекулой воды и до- норно-акцепторной связи между катионом и кислородом воды.
В спектре поглощения воды для системы пиридин — вода — LiC104 присутствует одна очень широкая полоса 3200 см~1. Полоса поглощения 3365 см~ которая наблюдается в спектре растворов LiJ, отсутствует. Зто позволило отнести более смещенную полосу поглощения в спектрах растворов иодистых солей к колебаниям группы О — Н воды, связанной с молекулой пиридина, а менее смещенную полосу — к колебаниям группы О — Н воды, связанной с анионом иода. Обе связи возмущены донор - но-акцепторной связью катиона с молекулой воды.
Как видно из табл. 16, волновое число полосы поглощения, соответствующей колебаниям О — Н-группы воды, связанной с ^-анионом, не зависит от природы органического растворителя. И в ацетонитриле, и в пиридине оно практически одно и то же. Это лишний раз свидетельствует в пользу высказанного предположения о том, что связь ионов с молекулами воды носит локальный характер (водородная и донорно-акцепторная). Вторая полоса поглощения, соответствующая колебаниям группы О — Н молекулы воды, связанной водородной связью с молекулой органического растворителя, естественно, зависит а значительной степени от протоноакцепторных свойств растворителя. Большая протоноакцепторная способность атома азота молекулы пиридина приводит к значительному смещению этой полосы в область низких частот.
В табл. 17 приведены значения энергии водородной связи ОН-групп воды. Как видно из таблицы, значения энергии водородных связей воды с Л_-анионом или прото - ноакцепторным органическим растворителем существенно зависят от природы катиона. Это вызвано тем, что приведенные величины учитывают не только энергии водородных связей, образуемых молекулами воды, но и вклад
|
Таблица 17 Энергия водородной связи группы О—Н молекулы воды
|
|
Примечание. Значение 8 вычислено по [99], Е — по [126]; R — растворитель |
В эти энергии донорно-акцепторной связи атома кислорода с катионом.
При изучении взаимодействия перхлорат-ионов с водой в среде метилэтилкетона (МЭК) и трибутилфосфата (ТБФ) предварительно были изучены ИК-спектры поглощения кетонов в области колебаний С = 0-группы в присутствии солей и D2O, поглощение Р = 0- и Р — О — С - групп ТБФ ^присутствии солей и Н20, спектр поглощения аниона С107 в области 1000—1200 см~ а также полосы поглощения воды в области основных частот и первого обертона валентных колебаний ОН-групп.
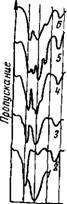
1. Спектры аниона соли. Полоса поглощения СЮГ - группы безводного перхлората натрия симметрична и имеет максимум при 1115 см~1. При растворении безводной соли в осушенном метилэтилкетоне смещения указанной полосы поглощения не наблюдается (рис. 45). В спектре поглощения других безводных перхлоратов [LiC104, Mg(C104)2, А1(С104)з и др.] в области 1000— 1200 см~х наблюдается полоса поглощения, состоящая из трех компонент, положение и интенсивность которых определяются типом катиона-партнера. Такое расщепление полосы поглощения С104~-групп было приписано нами влиянию поля катиона. При растворении указанных безводных солей в осушенном метилэтилкетоне за счет
смещения низкочастотных компонент расщепление рассматриваемой сложной полосы поглощения несколько увеличивается.

|
■ то то у, см- |
При введении в систему кетон — соль легкой или тяжелой воды спектр поглощения резко меняется (рис. 46). Независимо от катиона-партнера в растворах всех перхлоратов в области валентных колебаний СЮ4- группы наблюдаются более симметричные полосы, положение максимумов которых совпадает по частоте с соответствующей полосой безводного перхлората натрия. Однако при большом содержании воды в растворе (молярное соотношение МЭК : H20(D20) = 1 :4) наблюдается понижение частоты полосы поглощения до 1090— 1095 см~1. Аналогичное, но еще более сильное понижение
|
|
0чо то V,Cm-'
То то V,Cm-I
Рис. 45. ИК-спектры поглощения валентных колебаний СЮ4-группы перхлоратов, растворенных в метилэтилкетоне (безводные соли и растворы)
Концентрация соли в рвстворах } моль/л; 1 — безводный NaCl04; 2 — безводный метилэтилкетои; 3—NaC104 в метилэтилкетоне; 4 — L1C104 в метилэтилкетоне; 5 — Mg(C104)2 в метилэтилкетоие; 6 — А1(С104)3 в метилэтилкетоне
Рис. 46. ИК-спектры поглощения СЮл-группы перхлората магния в системе метилэтилкетои (МЭК) —H^O—Mg(C104)2
Молярное соотношение концентраций МЭК : НгО : Mg(ClO<)2. 1 — 20 5 0, 2 — 20:0:1; 3 — 20 5:1; <—10:40:1; 5 —0-55; 1
Рис. 47. Смещение полосы поглощения С = 0-группы кетона при растворении воды и Mg (CIO4) 2
Молярное соотношение концентраций МЭК D20 : (СЮ4)2 1 — 20 5 0, 2 — 20:0: 1; 3 — 10:40:1
частоты наблюдалось нами ранее в кристаллогидратах и концентрированных водных растворах перхлоратов. В разбавленных же водных растворах перхлоратов полоса поглощения более симметрична, и при различных катионах-партнерах положение максимума полосы совпадает с максимумом соответствующей полосы безводного перхлората натрия.
В экстрактах NaC104, Mg(C104)2, LiC104, А1(СЮ4)3 и других солей из водного раствора, содержащего помимо указанной соли сульфат соответствующего металла, полоса поглощения этой группы довольно симметрична и имеет максимум при 1115 см~
Определить положение полос поглощения С104-группы в безводных растворах перхлоратов в трибутилфосфате весьма трудно из-за наложения полос поглощения растворителя.
2. Спектры органического растворителя. Полоса поглощения С = 0-группы безводного метилэтилкетона имеет максимум при 1717 см~1 и не смещается заметным образом при добавлении D20 (вплоть до максимально допустимых концентраций). При введении в безводный метилэтилкетон перхлоратов и иодидов происходит понижение частоты указанной полосы на 5—15 смг1 в зависимости от катиона соли.
При добавлении D20 к этой системе происходит дальнейшее понижение частоты полосы поглощения С = 0- группы до 1690 см~1 (рис. 47), что можно объяснить упрочнением связей между С = 0-группой кетона и катионом соли или молекулами воды ближайшего окружения катиона.
Аналогичные изменения наблюдаются и в спектрах сиСтемы ТБФ — Н20— соль. Полоса поглощения Р = 0- группы безводного трибутилфосфата имеет максимум при 1282—1285 см~1. Присутствие воды понижает частоту указанной полосы на 15—20 см~К Добавление к безводному трибутилфосфату перхлоратов и иодидов различных металлов приводит также к смещению полосы поглощения, величина которого зависит от катиона солей и составляет 2—7 смг1. Последующее добавление к этому раствору легкой или тяжелой воды приводит к дальнейшему понижению частоты полосы поглощения Р = 0-группы. В системе ТБФ — Н20 — А1(С104)з максимум указанной по лосы лежит при 1240 см~ в системе ТБФ — Н20 —
Mg(004)2 максимум поглощения фиксируется при 1255 смгА в системе, содержащей перхлорат натрия,— при 1265 см-1.
В присутствии указанных солей наблюдаются и изменения полосы поглощения Р — О — С-групп (950— 1200 см-1). Полосы поглощения Р = 0-иР — О — С-групп в экстрактах указанных солей трибутилфосфатом деформированы аналогичным образом.
|
3800 3400 V.сиг1 |
3. Спектры воды. При содержании воды в системе МЭК—H20(D20) — соль до 0,5—0,8 моль]л и концентра
Рис. 48. ИК-спектры поглощения воды в системе МЭК— НгО — соль (концентрация воды 0,5 моль/л, соли 1 моль/л)
1 — вода в кетоне без соли; 2 —вода в кетоне в присутствии LiC104; 3 — вода в кетоне в присутствии Mg(C104)2; 4 — вода в кетоие в присутствии А1(СЮ4)з
Ции NaC104 около 1 моль/л в области основных частот валентных колебаний О—Н-групп и в обертонной области полосы поглощения воды практически совпадают с соответствующими полосами воды, растворенной в кето - не, не содержащем соли. При большем содержании воды наблюдается заметный рост полосы поглощения жидкой воды, которая затрудняет анализ спектра. Спектры же поглощения воды в растворах Mg(C104)2 и А1(С104)3 резко отличаются от спектров чистой водывкетоне (рис.48). В области основных частот валентных колебаний ОН - групп воды для раствора, содержащего Mg(C104)2, наблюдается сложная полоса с максимумами при 3200 и 3360 см-1. Полосы в растворе, содержащем А1(С104)3, еще сильнее смещены в низкочастотную область. Структура полос выражена слабо и в значительной степени маскируется поглощением жидкой воды, поэтому можно, используя формулу, полученную методом теоретического моделирования [126], дать лишь приближенную оценку энергии водородной связи, образуемой молекулами воды,
составляющими ближайшее окружение катиона, со средой:
NaCI04—МЭК—Н20 2,5—3,0 ккал/связь, LiCIOi—МЭК—Н20 4,5—5,0 ккал/связь,
Mg(C10i)a—МЭК—Н20 6,5-7,0 ккал/связь.
Для растворов, содержащих перхлорат алюминия, энергия связи имеет еще более высокое значение, но оценить ее трудно вследствие недостаточного разрешения полос в спектре.
В обертонной области также наблюдается смещение полос в низкочастотную область в ряду NaC104<LiC104< <Mg(C104)2<Al(C104)3. При содержании воды свыше 1 моль/л и содержании соли около 1 моль/л наблюдаются полосы, которые характерны для ассоциатов типа вода — кетон [263], при концентрации воды свыше 2,5—3 моль! л Наблюдаются также полосы поглощения жидкой воды. Смещение полос в спектре воды определяется в основном типом катиона.
При содержании воды 0,5—0,8 моль/л в спектре ОН - колебаний не обнаруживаются полосы, которые можно было бы приписать молекулам воды в гидратной оболочке аниона; при большей концентрации воды интерпретация спектра затруднена наложением полос воды в ассоциатах вода — кетон и полос жидкой воды.
При содержании воды около 30—40 моль/л происходит гидратация аниона. Структура воды в этих условиях сильно нарушена присутствием молекул кетона, что позволяет образоваться слабым связям НОН...ОСЮГ. Это предположение находится в хорошем согласии с термодинамическими данными по гидратации анионов в 50%-ных водно-диоксановых растворах [264].