СОСТОЯНИЕ ВОДЫ В ОРГАНИЧЕСКИХ И НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Исследование состояния воды в объектах фотосинтеза
Изложенные выше результаты по прочности водородных связей воды в различных соединениях — органических и неорганических — нашли применение не только при изучении механизма адсорбции воды на силанольных поверхностях, но и при изучении состояния воды в биологически важных соединениях.
Известно, что структурные изменения клетки — это главным образом структурные изменения внутриклеточной воды, которая является основным по массе компонентом клетки. Это послужило причиной все возрастающего интереса исследователей к изучению состояния и роли воды в биологических системах и живом организме [335, 336].
Огромную роль вода играет и в процессе фотосинтеза, являясь единственным "источником кислорода, выделяемого растениями. Разложение воды является первичным процессом фотосинтеза. Однако механизм его до настоящего времени не установлен. Несомненно, что он состоит из нескольких частей, от окисления воды до конечного результата — выделения молекулярного кислорода. Промежуточные же стадии и система, окисляющая воду, пока неизвестны. Более того, окончательно не установлено даже, в какой форме происходит окисление воды.
Существуют различные точки зрения по этому вопросу. Одни придерживаются мнения, что окисление ее происходит посредством гидроксильных групп, которые образуются за счет присоединения воды к карбонильной группе хлорофилла [337]:
/он
>С=0 + Н20 >С<
Х / Х)Н
Другие считают, что вода окисляется в виде гидрок - сильного иона [338] или гидроксильной группы [339].
Наконец, существует мнение, что вода разлагается в комплексе хлорофилл — вода, в котором она находится в виде недиссоциированных молекул [340].
Все сказанное является свидетельством того, что отсутствует общепринятое мнение о процессе разложения и окисления воды при фотосинтезе, знание которых может пролить свет на выявление механизма фотосинтеза в целом.
Такой же вывод следует из краткого обзора по состоянию воды в хлорофилле, к которому мы переходим.
Состояние воды в хлорофилле
В настоящее время наиболее достоверным является положение о том, что единственным источником кислорода, выделяющегося в процессе фотосинтеза, является вода. Существуют, однако, иные представления: выделение кислорода из углекислого газа [341] и возможность выделения кислорода фотосинтеза из ортофосфат-иона [342]. Последнее не подтвердилось при экспериментальной проверке [343]. Первое предположение несостоятельно ввиду полного совпадения изотопного состава кислорода фотосинтеза и кислорода воды (при условии тщательной очистки выделяемого кислорода от примеси углекислого газа и кислорода воздуха [344]).
Таким образом, остается принять, что только при разложении воды выделяется кислород фотосинтеза. Отсюда следует важность проблемы изучения состояния воды при фотосинтезе.
Представляет интерес вопрос о роли пигмента и ферментных систем в процессе разложения воды. Из ферментов цитохром и флавин рассматриваются как возможные участники этого процесса [345, 346]. При этом цитохромная система либо осуществляет электронный перенос между системами хлоропластов, либо непосредственно участвует в окислении воды.
Что касается одного из наиболее важных вопросов — роли хлорофилла в процессе разложения воды, то его нельзя считать окончательно решенным.
По исследованию хлорофилла и его аналогов имеется ряд опубликованных работ [344, 347—349], но они не затрагивали вопроса изучения взаимодействия воды с пигментом, формы вхождения воды в молекулу хлорофилла. Лишь в последние годы, когда в химии и биологии с успехом стали применяться физические методы исследования, в частности спектральные, которые служат надежным и мощным методом в решении структурных задач, появились подобного рода исследования.
Анализ ИК-спектров твердых пленок хлорофилла и его металлсодержащих аналогов привел авторов работы [350] к выводу о том, что наблюдаемая широкая полоса поглощения 3400 см~ расположенная в области характеристических частот колебаний ОН-связей, возмущенных водородной связью, относится к молекуле воды, связанной одновременно с двумя атомами азота пирроль - ных ядер пигмента.
ИК-спектры пленок хлорофилла, подверженных вакуумной тренировке, изучались и в работе [351]. Было найдено, что для хлорофилла Ь вид спектра в области 3200—3600 см-1 существенно не изменялся. В то же время для хлорофилла а наблюдалось постепенное уменьшение и полное исчезновение этой полосы, которая восстанавливалась обратимо при впуске паров воды. Авторы пришли к выводу, что молекулы воды в хлорофилле находятся не в свободном состоянии, причем с хлорофиллом Ь они связаны более прочно.
Изучению прочности взаимодействия воды с хлорофиллом, выявлению места такого взаимодействия, выяснению влияния связанной воды на спектральные свойства пигмента посвящена работа [352]. Для рассмотрения этих вопросов авторы использовали спектры поглощения в инфракрасной и видимой областях, спектры флуоресценции. Качественно установлено, что связанная вода в хлорофилле а и Ъ имеет различную прочность. Место возможного взаимодействия хлорофилла а с водой — атомы кислорода циклопентанонного кольца.
Вопрос реакционной способности хлорофилла при изучении изотопного обмена его атомов водорода рассмотрен ib работе [353]. Спектральное изучение дейтери - рованных хлорофиллов а и Ъ привело к выводу о высокой способности к изотопному обмену хлорофилла а по сравнению с хлорофиллом Ъ.
Существование связанной воды обнаружено не только в хлорофилле а, Ь, но и в а--Ъ, а также в феофитине а + Ь [354]. На основании этого можно утверждать, что присутствие атама магния >в молекуле пигмента не является обязательным три (взаимодействии его с водой, что> подтверждает сделанный в работе [350] аналогичный вывод.
Вопрос о влиянии воды иа природу агрегации в хлорофилле а и этилхлорофиллиде а разбирается в одной из последних работ [355], где на основании изучения ИК- спектрав этих веществ авторы полагают, что вода ic этил - хлорофиллидом связана как-то механически, Ib То время как с хлорофиллом а эта связь по природе очень специфична.
К выводу о существовании воды в связанном состоянии приходят и авторы еще одной работы [356] при изучении методом ЭПР свободнорадикальиых состояний в лиофилизованных тканях животного и растительного происхождения. Они (нашли, что для возникновения и гибели свободных радикалов необходимо наличие в клетках 10—11% связанной воды.
Из краткого изложения и сопоставления (результатов, содержащихся >в литературных источниках, становится ясно, что метод ИК-спектроскопии предоставляет большие возможности для выяснения природы взаимодействия хлорофилла с водой. Вместе с тем эти 'возможности не исчерпаны до конца, в частности, количественная оценка прочности связи пигмента с водой не установлена.
Отсутствует единая точка зрения в вопросе о способе координации молекулы воды В связи с этим (представляло интерес исследование состояния воды в хлорофилле, с тем чтобы в какой-то мере 'решить эта вопросы с помощью ИК-спектроскопии Это стало возможным только в результате детального изучедия природы и прочности взаимодействия воды с молекулами окружения в (растворах органических соединений и в кристаллогидратах
Энергия водородной связи воды в хлорофилле
В качестве объектов исследования использовались препараты хлорофиллов а и Ь, выделенные из крапивы по методу [357], чистота которых по мапнию и азоту составляла 99,9±0,4%.
ИК-|Спектры были получены для кристаллических образцов, спрессованных с КВг в таблетки, а также для
твердых пленок (толщиной в несколько. микрон), полученных выпариванием эфирных растворов пигментов (по методу, описанному в [351]).
|
|
К сожалению, спектры пленок в области поглощения воды представляют собой широкую слаборазрешен - ную полосу. Однако, несмотря на отсутствие в них отчетливо выраженного структурирования, при сопоставлении спектров пленок и таблеток обнаруживается сходство их между собой. Если же сопоставить спектры таблеток хло-
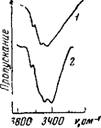
Рис 63 ИК спектры поглоще ния прессованных таблеток хлорофилла а (/) и хлоросрил ла Ь (2)
Рофилла а и хлорофилла Ь, то оказывается, что в области валентных колебаний воды для них наблюдается широкая полоса в интервале 3100—3600 см-1, которая в спектре хлорофилла b несколько смещена в область низких частот (рис. 63, 1 и 2).
Как и для кристаллогидратов, по частотам валентных колебаний воды, смещенных в результате образования водородных связей, был произведен (расчет энергии этих связей, результаты которого представлены в табл. 24.
|
Таблица 24 Энергия водородной связи воды (ккал) В хлорофилле а и Ь
|
Из приведенных данных прежде всего следует, что метод подготовки образцов (таблетка или пленка) не влияет на природу 'взаимодействия воды с пигментам, на прочность
образуемых ею связей. В пределах ошибок определения значения энергии связи совпадают для образца, приготовленного в виде таблетки и тонкой пленки.
Кроме того, расчет показывает, что значение энергии более прочной связи молекулы. воды в хлорофилле а на 0,7—0,8 ккал меньше, чем в хлорофилле Ь, в то .время как значения энергии менее прочных связей для них совпадают.
Наши расчеты подтвердили ранее сделанные Ib работе [352] выводы о том, что в хлорофилле Ь вода более прочно связана. Кроме того, на основании обратимых изменений интенсивности полосы 1675 см~х (С = О...Н—О—) в спектре хлорофилла а при пуске паров H2O/D2O и их откачке авторами сделан вывод, что одним «з мест взаимодействия пигмента с водой являются атомы кислорода циклопентанонного кольца.
Значения энергии водородной связи молекул воды, полученные расчетным методом, хотя и являются весьма приближенными, но также дают возможность определить место такого взаимодействия. Мы [рассчитали, что энергия связи воды с карбонильной группой для ацетона, например, составляет 2,7, метилэтилкетона 2,5 ккал/связь. В случае хлорофилла же получилось значение энергии менее прочной связи молекулы воды 2,6—2,9 ккал/связь, Т. е. близкое к значению энергии связи С = О...Н—О—Н. Это позволяет очитать вполне оправданным предположение о том, что вода может быть координирована атомом кислорода циклопентанонного кольца.
Следует, однако, отметить, что это не единственный вид ассоциации. Из табл. 24 видно, что величина энергии наиболее прочной связи воды в хлорофилле находится в пределах 5,0—6,1 ккал. Очевидно, эта энергия характеризует иную ассоциацию, чем типа С = О...Н—О—Н. Наиболее вероятным является предположение о существовании водородной связи воды с гетероатомом азота, входящим в структуру молекулы хлорофилла. Это основывается на полученных нами данных об энергии взаимодействия молекул воды с атомом азота, например, в пиридине или аминах. Она имеет примерно то же значение 5,0 ккал/связь для пиридина и ~5,8 ккал/связь для этил - амина (глава II, § 1).
К аналогичному выводу, хотя, на наш взгляд, недостаточно обоснованному, пришли Сидоров и Теренин [350], анализируя ИК-спектры хлорофилла и его аналогов. Основываясь на сходстве формы полосы (поглощения молекул воды, связанных с хлорофиллом (3400 см~х), с полосой жидкой ©оды (3400—3500 см-'), авторы полагают, что, как и в жидкой воде, при взаимодействии с хлорофиллом связываются водородной связью оба атома водорода молекулы воды. Предположение о том, что местом присоединения молекулы воды следует считать два атома азота пиррольных ядер пигмента, подтверждается, по мнению авторов, тем, что полоса поглощения молекулы воды, связанной одновременно с двумя молекулами пиридина, также имеет сходство с полосой поглощения жидкой воды.
То обстоятельство, что для взаимодействия воды с пигментом посредством водородной связи присутствие атома металла не является обязательным [350, 354], также свидетельствует в пользу данной интерпретации.
Следует отметить, что хотя предложенный Сидоровым и Терениным [350] способ координации молекулы воды одновременно к двум атомам азота хлорофилла по обеим ОН-связям (N...H—О—H...N) и возможен, однако не является обязательным и единственно возможным. Полагать, что молекула воды присоединяется посредством ОН-связи только к карбонильной группе кислорода (С = О...Н—ОН) [352], на наш (взгляд, также не совсем верно. Такие способы координации возможны, вместе с тем возможны и другие:
С=Ю... Н—О—Н... N; С=0 .. Н—О—Н... 0=С;
N...Н—О—Н.
Более того, возможно образование ассоциатов вода — н
Нч )0
Вода типа )0 ... W. Такое заключение сделано Н/
Вследствие того, что в спектрах хлорофиллов, полученных нами, имеется полоса ~3450 см~ которая относится к валентному колебанию ОН-групп молекул воды, связанных друг с другом водородной связью. Эта полоса, однако, в 'расчетах у нас не фигурировала. Тогда возможна координация молекулы воды одновременно к группе
С = О или атому азота, с одной стороны, и к соседней молекуле воды—с другой:
С=0 ... Нч N... Нч
W W
Это тем более верно, что в ряде работ [350, 354] отмечалась активизирующая роль атома (металла, особенно Mg, при комплексообразовании хлорофилла с водой.
Полученных нами экспериментальных и расчетных данных, однако, недостаточно для какого-либо суждения относительно причин образования хлорофиллом b более прочных Н-связей с водой, чем хлорофиллом а.
Возможность дополнительного взаимодействия хлорофилла b с водой благодаря наличию альдегидной (группы (что привело бы « более прочной связи воды) является, на наш взгляд, маловероятной. Исходя из спектральных проявлений водородной связи, неодинаково возмущенным молекулам воды в ИК-спектре должны соответствовать полосы с разными частотами. Взаимодействие воды с альдегидной группой пигмента привело бы тогда к появлению в спектре новой полосы, частота которой характеризовала бы прочность именно данного взаимодействия. Мы же получили. результат, несколько отличный от описанного. Вероятнее всего, большую силу. взаимодействия хлорофилла b с водой следует отнести за счет большей протоноакцепторности этого пигмента, что зависит от электронного (строения молекулы. Наличие в молекуле хлорофилла b альдегидной группы приводит ik перераспределению электронной плотности, возможно, таким образом, что усиливает протоиоакцепторные свойства активного электронодонорного центра, образующего Н - связь с водой. Несомненно, что для окончательного решения вопроса необходимы дополнительные исследования.
Взаимодействие воды с биологически важными веществами
Все схемы первичного процесса фотосинтеза предполагают, что при разложении воды непременными участниками процесса являются хлорофилл и вода. Кроме того, он протекает в присутствии целого ряда биологически важных соединений, таких, как микошнамиддинуклеотид (NAD), аденозиндифосфат (ADP), микотинамиддинук - леотидфосфат (NADP), неорганические фосфаты (Р), ци - тояром. На рис. 64 'представлена такая схема первичного акта фотосинтеза, предлагаемая Виттом [360]. Указанные соединения хотя и изображены на ней, между тем роль их, возможность взаимодействия с водой, влияние их присутствия на состояние воды неизвестны. Более того, в литературе отсутствуют какие-либо указания на рассмотрение т обсуждение этих вопросов. В то же время не
О? nadp-h2 atp
Рис. 64. Элементарная схема -------
Разложения воды по Витту хлоропласт свет [360]-------------- 1
Н;0 nadp adp Р
Исключена возможность того, что выяснение именно этих вопросов могло бы пролить свет на 'решение в целом процесса разложения воды.
Для изучения возможного взаимодействия воды были выбраны наиболее важные, неизменно присутствующие в процессе фотосинтеза готовые препараты ADP, NAD, NADP, Р, NAD-Иг, цитохрома. Взятые в кристаллическом состоянии, они прессовалась в таблетки с КВг. Чистоту соединений гарантируют фирмы: «Cyclochemical Corporation» (Калифорния)—NAD, NAD-H2; «Boehringer»— NADP; «Reanab — ADP.
Сопоставим спектры поглощения хлорофилла а и Ь, с одной стороны, с ИК-спектрами исследованных веществ — участников процесса фотосинтеза — с другой.
ИК-юпектр цитохрома с, в состав 'которого, как и в хлорофилл, входят порфириновые кольца, в области 3000—3700 см~1 совпадает оо спектром воды в хлорофилле а. В результате сходства их ИК-спектров в области валентных ОНнколебаяий все рассуждения, проведенные для хлорофилла (точнее хлорофилла а), оказываются справедливыми и для цитохрома с. Он образует с водой комплексы такого же типа, какие были предложены для хлорофилла а. Следует отметить, что соотношение интен - оивностей полос всего спектра несколько иное, чем в случае хлорофилла а. Наличие полосы ~3450 см-1 с наи
большей интенсивностью говорит о том, что в цитохраме С преобладают аосоциаты типа вода — вода.
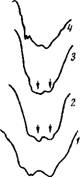
Аналогично были проанализированы ИК-спектры валентных колебаний воды в соединениях NAD-H2, NADP, NAD, ADP и Р (рис. 65). Данные по энергиям связей воды с Р04-анионом были взяты из полученных ранее (глава III) результатов.
Для )всех названных препаратов в области поглощения воды (3000—3700 см~х) располагаются также полосы N—Ннколебаний. Однако интерпретированные нами, согласно данным работы [361], частоты N—Н-колебаний из дальнейшего рассмотрения исключались. Для проверки достоверности интерпретации были дополнительно получены ИК-шектры соединений, содержащих группы
У N, NH, NH2, а также их спектры при добавлении малых количеств воды.
Полосы же поглощения валентных колебаний воды для всех соединений смещены в низкочастотную область по сравнению с хлорофиллом а и Ь. В связи с существующей зависимостью между прочностью образования молекулой воды водородной связи и смещением частоты ее валентного колебания следует, что вода в указанных веществах образует водородную связь более сильную, чем в хлорофилле. Проведенная оценка энергии Н-связи воды в анализируемых кристаллических веществах подтвердила это предположение. Результаты расчета сведены в табл. 25. Представленные в таблице значения энергии свидетельствуют о том, что в исследуемых соединениях существуют различные по прочности Н-связи воды.
Если сопоставить результаты, представленные в табл. 24, то окажется, что энергия более прочной Н-связи молекул воды в хлорофилле значительно меньше, чем тех же
|
|
|
I I |
|
3800 3400 3000 V.см' "ы полосы связанной воды) |
Рис 65 ИК-спектры поглощения неорганических фосфатов (1), никотииамидаденин - динуклеотидфосфата (2), аденозиндифосгра - та (3) и хлореллы (4) (стрелками показа-
|
Таблица 25 Частоты валентных колебаний воды, возмущенные водородными связями, и энергии Н-связей
|
Связей в приведенных в табл. 25 соединениях. Вторая энергетически менее прочная связь воды в этих соединениях также является довольно сильной (в среднем 6,0 ккал). Найденным энер1иям, вероятнее всего, соответствуют водородные связи вода — фосфат (так как они либо совпадают с энергией связи воды в неорганических фосфатах, либо близки к ней) или предположительно вода — азот в NAD и NADP (энергия Н—О—H...N, как указывалось ранее, в пиридине и аминах 5,0—6,0 Ккал/связь) [362].
Расчет энергии проводился, как и для хлорофилла, по частотам валентных колебаний воды, поэтому на рис. 65 в качестве примера представлено поглощение в этой спектральной области для некоторых соединений. Из рисунка видно, что в спектрах изученных кристаллических солей отсутствует полоса у ~3600 см~Следовательно, несвязанных ОН-групп в данных соединениях нет. В то же время в неорганических фосфатах существование таких групп вполне возможно, доказательством чего служит наличие полосы при 3600 см~1. Можно, таким образом, полагать, что в соединениях NAD, ADP, NADP мо-' лекула воды одновременно участвует в двух водородных
Связях за счет обоих атомов водорода. В связи с тем, что энергия этих Н-связей то обеим ОН-связям неодинакова, молекула воды образует асимметричный комплекс.
Возможность подобного рода ассоциации воды показана для гидрата аденозинфосфата [363], в котором молекула оводы вписывается между гетероциклической частью одной молекулы и фосфатной труппой другой, образуя две водородные связи длиной 2,863 и 2,824 А по схеме:
NH2 ... Н20 ... о
/ / NH... О-Р—О
В дальнейшем мы попытались с помощью ИК-спект - ров изучить состояние воды в природных водорослях, представителем которых является хлорелла. Для этих целей хлорелла, предварительно отцентрифугированная из водного раствора и высушенная до пастообразной массы, тонким слоем наносилась на подложку из бромистого калия. Затем записывался ее ИК-спектр в области валентных колебаний воды. Поскольку хлорелла очень сложный объект исследования, ее спектр также сложен, и полосы разрешены слабо (см. рис. 65, 4). Однако можно сказать, что вода в ней находится в связанном состоянии и энергия наиболее сильной водородной связи составляет около 6,9 ккал/связь, т. е. по своей величине она приближается к значению энергии связи воды с группой Р = 0. Существование такой связи в хлорелле вполне возможно вследствие того, что общее содержание фос - форильных группировок в биологических системах велико (они входят в состав Р, ADP, NADP, NAD), а следовательно, велика и вероятность образования подобного типа связей. Наряду с этим не исключена возможная координация воды другими протоноакцепторными элементами системы, в частности атомом N. Но в результате того, что содержание последних в хлорелле меньше, чем Р=0-групп, связь их с водой в спектре отчетливо не проявляется.
Резюмируя полученные из эксперимента данные по энергии Н-связи, можно сказать, что вода образует прочные водородные связи не только с хлорофиллом, но и с Р, ADP, NADP, NAD. Более того, Н-связи воды в этих последних оказались энергетически более прочными, чем в хлорофилле.
Если вспомнить положение о том, что внутриклеточная вода в хлоропластах жестко связана [350], и добавить к этому полученные нами данные по прочности водородных связей воды, а также учесть, что в NAD, ADP, NADP оба атома водорода молекулы воды образуют водородные связи, то на основании всего изложенного можно предположить, что вода в этих соединениях находится в напряженном состоянии (как бы на растяжках): А...Н—О—Н...В. При этом А=т^В, и энергия связи А...Н—О—Н не равна энергии связи Н—О—Н...В. Не исключена, однако, возможность того, что в ряде случаев А=В, и тогда молекула воды образует симметричный комплекс.
Исходя из численных значений энергии Н-связей А...Н—О—Н и Н—О—Н...В, полученных для изученных соединений, можно полагать, что в качестве протоноак - цепторных атомов или групп А и В могут быть атом азота N и фосфорильная группировка Р = 0, входящие в структуру анализируемых веществ. Тогда не исключается возможность существования комплекса типа Р = О...Н—О—H...N.
Поскольку все изученные нами химические соединения являются биологически важными и входят в состав растений, описанный выше механизм комплексообразо - вания воды с электронодонорными центрами, очевидно, возможен и в природных объектах, в которых процесс фотосинтеза реально существует.
Действительно, приближенная оценка энергии Н-связи воды, проведенная по ИК-спектрам хлореллы, является в какой-то степени доказательством возможности подобного взаимодействия воды в случае In Vivo. Однако в силу того, что хлорелла представляет собой слишком многообразный и сложный объект исследования и поэтому обладает спектром более богатым, не представляется возможным делать какие-либо конкретные выводы по механизму и возможным типам ассоциации молекул воды в ней. Очевидно, в хлорелле вода может образовывать и симметричные (А...Н—О—Н...А) и асимметричные (А... Н—О—Н...В) ассоциаты, а может быть, и комплексы типа А...Н—О—Н. Следует только отметить, что если бы существовал комплекс типа А...Н—О—Н, был бы, по - видимому, возможен частичный быстрый обмен кислорода, что в действительности не имеет места [350].
Существование воды в напряженном состоянии подтверждает идею Теренина [364] о том, что вода, участвующая в процессе фотосинтеза, как бы заранее подготовлена к разложению.
Соображение о возможном взаимодействии с водой помимо хлорофилла других соединений, которые являются участниками процесса фотосинтеза, является аргументом в пользу возможного участия последних в процессе разложения воды. В пользу данного же предположения свидетельствует и тот факт, что количество связанной воды в хлорелле, например, больше, чем количество хлорофилла [365]. Это приводит к логичному выводу о том, что хлорофилл не может быть основным участником и единственным виновником разложения воды. Поэтому можно считать, что предложенная схема напряженного состояния воды (NADP) N...НОН...0 = P(ADP, Р) более вероятна, чем существовавшее до сих пор представление воды в виде изолированных молекул или молекул, ассоциированных только друг с другом.
Образование молекулой воды двух довольно сильных водородных связей по обеим ОН-группам, конечно, снижает энергию разложения воды, если этот процесс происходит в ранее приведенном комплексе А...Н—О—Н...В. При этом осколки молекулы воды (группы ОН и Н) находятся в связанном состоянии, а не в свободном, как в случае простой диссоциации.
Дальнейшее окисление воды до молекулярного кислорода происходит, очевидно, в виде гидроксильной группы, находящейся в связанном состоянии. Это согласуется с мнением других авторов [365]. Однако механизм разложения и окисления воды требует дополнительных специальных исследований.