СОСТОЯНИЕ ВОДЫ В ОРГАНИЧЕСКИХ И НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Исследование механизма экстракции
Выяснение механизма экстракции сильных кислот — одна из наиболее интересных и наиболее сложных задач теории экстракции. К сожалению, ценное для своего времени представление об оксониевом механизме экстракции таких соединений в последние годы, по-видимому, сдерживало развитие работ по механизму экстракции кислот и не совсем верно их ориентировало. Так, это представление не требовало изучения гидратации экстрагирующихся соединений; более того, считалось, что участие воды в образовании соединения должно препятствовать извлечению.
В действительности оказалось, что вода играет исключительно важную роль в процессе экстракции, причем именно как составная часть экстрагирующихся соединений.
Основной задачей проведенного нами исследования [284] было выяснение роли воды при экстракции комплексных металлгалогенидных кислот и характера взаимодействия кислородсодержащих органических растворителей с молекулой экстрагирующегося соединения.
Вначале изучалась экстракция Fe(III) и Tl(III) из хлоридных растворов. Эти системы интересовали нас главным образом как типовые модельные системы. Можно считать, что механизм экстракции образующихся при этом соединений, особенно в его части, касающейся гидратации и сольватации, является в значительной мере общим для соединений такого типа.
Экстракция железа(Ш) из хлоридных растворов
В процессе изучения механизма экстракции железа(III) из солянокислых растворов было обнаружено, что формы существования железа в экстракте и в водной фазе различны [284]. В связи с этим было выполнено более обстоятельное спектрофотометрическое изучение комплексооб - разования железа в водных хлоридных растворах [285]. Работа позволила заключить, что в водной фазе при экстракции железа из растворов соляной кислоты присутствует преимущественно комплекс FeCl3(H20), а в экстракте— только анион FeCU-.
В водных хлоридных растворах железа в зависимости от концентрации хлорид-ионов были обнаружены комплексы Fe(H20)e3+1_ FeCl(H20)26+ [или FeCl2(H20)t], FeClj(Н20) и FeCli. Особенно интересно то, что комплекс FeCir присутствует в заметных количествах лишь при концентрации хлорид-ионов выше 7—8 М.
Спектрофотометрическим методом было изучено ком - плексообразование в растворах хлорида железа в ряде органических растворителей в присутствии соляной кислоты. Исследование показало, что в органических растворителях FeCir образуется гораздо легче, чем в водных растворах. Практически во всех растворителях спектр поглощения, характерный для аниона FeClT, проявляется вплоть до очень низких концентраций соляной кислоты (6-Ю-4 М).
Неожиданно была обнаружена [285, 286] идентичность спектров растворов безводного FeCl3 в органических растворителях (в отсутствие избытка хлорид-ионов) и спектра FeClT- Это объясняется присутствием*в таких растворах иона FeCli" за счет дислропорционирования, которое легко проходит в неводной среде.
Обнаружена и подробно исследована экстракция железа из растворов FeCl3 в серной или хлорной кислоте [287]. Анализ равновесных органической и водной фаз на железо и хлор, зависимость экстракции от молярного отношения Cl:Fe в равновесной водной фазе и другие данные позволили сделать заключение, что железо и в этих условиях (т. е. в отсутствие избытка хлорид-ионов) экстрагируется в виде HFeCl4. При этом, что вполне естественно, извлекается не более 75% железа.
Была изучена также экстракция железа из растворов хлоридов лития, магния, кальция, алюминия и некоторых
других металлов [288]. Интересно, что коэффициенты распределения в ряде случаев сравнимы с коэффициентами распределения, полученными при экстракции из НС1. Проведенный нами химический анализ органических фаз свидетельствует о том, что экстрагируются соли состава LiFeCU, Ca(FeCl4)2, Mg(FeCl4)2.
Методом ИК-спектроскопии были исследованы сольватация и гидратация экстрагирующихся соединений железа. Было показано прежде всего, что молекулы
|
Щ So 50 |
|
40 30 Го |
|
|
|
|
З! з0
|
-1 |
30 80 -
40
1800 то 1600 1800 1700 1600 1800 1700 1600 VjCHT
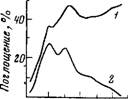
Рис. 53. ИК-спектры поглощения экстрактов, полученных при извлечении железа дибутнловым эфиром
А — из 9,8 М НС1; 6 — из 8,2 М LiCl; в — спектр чистого дибутилового эфира. Исходная концентрация FeCl3 равна 0,18 М; полоса при 1700 сл-1 принадлежит гидроксонию
Органического растворителя и воды входят в состав экстрагирующихся соединений, причем находятся в катион - ной части [289—292].
Исследовался механизм сольватации катионной части экстрагирующихся соединений железа и параллельно некоторых минеральных кислот. В ИК-спектрах экстрактов, содержащих HFeCl4, НСЮ4 или H2S04 в простых и сложных эфирах, была обнаружена широкая полоса с максимумом около 1700 см~ принадлежащая гидроксонию Н30+. На рис. 53 в качестве примера показан спектр одного из экстрактов с характерной полосой гидроксония. Эти и другие данные указывали на то, что катионная часть экстрагирующихся сильных кислот представляет собой сольватированный молекулами воды и органического растворителя гидроксоний [289, 291, 293—297]. Поскольку в гидратированном гидроксонии заряд, по-видимому, делокализован, более правильно говорить просто о гидратированном протоне.
Механизм сольватации экстрагирующихся солей типа Me(FeCl4)n, как было установлено, в известной степени
R,
О 0
/ J
В, н / R,
0
A
У
H
|
FeCi; |
|
/ R, |
|
/ ч |
|
H У I H I f ( 0 / |
R, R2
Рис. 54. Структура экстрагируемого комплекса
Аналогичен механизму сольватации кислот. Молекулы воды присоединяются непосредственно к катиону металла, и гидратированный катион в дальнейшем сольватиру - ется молекулами органического растворителя [294, 2Уб] (рис. 54).
Экстракция таллия(Ш) из хлоридных растворов
Методом ИК-спектроскопии (в обертонной области ОН - колебаний воды) изучен механизм гидратации экстрагирующихся соединений таллия [298]. В качестве растворителей в этом случае использованы диэтиловый, диизо - пропиловый, дибутиловый эфиры, амилацетат и цикло - гексанон. Исследование спектров экстрактов в зависимости от концентрации соляной кислоты, от концентрации таллия и других факторов показало, что вода входит в состав экстрагирующихся соединений. Было установлено, что анион Т1С1Г координационно не гидратирован, вода связана с ионом водорода, т. е. находится в катион - ной части экстрагирующегося соединения. Полученные данные хорошо согласуются с химическими данными о содержании воды в экстрактах.
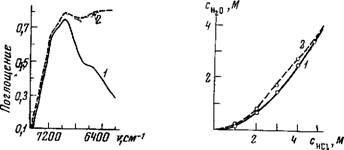
На рис. 55 показана полоса поглощения в экстракте с НТ1СЦ, принадлежащая сильно связанной воде (6200 см~1, поглощение принадлежит гидроксонию).
В экстракте с LiTlCU этой полосы, как и следовало ожи дать, нет.
Рассмотрим в качестве примера одно из доказательств того, что анион Т1СЦ - в органической фазе не гидрати - рован. Мы экстрагировали таллий из хлоридного раствора, приготовленного таким образом, чтобы он практически не содержал ионы водорода (гидролиз таллия, связанного в прочный хлоридный комплекс, незначителен).
|
|
|
Mo Бзоо V,Cm-1 |
Рис. 55. ИК-спектры поглощения воды в экстрактах таллия (III) в амилацетате (концентрация таллия 0,1 г-атом/л) / — экстракт из 1,25 Af раствора НС1; 2 — экстракт из 2 М раствора LiCl
В раствор перед экстракцией вводили хлорид тетрафе - ниларсония, и таллий экстрагировали метилизобутилке - тоном в виде тетрахлорталлата тетрафениларсония. В экстракте определяли воду и сравнивали полученные данные с данными о содержании в соответствующем холостом экстракте, не содержащем таллия.
Было показано, что содержание воды в экстрактах с таллием не отличается от содержания ее в холостых экстрактах. ИК-спектры также показали отсутствие сильно связанной воды.
Мы экстрагировали таллий (III) также из растворов хлорида лития. Коэффициенты распределения таллия растут с ростом концентрации LiCl в водной фазе и достигают довольно высоких значений, хотя и меньших, чем в растворах НС1 той же концентрации. Экстрагирующиеся соединения гидратированы. Гидратные числа этих соединений (LiTlCU) уменьшаются с ростом концентрации LiCl, так же как и в случае НТ1СЦ, но по абсолютному значению они меньше.
Следовательно, механизм экстракции сильных кислот, который был выяснен в этих исследованиях, можио назвать гидратно-сольватным или гидроксониевым. Существо этого механизма заключается в том, что протон кислоты непосредственно взаимодействует не с кислородом органического растворителя, как считали ранее (оксо-
ниевый механизм), а с кислородом воды, образуя гидро - ксоний, который в свою очередь может гидратироваться и сольватироваться молекулами органического растворителя. Последнее — необходимое условие экстракции.
Экстракция рения трибутилфосфатом [299]
Возможность экстракционного извлечения рения (VII) трибутилфосфатом из кислых сред была показана в ряде работ [300, 301]. Однако роль воды и характер образующихся комплексов были исследованы недостаточно полно, хотя были основания предполагать, что вода входит в состав экстрагента и существенным образом влияет на характер процесса.
Известно, что соединения с фосфорильной группой Р=0 координируют молекулы воды. Это подтверждается и данными спектральных измерений. В присутствии воды полоса Р = 0-группы (1285 см'1) расщепляется на две компоненты—1270 и 1285 см-1, причем с увеличением концентрации воды интенсивность низкочастотной компоненты увеличивается, а высокочастотной уменьшается [280, 301а].
При введении небольших количеств НС1 полоса поглощения Р=0-группы имеет те же компоненты, что и при введении воды без НС1. Заметный сдвиг (60— 80 см-1) наблюдается лишь при содержании НС1 выше 4—5 моль/л. Аналогичное смещение наблюдалось ранее [302], когда в обезвоженный ТБФ вводился сухой НС1, причем описанное изменение интенсивности и положения полосы поглощения было приписано образованию сильного взаимодействия между протоном кислоты и Р=0- группой молекулы ТБФ. Введение небольших количеств сухого НС1 в растворитель, содержащий определенное количество воды, вызывает изменения спектра, аналогичные наблюдаемым при введении соляной кислоты.
Таким образом, при введении в ТБФ, содержащий воду, соляной кислоты, по-видимому, наряду с комплексами (С4Н9)зР0...Н20 появляются и комплексы (С4Н90)зР0...(Нз0+Н20)С1-, причем количество их увеличивается с возрастанием концентрации НС1. При малом содержании воды и высоком содержании НС1 образуются и комплексы, в которых протон кислоты не гид - ратирован [ (С4Н90)3Р0...НС1].
Аналогичный эксперимент был проведен и с рение* вой кислотой. Результаты эксперимента совпадают, чтс позволяет сделать вывод о тождественности процессов в присутствии НС1 и HRe04.
Такое предварительное рассмотрение упрощенной системы вода —ТБФ—НС1 и вода — ТБФ—HRe04 (при постоянном содержании воды) облегчило рассмотрение экстракционных систем, в которых концентрация воды меняется в зависимости от исходной концентрации кислоты в водной фазе.
Для экстрактов НС1 трибутилфосфатом из водных растворов наблюдалась полоса гидратированного иона гидроксония, однако интенсивность полос поглощения воды, связанной с растворителем, уменьшается в значительно меньшей степени, чем наблюдалось при постоянном содержании H20 в растворе. На основании этого можно сделать вывод, что комплекс формируется при избытке воды, т. е. в водной фазе или на границе раздела фаз. В этом случае гидратация протона осуществляется не за счет отрыва молекул воды от растворителя, но за счет молекул водной фазы.
Для проверки этого предположения были сопоставлены количество воды в фазе органического растворителя, определенное методом Фишера, количество воды, связанное с растворителем, определенное спектральным методом, и количество НС1 в фазе органического растворителя, определенное титрованием.
Полученные данные свидетельствуют, что на одну молекулу НС1 приходятся четыре молекулы воды в гидрат - ном слое протона, т. е. образуется ион Н9О4"1", который замещает воду в гидратной сфере трибутилфосфата, и что анион не гидратирован. Таким образом, экстрагирующийся комплекс имеет, вероятно, следующее строение: [(С4Н90)зР0...Н904^С1-
Экстракты рениевой кислоты по характеру спектра совершенно не отличаются от холостых экстрактов соляной кислоты, однако поглощение в области полос иона Нэ04 значительно выше для экстрактов HRe04, чем для экстрактов НС1 с такой же исходной нормальностью в водной фазе (рис. 56). Это объясняется, по-видимому, более высоким коэффициентом распределения HRe04, чем НС1. Совпадение спектров экстрактов НС1 и HRe04 трибутилфосфатом свидетельствует о сходстве механиз
ма экстракции указанных кислот и об идентичности строения их комплексов.
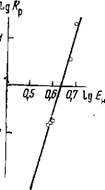
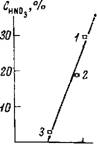
Для экстрактов из солянокислых растворов KRe04 характер спектров поглощения не изменяется, однако рост полосы поглощения иона Нэ04+ идет менее интенсивно, чем в случае экстракции из чистого HRe04. На графиках (рис. 57), полученных по спектральным измерениям, показана зависимость изменения содержания воды в гидратной оболочке ионов гидроксония для экстрактов из растворов соляной кислоты с KRe04 и растворов соляной кислоты, не содержащих Re, от концентрации НС1 в водной фазе. Характер указанных зависимостей свидетельствует о существовании конкуренции между С1- и Re04~ за обладание местом в образующемся комплексе. Присутствие С1~ препятствует экстракции Re04~, вместе с тем введение в раствор НС1 необходимо для создания катионной части комплекса. Как видно из рис. 57, максимальное расхождение указанных зависимостей приходится именно на это значение концентрации НС1. При более высоких концентрациях НС1 в водной фазе в основном экстрагируется НС1, и кривые сближаются.
|
Рис 56. ИК-спектры поглощения в обертонной области воды в экстрактах трибутилфосфата из растворов НС1 (/) и HRe04 (2); исходная концентрация кислоты в водной фазе в обоих случаях 2 N Рис. 57. Зависимость общего содержания воды в гидратиой оболоч ке протонов от исходной концентрации НС1 в водной фазе |
|
' — экстракты без Re; 2 —экстракты, содержащие Re |
На основании ряда спектров воды в экстрактах из среды с одной и той же концентрацией НС1, но различ-
|
|
|
I i ii ''ii. 0,5 Jo |
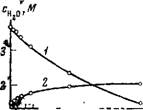
Рис. 58. Зависимость содержания воды в экстрактах из солянокислых растворов KRe04 от концентрации Re в органической фазе
/ — изменение содержания воды, непосредственно связанной с трибутилфосфатом; 2 — изменение общего содержания воды в гидратной оболочке протонов
Ным содержанием Re получена зависимость, приведенная на рис. 58. С увеличением содержания Re количество воды, связанное с ТБФ, уменьшается почти линейно, что свидетельствует об уменьшении растворимости воды в органической фазе в присутствии Re04_.
Изучение влияния некоторых факторов иа извлечение ионных ассоциатов реиия(VII) и техиеция(УИ) [152, 280, 303, 304]
1. Извлечение из кислых сред. Изучение влияния характера высаливающих кислот и их концентрации, присутствия в водных растворах кислот посторонних солей, концентрации инертных разбавителей на извлечение HRe04(HTc04) в той или иной степени подтверждает предположение, что при извлечении спиртами, альдегидами, ТБФ и кетонами в фазе растворителя наряду с сольватированными ионами находятся сольваты ионных ассоциатов общего вида H904S«"f(H20)i;Sm(304). Причем не исключена возможность образования водородной связи анионом с одним из протонов молекулы воды (НгО);,, кислород которой также связан водородной связью с Н904+(Нз0+). Значения пит являются переменными и зависят как от природы растворителя, так и от характера и концентрации высаливающей кислоты и концентрации высаливаемых HRe04(HTc04). При относительно невысоких концентрациях HRe04 и довольно большом содержании H2SCU, как это показано на примере извлечения ТБФ, количество молекул воды в сольвате постепенно уменьшается, и в конечном результате извлечение протекает по оксониевому механизму.^
Также установлено, что на значение коэффициента распределения (D) оказывает влияние как извлечение
высаливающих кислот, так и характер гидратации аниона. Значения D убывают в ряду
HgP04 H2S04 НС1 HNOs HJ нсю4.
Введение солей с одноименным анионом приводит к снижению значения D вследствие уменьшения активности водородных ионов.
На значение коэффициента распределения существенное влияние оказывает структура растворителя, причем для нормальных спиртов, кетонов и альдегидов имеет место линейная зависимость lgD от соответствующих сте - рических параметров (отношение числа атомов кислорода к числу атомов углерода, отношение молекулярных весов СО-группы и кетона и т. д.); для изовторичных и третичных спиртов, кетонов и альдегидов имеют место отклонения (особенно значительные в сторону повышения значения D для циклических). Этот эффект, вероятно, объясняется различием в строении молекулярных орбит.
Исследования показали, что составы сольватов зависят от условий высаливания. Так, при извлечении HRe04 изоамиловым спиртом из IN H2SO4 сольватное число (П+т) равно 3, при извлечении из 6—7 N H2S04 — 2. Аналогичная картина имеет место и при извлечении ТБФ. Природа изменения сольватных чисел связана, вероятно, с частичной дегидратацией гидратированного протона водорода и, как показывают исследования экстрактов методом ИК-спектроскопии, с изменением характера взаимодействия растворителя при уменьшении числа молекул воды в сольвате смещения полос Р = 0- и Р—О—С-колебаний ТБФ значительно возрастают.
Различие при извлечении из кислых сред спиртами и ТБФ, с одной стороны, и кетонами — с другой, проявляется во влиянии концентрации рения на степень извлечения. Для первых в области концентрации рения Ю-8— 10° М степень извлечения сохраняется постоянной, для кетонов несколько падает с увеличением концентрации. Этот факт объясняется, вероятно, различием в растворимости соответствующих сольватов в растворителях.
2. Извлечение из солевых и щелочных растворов. При извлечении из солевых и щелочных растворов кетонами, аминами, альдегидами, ТБФ и спиртами в фазу растворителя переходят сольваты ионных ассоциатов, веРоятно, общего вида S2Mex+(0H2)n-Sm(0H2)!/Si(304)x, где значения у, Z, п, I, т зависят от условий извлечения.
При этом можно высказать предположение о том, что природа воды, находящейся в фазе экстрагента в присутствии сольватов ионных ассоциатов, является двоякой. С одной стороны, это вода, входящая в состав сольватов ионных ассоциатов и гидратно-сольватных оболочек ионов, и, с другой стороны, вода, входящая в состав ассоциатов с растворителем.
Поскольку в рассматриваемом нами случае наибольшее влияние оказывает перренат-ион, то можно высказать предположение, что в условиях отсутствия высаливания и самовысаливания значения коэффициентов распределения в рядах ассоциатов с одно - и двухвалентными катионами должны быть близки (т. е. Du+Reo-~A:s+Reo4
0 ^MgReO+ReO-^^CdReO+ReO-' Н0 ^Me+ReCT ^^MeReO+ReOT 44 44 4 4
Вследствие меньших значений вторых констант ассоциаций в водной и органической средах). С другой стороны, при введении высаливающих агентов с одноименным катионом должно быть соответствие в рядах значений D, Упорядочивающего или разупорядочивающего действия анионов высаливателей и значений Ks* и Кв*, причем в этом случае обезвоживающе-оводняющее действие ионов высаливающих агентов на высаливаемые должно сказываться сильнее, чем на растворитель.
Действительно, экспериментально установлено, что при экстрагировании индикаторных количеств (Ю-7— 10-8 М) перренатов щелочных металлов метилэтилкето - ном в отсутствие высаливающих агентов значения коэффициентов распределения весьма близки (для Li+ReOT" 1,68; Na+ReOr 1,65; K+Re07 1,67; Rb+Re07 1,75; Cs+Re04 1,80). Кроме того, повышение температуры в области 15—30° С не приводит к существенным изменениям значений D, т. е. процесс извлечения является или изоэнтальпийным, или весьма близким к нему. В ряду ассоциатов с двухвалентными катионами в отсутствие высаливающих агентов и процессов самовысаливания значения D также близки (для MgRe04+Re04~ 1,12; CdRe04+Re07 1,15; MnReOr+ReOT" 1,17), но в то же время значительно ниже, чем для ассоциатов с одновалентными катионами.
Введение высаливающих агентов приводит к различным значениям D в зависимости от природы анионов и катионов высаливателя как при извлечении кетонами, так и ТБФ или аминами с неэкранированным азотом. По своему действию ионы высаливающих агентов располагаются в ряды
Li+ > Na+ > К+ > Rb+ > Cs+; Cus+ > Cd,+ > Zn*+ > Nia+ >
> Mn2+ > Mga+ > Caa+ > Sra+> Baa+; CO2- > SO2- > Mn02~>
> WO2"; CH3C00">F->0H->CI->Br->N0;>N03 >J->C10~,
В основном совпадающие с рядом упорядочивающе-раз - упорядочивающего действия этих ионов на структуру воды. С другой стороны, на значения D в случае высаливания иодидами и перхлоратами также оказывает влияние конкурирующее извлечение ассоциатов, содержащих эти анионы, что в сочетании с сильным разупорядочива - нием структуры воды приводит к резкому снижению значения D.
Сопоставление изменений D и коэффициента высаливания (К$*) метилэтилкетона от значения параметров, характеризующих изменение состояния молекул воды, находящихся в ближайшем окружении высаливаемых ионов, показало, что на процесс извлечения сольватов ионных ассоциатов накладывается процесс извлечения ассоциатов вода — растворитель, однако вклад процесса обезвоживания высаливаемых ионов имеет большее значение, чем оводнения растворителя.
Изучение влияния концентрации высаливающих агентов в зависимости от характера их гидратации показало, что происходит повышение или понижение D(DDfdc>0; DD/Dc=0; DD/Dc<0). (Последний случай характерен для высаливающих агентов с сильно отрицательно гидрати - рующимися ионами.) Однако в случае положительно гидратирующихся ионов высаливающих агентов, для которых в определенной области концентраций DD[Dc>0, Имеют место такие значения с, при которых DDfdc=0. При дальнейшем повышении с DD/Dc=0. Такой ход кривых извлечения в зависимости от концентрации, вероятно, связан с процессами обезвоживания ионных ассоциатов, т. е. с уменьшением значений п и у и, вероятно, I и т. Не исключена возможность и того, что при очень больших. концентрациях высаливателей в водной фазе образуются ионные ассоциаты типа Ме+Э04~, сольваты которых либо не образуются, либо если и образуются, то не извлекаются растворителями. Необходимо отметить, что положение максимумов на кривых D—свыс зависит как от гидратации ионов высаливающих агентов, так и от природы растворителя. Во всех исследованных случаях Стах при извлечении ТБФ имеют большие значения, чем при применении в качестве растворителей кетонов. Этот факт может быть объяснен большим значением энергии водородной связи ТБФ—НгО, а также и тем, что в состав сольватов в этом случае, вероятно, входит меньшее число молекул воды.
Исследования состояния воды в экстрактах в ТБФ и метилэтилкетоне методом ИК-спектроскопии показали, что в первом случае процессы оводнения растворителя перренат-ионом относительно невелики, в то время как для кетона (не только для МЭК, но и для циклогекса - нона, метил-н-пропилкетона, диэтилкетона и ацетофено - на) они играют важную роль. В результате такого воздействия (что также характерно и для ионов Tc04~, J-, С104_, SCN-) на структуру воды и состояние растворителя в водном растворе солей этих анионов определение гидратных чисел простыми методами вряд ли возможно. (Так, при извлечении сольвата перрената кадмия при учете холостых опытов мольное отношение Н20: Re04 составляет 11-Мб.)
Таким образом, высказанное предположение о двоякой роли воды, находящейся в фазе экстрагента в присутствии сольватов ионных ассоциатов, экспериментально подтверждается, т. е. вода входит в состав сольватов ионных ассоциатов и гидратно-сольватных оболочек ионов, а также в состав ассоциатов с растворителем.
Рассмотрение предварительных данных по извлечению нитросоединениями указывает на принципиально отличный механизм извлечения, что особенно хорошо видно из обратного порядка высаливающего действия катиона.
Экстракционная способность органических веществ и реакционная способность их функциональных групп
Соединения, являющиеся бутил - и бутоксизамещенными фосфорной кислоты—(С4Н90)3Р0, (С4Н90)2(С4Н9)Р0, (С4Н90) (С4Н9)2РО и (С4Н9)3РО,—были неоднократно апробированы в качестве реагентов при экстракции ни - трозонитрата рутения [305 , азотной кислоты [306], уранилнитрата [148, 149, 307], а также Pu(VI) и Pu(IV) [148]. Во всех случаях отмечается рост экстракционной способности в ряду фосфат—>-фосфонат—>-фосфинат—*• —>-фосфинокись (табл. 19).
|
Таблица 19 Корреляция коэффициентов распределения веществ при экстракции Pu (VI) и U (VI) и энергии водородной связи экстрагеита с водой
|
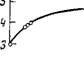
Как выяснилось в результате изучения прочности образуемых этими соединениями ассоциатов с водой, она возрастает в той же последовательности. Более того, между этими величинами — прочностью водородной связи типа Р = О...Н—О—Н и коэффициентом распределения при экстракции уранилнитрата—существует пропорциональная зависимость (рис. 59). Если же по оси абсцисс отложить логарифм энергии Н-связи, а по оси ординат логарифм коэффициента распределения при экстракции уранилнитрата реагентами указанных классов при условии концентрации органической фазы 0,5 М в ССЦ, содержания уранилнитрата в исходной водной фазе 0,2 М (данные по КР взяты из [148]), то получается зависимость, близкай к прямой линии (рис. 60).
Полученное соответствие не является случайным. Согласно современному представлению, экстракция уранилнитрата из водных растворов фосфорными соединениями происходит путем образования комплекса с эксТрактом типа и0г(Ы03)2-2ТБф [308—310].
Известно, что в реакции взаимодействия уранилнитрата с экстрагентом принимает активное участие атом кислорода фосфорильной группы Р = 0. В работе [149] было показано, что в присутствии уранилнитрата частота колебания фосфорильной группы vp=o имеет тенденцию к уменьшению. Для последнего члена указанного ряда экстрагентов она уменьшается в среднем на 80—90 см~х. В то же время частота колебания Р—О (в группе Р—О—С) практически не изменяется по величине, оставаясь равной —1030 см~х. Это означает, что кислород эфирных групп экстрагентов не принимает участия в их комплексообразовании с уранил - нитратом.
Если комплексообразование уранилнитрата с фосфор - органическими реагентами происходит посредством Р = 0-группы, то степень извлечения уранилнитрата этими экстрагентами зависит от реакционной способности функциональной группы, участвующей в комплексообразовании (в данном случае Р = 0), от ее способности отдавать электрон. Это же свойство является показателем степени прочности водородной связи Р = О...Н—О—Н, энергии этой связи. Отсюда становится понятной прямая зависимость между рассматриваемыми величинами: энергией Н-связи экстрагента с водой и его коэффициентом распределения.
Аналогично корреляционная зависимость имеет место между энергией Н-связи алкилфосфорных реагентов с
Nnjinn Ijjaia lyuwyupvpi Ахшчсшпмн ре - ~ Z Г 9 Агентами и логарифмом энергии *
|
£н, ккал/сВязь
|
|
|
|
0 |
|
________ j__________ i__________ l 0 0,5 5,0 50 Tfp
При экстракции уранилнитрата фос - форорганическнми реагентами и энергией их водородных связей с водой Рис. 60. Корреляционная зависимость между логарифмом коэффициента распределения при экстракции уранилнитрата фосфорорганическими ре- |
Н-связн экстрагента с водой
Водой и количеством азотной кислоты, переходящей вэк - страгент (рис. 61). Данные по проценту перехода HN03 в органическую фазу взяты из [306]. Вследствие того, что зависимость построена для трех точек, ее следует считать приближенной. Однако ценность ее заключается в том, что она указывает на возможность симбатных изменений и, кроме того, подтверждает наличие прямой
Рис. 61. Зависимость между процентом перехода в органическую фазу азотной кислоты при извлечении фосфорор1 эпическими реагентами и энергией водородных связей с водой типа Р = О...Н—О—Н
1 - ТБФО; 2 — ДВЭФ; 3 - ТБФ
Пропорциональной зависимости между энергией водородной связи с водой и параметром, характеризующим степень извлечения экстрагируемого элемента.
Показателем электронодонорной способности фосфо - рильной группы является также величина константы комплексообразования, например, с уранилнитратом. Изучение комплексообразования уранилнитрата с фос - форорганическими соединениями ряда
Трибутилфосфат трнбутилфосфонат -* трибутнлфосфинокись, (ТБФ) (ДБЭБФ) (ТБФО)
Проведенное Воденом и др. в работе [307], позволило установить, что константа комплексообразования растет в указанном ряду. Ее порядок: U02 (Ш3)2 • 2ТБФ 12,0 UOj (N03)2 ' 2ДБЭБФ 9,5 • 10* UOa (N03)2 ■ 2ТБФО 3,8-10».
|
3 4 5 Е н, нкал/'сйязь |
Это свидетельствует об увеличении прочности соединений U02(N03)2-2T при переходе от трибутилфосфата к трибутилфосфинокиси. Следовательно, в той же последовательности возрастает полярность группы Р = 0,
Сопоставление величины энергии водородной связи с водой с параметрами, характеризующими экстракционную способность соединений, мы провели на примере Р=0-содержащих фосфорорганических реагентов. К сожалению, сведений относительно экстракционной способности С = О, S = 0 и NO2 имеется ограниченное количество. Так, в работе [311] представлены максимальные коэффициенты распределения при извлечении четырехвалентного плутония из азотнокислых растворов диэти - ловым эфиром и бензальдегидом. Они соответственно равны 11,5 и 3,5. Как видно из табл. 4 (см. стр. 35), диэтиловый эфир также образует и более прочный комплекс с водой по сравнению с бензальдегидом.
Кроме того, в работе [304] представлены значения коэффициентов распределения при экстракции Re(VII) из 2N растворов серной кислоты для реагентов: нитроме - тан, нитробензол, бензальдегид, трибутилфосфат, алкил - амины (табл. 20).
|
Таблица 20 Корреляция коэффициента распределения при экстракции Re (VII) и энергии водородной связи экстрагента с водой
|
Из данных таблицы следует, что увеличение коэффициента распределения и энергии водородной связи с водой для изученных экстрагентов происходит в направлении от нитробензола к аминам. Естественно, не следует ожидать, что такая зависимость будет линейной, так как приведенные в табл. 20 реагенты относятся к различным классам соединений и имеют разные протоно - акцепторные группы. Вместе с тем имеет место прямая пропорциональная зависимость.
Рассуждения, проведенные для соединений с полярной группой Р = 0, настолько общие, что могут быть применены и к соединениям других классов с аналогичными кислородсодержащими функциональными группами.
Вследствие этого можно ожидать, что в пределах одного класса соединений, содержащих одинаковую прото - ноакцепторную группу, между этими параметрами в логарифмической шкале будет зависимость, близкая к линейной.
Установленное соответствие между коэффициентом распределения экстрагента и энергией его водородной связи с водой для класса фосфорсодержащих реагентов может представлять определенный интерес. Величина энергии водородной связи с водой может быть рекомендована в качестве критерия при выборе экстрагентов в пределах одного класса, а также при синтезе новых ' реагентов данного класса.
Следует заметить, что Николаев с сотрудниками
[312] нашли обратную зависимость между энергией связи Р = 0-группы некоторых фосфорорганических экстрагентов и их экстракционной способностью при извлечении уранилнитрата. На основании этого авторы считают, что энергия связи Р = 0-группы может быть критерием экстракционной способности соединений данного класса. Полученная нами обратная корреляционная зависимость (линейная) между энергией связи фосфорильного кислорода и энергией водородной связи, образуемой с водой этой группой, лишний раз подтверждает предположение о том, что и прочность водородной связи также может служить мерой экстракционной способности соединений.
Вместе с тем не только мерой экстракционной способности может служить энергия водородной связи. Она может быть использована и для определения реакционной способности органических соединений.
Известно, что реакции, протекающие с участием органических растворителей, зависят от способности последних к координации. Исходя из этого, растворители можно рассматривать либо как доноры, либо как акцепторы. Подобная химическая классификация неводных растворителей в зависимости от наличия у них донорных или акцепторных свойств была предложена Гутманом
[313] . Он ввел количественную характеристику донорно-акцепторной способности растворителей, так называемое «донорное число». Последнее представляет собой взятую с обратным знаком величину энтальпии реакции присоединения молекулы растворителя к пентахлориду
Сурьмы. Метод универсален, удобен, однако не лишен недостатка: он справедлив в тех случаях, когда компоненты реакции (стандартный акцептор и растворитель) взаимодействуют в соотношении 1:1, реакция протекает до конца и механизм реакции постоянен. Мы предлагаем использовать количественную характеристику прочности водородной связи для оценки протоноакцепторной способности органических растворителей. В этом случае стандартным донором протона будет служить вода. Этот способ справедлив для соединений, способных к образованию водородных связей (координационных связей, осуществляемых с участием атома водорода молекулы воды).
Мы провели сопоставление полученных нами значений энергии водородных связей некоторых электронодо - норных растворителей с «донорной силой» (по Гутману) тех же растворителей. Оказалось, что между этими величинами существует прямая пропорциональная зависимость (табл. 21).
|
Таблица 21 «Донориые числа» и энергия водородных связей с водой некоторых органических растворителей
|
Наличие корреляции между «донорной силой» и рассчитанной нами энергией водородной связи свидетельствует о том, что предложенный нами метод оценки донорно-акцепторной способности органических соединений справедлив и может быть с успехом использован даже в тех случаях, когда метод Гутмана неприменим. Одним из достоинств предлагаемого нами метода является также и то, что он может быть применен не только к жидким неводным растворителям, но и к кристаллогидратам с различными анионами. В последнем случае оценивается энергия водородных связей, образуемых анионом с кристаллогидратной водой.