СОЕДИНЕНИЕ МЕТАЛЛОВ В ТВЕРДОЙ ФАЗЕ
ПРИМЕРЫ АНАЛИЗА ВЗАИМОДЕЙСТВИЯ МЕЖДУ МЕТАЛЛАМИ
Ранее отмечалось, что процессы схватывания твердых тел происходят при взаимодействии тонких приповерхностных слоев, которые по своим энергетическим и структурным характеристикам при любом состоянии поверхности существенно отличны от объема твердого тела.
Сварка и спекание проводились в среде аргона, поскольку проведение процесса в вакууме приводит к появлению летучих веществ и «вытравливанию» свариваемых материалов.
В обычных условиях (окружающая атмосфера и комнатная температура) поверхности металлов покрыты окислами и другими загрязнениями различного происхождения. Термодинамически более устойчивыми являются соединения с кислородом, поэтому именно эти соединения в процессе сварки препятствуют в наибольшей степени образованию химических (металлических) связей между атомами соединяемых поверхностей. Было показано также, что длительная обработка большинства металлов при высоких температурах и в вакууме (не ниже 10-8 мм рт. ст.) обеспечивает удаление с поверхности окисного слоя, но не получение абсолютно чистой (ювенильной) поверхности.
В работах [57, 58] обобщены результаты многочисленных исследований, свидетельствующие о чрезвычайно высокой стабильности хемосорбированных слоев кислорода вплоть до предплавиль - ных температур. Так, окись вольфрама WOs восстанавливается водородом при 500° С, в то время как хемосорбированный слой кислорода может быть восстановлен водородом при температурах выше 1200° С. Аналогичные закономерности получены также на никеле.
В работе [58 ], по-видимому, впервые предложена методика расчета изменения изобарно-изотермического потенциала комплекса хемосорбции:
TOC o "1-5" h z Me + Оа —» MeO AGOK. (26)
Me + 02 —. О Me[1] А GxeM, (27)
О Me* Me О AGnp. (28)
По закону Гесса можно записать:
АСхем = A G0K—А Спр. (29)
Образование прочной химической связи кислорода с металлом
обусловлено незаполненным d-уровнем энергии электрона у пере
ходных металлов. Для непереходных металлов с заполненным d-уровнем адсорбированный кислород менее прочно связан с поверхностью металла и более предпочтительным является образование окисла [58].
Уравнение (29) позволяет определить значения изменения изобарно-изотермического потенциала образования комплексов хемосорбции на металлах. Значения AGOK можно найти, например, в справочниках [51, 52]. В описываемой методике принято, что значения AGnp близки к значениям изменения изобарно-изотермического потенциала испарения соответствующих металлов, так как перестройка структуры комплекса хемосорбции в структуру окисла связано с удалением избыточных атомов металла. Таким образом, значения AGnp можно также найти в упомянутых спра-
чтительным процессом имеет знак плюс.
|
вочниках. Поскольку при взаимодействии атомно чистой (ювенильной) поверхности металла с кислородом хемосорбция является термодинамически более предпо- |
|
|
|
АС, |
|
пр |
|
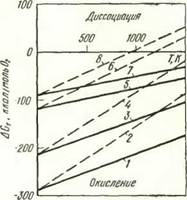
Рис. 6. Диаграмма A Gj. — Т системы Me — 02 — О Me (Me О) при Pq^ = = 760 мм рт. ст. (1, 3, 5, 7) и Pq = = 3.5- 10-» мм рт. ст. (2. 4, б? 8): 1,2 — ОМо; 3, 4 — ONi; 5, 6 — NiO; 7, 8 — Си, О |
На рис. 6 приведены температурные зависимости изменения изобарно-изотермических потенциалов образования комплексов хемосорбции или окислов на молибдене, никеле и меди для двух значений давления —760 и 3,5-10 9 мм рт. ст. [59]. Применительно к меди расчет произведен только для образования окисла, поскольку медь является непереходным металлом. Сопоставление прямых 3—5 и 4—6 свидетельствует о том, что хемосорбция является термодинамически более предпочтительным процессом по сравнению с образованием окислов.
Из сопоставления этих же прямых следует, что в случае хемосорбции повышение температуры оказывает большое влияние на уменьшение прочности связи атомов металла и кислорода, так d АСхем 4 А0ОК
|
> |
то
как
dT " dT '
В качестве примера рассмотрим расчет AGxeM для никеля при температуре 1000 К и давлении кислорода 760 и 3,5-10'9 мм рт. ст. Для взаимодействия никеля с кислородом AGiroo = —75 ккал/моль
2. Для испарения никеля AGr=65,6 ккал/г-атом №. Таким образом, по уравнению (10) для давления кислорода 760 мм рт. ст. и Т = 1000 К'- AGxeM = —75—65,6 = —140,6 ккал/моль 02. Для давления кислорода 3,5-10'9 мм рт. ст. AGxeM = —140,6 —
— 4,57 • 1000 lg - = —88,7 ккал/моль Ог.
Однако приведенные зависимости учитывают лишь влияние температуры и давления на изменение значений соответствующих изобарно-изотермических потенциалов. В реальных условиях вакуумного нагрева металлов и сплавов (в том числе и при сварке давлением с подогревом) существенное влияние на термодинамику и кинетику процессов окисления-восстановления будут оказывать остаточные газы, т. е. вакуум необходимо рассматривать как контролируемую атмосферу сложного состава с низкими парциальными давлениями компонентов. Попытка оценить влияние этих остаточных газов была предпринята в работе [60], но там лишь
3
|
33 |
Э. С. Каракозов
|
СОСТАВ ОСТАТОЧНЫХ ГАЗОВ ПРИ ОТКАЧКЕ ТЕХНОЛОГИЧЕСКОГО ОБЪЕМА ДВУМЯ ТИПАМИ НАСОСОВ [001
|
|
Примечание. Давление незарегистрированных компонентов не превышает 5-10~‘° мм рт. ст. |
рассматривается взаимодействие с бинарными атмосферами СО— С02 и н2—н2о.
Выполним расчет изменения изобарно-изотермических потенциалов реакции окисления-восстановления в вакууме для составов остаточных газов, приведенных в табл. 4, с учетом стехиометрических коэффициентов реакции и парциальных давлений компонентов по уравнениям:
Me + У, т (ГО) = О Me 4- X п (ГВ), (30)
Ме+ £т(ГО) = МеО+ Vn(rB), (31)
где ГВ — газ-восстановитель;
ГО — газ-окислитель.
Поскольку в условиях вакуума длина свободного пробега молекул составляет сотни метров, а «время жизни» молекул в адсорбированном состоянии на поверхности металла чрезвычайно мало при применяемых температурах нагрева, то в расчетах принимали, что температура газообразных молекул равна комнатной.
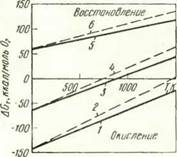
Результаты расчетов, представленные на рис. 7 (прямые /, 3, 5), показывают, что независимо от того, какие средства откачки технологического объема применены — масляные или безмасляные, значения изменения изобарно-изотермического потенциала реакции для одного и того же материала оказались одинаковыми. Это обусловлено тем, что уменьшение по абсолютной величине изменения изобарно-изотермического потенциала за счет более низкого
давления кислорода над окислом или комплексом хемосорбции при применении безмасляных средств откачки компенсируется более высокой концентрацией газов-восстановителей в остаточной атмосфере при применении масляных средств откачки.
|
Рис. 7. Диаграмма AGT — Т системы Me — вакуум — ОМе (MeО) для случая вакуумного нагрева при использовании масляных средств откачкн (/, 3, 5) и состояния физического контакта между соединяемыми металлами (2, 4, tf): ОМо — /, 2; ONi — 3. 4; CuaO — 5. 6 |
Из сопоставления прямых при одинаковых остаточных давлениях кислорода (рис. 6, прямые 2, 4, 8 и рис. 7, прямые 1, 3, 5) следует, что остаточные газы в вакууме оказывают существенное влияние на величины изменения изобарно-изотермического потенциала реакций. В наибольшей степени это сказывается на меди — в чисто кислородной атмосфере с низким остаточным давлением точка равновесия находится при температуре 970 К, а в случае масляного вакуума с таким же остаточным давлением кислорода эта атмосфера является восстановительной даже при температуре жидкого гелия; однако скорости восстановления окисла при низких температурах будут чрезвычайно низки. Этим противоречием термодинамики и кинетики [611 обусловлено, очевидно, и такое явление: в соответствии с термодинамическими расчетами точка равновесия для системы Ni—02—О Ni находится при температуре 880 К, но в работе [581 методом дифракции на медленных электронах показано существование комплекса хемосорбции на никеле даже при предплавильных температурах.
Следует подчеркнуть, что при вакуумном нагреве металлов и сплавов получение чистых поверхностей невозможно, так как даже в случае восстановления окислов и кислородных комплексов хемосорбции будет происходить хемосорбция соединений углерода с кислородом и углеводородов, но прочность связи в этом случае будет существенно ниже [57 1. Рассмотренные выше термодинамические закономерности относятся к случаю вакуумного нагрева металлов. При образовании физического контакта между соединяемыми материалами в результате пластической деформации прикон - тактных областей происходит сближение поверхностей до расстояния, равного нескольким ангстремам.
Поскольку скорости газообразных молекул близки к скорости звука и существенно выше скорости сближения соединяемых поверхностей, то в образовавшихся микрообъемах давление остаточных газов близко к давлению в технологическом объеме. Однако температура газов в этом случае в отличие от случая вакуумного нагрева равна температуре материалов. С учетом этого обстоятельства вычислили изменение изобарно-изотермического потен-
циала реакций для состояния физического контакта (рис. 7, прямые 2, 4, 6). Приведенные зависимости свидетельствуют о том, что когда соединяемые материалы находятся в состоянии физического контакта, происходит сдвиг реакций восстановления в сторону более низких температур.
Химическое взаимодействие (образование межатомных связей) между металлами при сварке давлением с подогревом может быть описано в общем виде следующим уравнением:
пОМе'т 4' гпОМе’п = тп (Me — Me") +
(m4" п) 10]мс' 4~ іО]ме") - (32)
В данном уравнении реакции распределение кислорода между двумя металлами после разрыва связей в комплексах хемосорбции определяется соотношением его коэффициентов диффузии D' и D" в металлах Me' и Me".
По закону Гесса изменение изобарно-изотермического потенциала для этой реакции может быть определено из следующего выражения:
AG — АЄме’- ме" 4~ AG[o] , 4~ AG[oj,, „ — AGo Me’ — AG0 мЄ" ■ (33)
Me Me
В этом выражении значение АЄме'-ме" для случая соединения одноименных металлов равно по абсолютной величине изменению изобарно-изотермического потенциала испарения металла. Для случая соединения разнородных металлов можно записать 1
Расчет изменения изобарно-изотермического потенциала при растворении кислорода в металле производится по уравнению [56]:
|
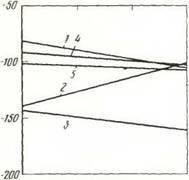
Рис. 8. Диаграмма Д(7у — Т системы О Me' — ОМе" для случая образования межатомных связей между металлами: / — Си + Си; 2 — Ni + Ni; 3 — Mo + + Mo; 4 — Си - j - Ni; 5 — Cu + Mo |
О 500 юоо г, л AG = А 4- ВТ + RT In N0,
(35)
где No — атомная доля кислорода в растворе.
В расчете принято, что при растворении в металле того незначительного количества кислорода, которое содержится в двухмерном комплексе хемосорбции, содержание кислорода в металлической матрице не изменяется.
•Долгов Ю. С. Исследование взаимодействия припоя с основным металлом в процессе пайки. Автореф. канд. дис. М., 1970.
Значения изменения изобарно-изотермического потенциала образования комплекса хемосорбции Авоме взяты из графиков на рис. 7.
Результаты расчетов, приведенные на рис. 8, свидетельствуют о том, что образование металлических связей при взаимодействии металлических поверхностей, покрытых химически адсорбированным кислородом, таких пар металлов, как Си + Си, Ni + Ni, Mo + Мо, Си + N і и Си -|- Мо, термодинамически разрешено даже при температуре жидкого гелия.
Выполненный термодинамический анализ взаимодействия различных окислов и других неметаллических материалов с металлами, а также металлов в одноименном и разноименном сочетаниях, естественно, не претендует на исчерпывающее рассмотрение всех термодинамических аспектов соединения в твердом состоянии. Он лишь показывает пути решения задач, возникающих при необходимости соединения различных сочетаний материалов, а также подчеркивает многообразие и специфику возможных задач.
Полезность и необходимость термодинамического анализа при соединении материалов в твердом состоянии определяется тем, что он позволяет ответить на вопрос о термодинамической разрешенное™ процесса (или спектра процессов), теоретически рассчитать возможность образования новых фаз непосредственно при сварке или при дальнейшей эксплуатации сварного соединения в различных температурно-временных условиях, а также подойти к решению проблемы выбора материалов для конструкций, работающих в космических условиях, когда схватывание материалов может быть нежелательно.