СИЛИКАГЕЛЬ, Его получение, свойства и применение
Старение в минеральных кислотах
Как указывалось, факторы, ускоряющие застудневание золя кремневой кислоты, действуют в том же направлении при старении гидрогеля. Известно [72], что застудневание золя кремневой кислоты ускоряется ионами Н+ и ОН-, причем ниже рН 2 скорость процесса пропорциональна концентрации гидроксильных ионов. При рН < 2 застудневание ускоряется также небольшими количествами иона фтора [152, 153]. Учитывая близость кристалло-
Химических свойств ионов ОН" и F-, авторы [152, 1531 высказали предположение о сходном механизме их каталитического действия. Мы предполагали, что сходство во влиянии этих ионов на скорость застудневания распространится и на скорость старения гидрогеля и соответственно
|
Таблица 10 Структурные характеристики силикагелей, полученных при старении гидрогеля в HF и НС1 (время обработки 24 н)
|
|
• неї. |
Отразится на изменении пористой структуры. Полученные результаты [141] находятся в полном согласии с нашими ожиданиями.
Так, зависимость структуры силикагеля от концентрации раствора фтористоводородной кислоты (табл. 10, рис. 14) сходна с закономерностью, полученной ранее [46, 117, 119—121] при изменении среды гелеобразования в области рН 2—9. Повышение концентрации кислоты, как и увеличение рН раствора, уменьшает удельную поверхность и увеличивает объем пор. Такую закономерность можно было связать с уменьшением рН среды старения, основываясь на известном факте увеличения объема пор с понижением рН гелеобразования в области значений от 2 до —1 [120]. Однако сравнение структурных характеристик силикагелей, полученных из гидрогеля под воздействием НС1 и HF, позволяет заключить, что влияние HF на структуру связано не столько с концентрацией ионов водорода, сколько со специфическими особенностями иона фтора или молекул HF.
|
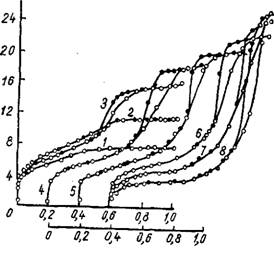
Рис. 14. Изотермы адсорбции паров метилового спирта на силикагелях, полученных обработкой «кислого» геля (/) растворами фтористоводородной кислоты различных концентраций. Номера кривых 2, 3, 4, 5, 6, 7, 8 Отвечают концентрациям 0,017, 0,06, 0,14, 0,26, 0,46, 0,88, 1,3 г. же! л соответственно. |
|
<----- 1------ 1------ 1__ _L___j О 0,2 0,6 0,8 1,0 О 0,2 ОЛ 0,6 0,8 P/Ps |
|
Отвечает значительно меньший объем пор силикагеля. Аналогия в действии HF и ОН- обнаруживается также для зависимости пористой структуры от длительности старения гидрогеля в растворах фтористоводородной кислоты (табл. 11). Как и в случае гидроксильного иона, с увеличением длительности старения гидрогеля в растворах фтористоводородной кислоты объем и радиус пор силикагелей возрастают. При этом вначале с ростом Vs примерно от 0,5 до0,7сж3/г удельная поверхность изменяется мало, а затем заметно уменьшается. При старении геля замечается предел |
Действительно, при одинаковом значении рН раствора названных кислот равном двум (0,1-н HF и 0,01-н НС1) (табл. 10) пропитка геля фтористоводородной кислотой приводит к образованию ксерогеля с объемом пор, превышающим в 2,7 раза объем пор образца, полученного пропиткой НС1. Такое же несоответствие структуры со значением рН растворов наблюдается при сравнении образцов 3 и 5, когда более низкому рН раствора соляной кислоты
В изменении величины предельно-сорбционного объема пор, близкий к 1,0—1,1 см[6]1г. Этот предел достигается тем быстрее, чем выше концентрация фтористоводородной кислоты.
В описанных опытах воздействию HF подвергали гидрогель, осаждеииый и отмытый от солей в кислой среде
|
Таблица 11 Старение «кислого» геля в HF
|
(«кислый» гель). В табл. 12 и на рис. 15 приведены результаты аналогичного исследования с тем же гидрогелем, ио отмытым от солей водопроводной водой с рН 6,4 («нейтральный» гель). Как и в предыдущих случаях, образцы
|
Таблица 12 Старение «нейтрального» геля в HF (время обработки 24 н)
|
|
* неї. |
Перед сушкой отмывали от фтористоводородной кислоты. Из таблицы 12 видно, что пропитка «нейтрального геля» (образец 7*) 0,01 и 0,1-и растворами фтористоводородной кислоты приводит к увеличению поверхности силикагеля, приближая ее к удельной поверхности образца, полуЦепного из «нейтрального» геля после обработки его 0,01-и. раствором соляиой кислоты (образец 6). Следовательно, фтористоводородная кислота при малых концентрациях раствора, подобно соляиой, препятствует росту первичных частиц. Это хорошо согласуется с фактом иезначитель-
|
|
|
А, ммоль/г |
|
І |
|
/ |
О 0,2 OA 0,6 0,8 1,0
TOC o "1-3" h z ' •_______ J____ і__ і—
'■■ '________ Li_______ 'J_____ 'J_______ і
0 0,2 OA 0,6 0,8 1.0
£___ і___ U.___ I___ Tl____ і
0 0,2 OA 0,6 0,8 P/Ps
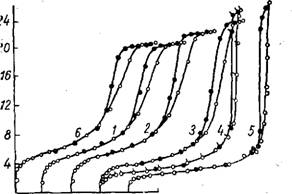
Рис. 15. Изотермы адсорбции паров метилового спирта на силикагелях, полученных обработкой нейтрального геля растворами фтористоводородной кислоты различных концентраций, номера кривых соответствуют номерам образцов табл. 12.
Ного изменения удельной поверхности при пропитке «кислого» геля теми же растворами фтористоводородной кислоты (см. табл. 10).
Дальнейшие превращения в структуре, вызванные увеличением концентрации HF и длительности старения в ней гидрогеля, дают картину, аналогичную полученной в тех же условиях с кислым гелем.
Отмеченная аналогия во влиянии концентрации ионов ОН- и F~ (в кислой среде) на пористую структуру силикагеля согласуется с экстремальной зависимостью изменения скорости поликоидеисации и растворимости кремнезема с минимумом при рН 2 [143].
При низком рН растворимость повышается в присутствии ионов фтора [144][7], она также увеличивается с возрастанием концентрации фтористоводородной кислоты. Поэтому мы склонны считать, что в растворах фтористоводородной кислоты имеет место явление переконденсации кремневой кислоты, обусловленное растворимостью дисперсной фазы в дисперсионной среде. Старение гидрогеля,
VSlCM3/e $,мг/г
|
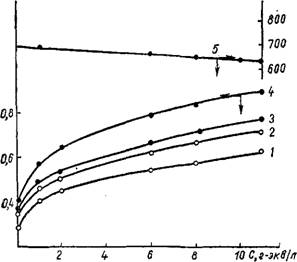
Рис. 16. Кривые зависимости предельно-сорбированного объема пор силикагеля от концентрации H2S04 и длительности старения в ней гидрогеля: 1, 2,3,4 — продолжительность старения 17, 46, 86, 198 суток соответственно; 5 — изменение удельной поверхности. |
По-видимому, может ускоряться не только вследствие повышения растворимости кремнезема, а и ускорения химической реакции между растворимой низкомолекулярной и коллоидной кремневой кислотой подобно тому, как с каталитическим действием ОН-" и F - связывают [144, 152, 153] ускорение желатинизации золя. Нельзя также исключить некоторого влияния на пористую структуру частич - ного уноса кремневой кислоты из геля при воздействии на него HF и последующей ее отмывке.
Подобным образом изменяются параметры пористой структуры силикагеля при старении гидрогеля в растворах соляной, азотной, серной и фосфорной кислот [154]. Как установили Шейнфайн, Стась и Маковская [154], повышение концентрации кислоты или увеличение продолжительности ее воздействия на гидрогель приводит в возрастанию объема пор ксерогеля, сопровождающегося небольшим
|
|
|
0 0,2 . Flf 0,6 0,8 1,0 P/Ps О -Д? д4 Де о, в І, а О 0,2 0,If 0,6 0,8 1,0 О О,,2 О, Л 0,6 0,6 1,0 О 0,2 ОЛ 0,6 0,8 1,0 П 0,2 ОЛ 0,6 0,8 1,0 Рис. 17. Изотермы адсорбции паров метилового спирта на силикагелях, полученных из гидрогелей, состаренных в течение 198 суток в растворах H2S04 различной концентрации: 1 — 0,01-н.; 2 — 1н.; 3 — 2н.; 4 — 6н.; б — 8н.; 5—11 н. |
|
А, ммоль/г |
|
20 |
|
16 |
|
12 |
Уменьшением удельной поверхности-. Иллюстрацией указанных изменений в структуре служат рис. 16 и 17. При изучении старения гидрогеля в растворах одинаковой нормальности соляной, серной и фосфорной кислот установлено, что по ускоряющему влиянию на процесс старения гидрогеля названные кислоты располагаются в ряд: НС1 > H2S04 > Н3Р04. Факт замедленного старения гидрогеля в сернокислых и фосфорнокислых растворах авторами [1541 объяснен меньшей активностью иона водорода в них, по сравнению с солянокислыми растворами одинаковой нормальности. Этот вывод подтвержден получением идентичных пористых структур из гидрогелей, подвергшихся воздействию разных минеральных кислот с одинаковой кислотностью среды, характеризуемой функцией кислотности Гаммета [155]. Следовательно, при старении гидрогеля в растворах соляной, азотной, серной и фосфорной кислот решающую роль играет кислотность среды, а не природа аниона.
Стожность явлений, происходящих в геле при старении в «агрессивных» средах, не позволяет однозначно интерпретировать экспериментальные данные на основе одних лишь адсорбционных характеристик. Следует иметь в виду результаты работы [156], в которой показано, что способ расчета размера частиц гидрогеля из адсорбционных данных не всегда является надежным. Необходимо также знать условия, при которых преимущественно реализуется тот или иной процесс (поликонденсация, растворение, растворение — переосаждение).