СИЛИКАГЕЛЬ, Его получение, свойства и применение
Силикагели из силиката натрия и легко Гидролизующихся солей
При взаимодействии растворов силиката натрия и легко гидролизующихся солей происходит мгновенное выпадение хлопьевидного осадка — коагеля кремневой кислоты и нерастворимого гидрата окиси металла. Осадок отфильтровывают, подсушивают до определенного содержания влаги, удаляют из него гидрат окиси металла кипячением в кислоте, отмывают от солей и сушат. Полученные таким путем ксерогели кремневой кислоты, в отличие от рассмотренных ранее стекловидных силикагелей, непрозрачны. Их принято называть меловидными. В процессе осаждения меловидного силикагеля, в связи с непрерывным изменением рН смеси, образующийся гель неоднороден как по составу, так и по дисперсности, что, несомненно, должно отразиться на конечной пористой структуре ксеро - геля.
Меловидные силикагели исследовались Холмсом [31, 32, 210, 211], Григорьевым [212], Боресковым, Киселевым и их сотрудниками [47]. В этих работах показано, что меловидные силикагели характеризуются весьма размытым распределением пор по их радиусам. Наряду с тонкими порами они содержат переходные и макропоры самых различных размеров. Вопросы регулировки пористости в указанных исследованиях не затрагиваются.
Способ получения меловидных силикагелей создает условия для образования агрегатов самых различных размеров, что обусловливает формирование в них пор различной величины, от весьма тонких до макропор. Об этом свидетельствуют электронномикроскопические исследо-
|
Таблица 28 Структурная характеристика меловидных силикагелей
|
Вания Радушкевича и Лукьяновича [213], согласно которым размеры частиц меловидного силикагеля колеблются от 500 до 1000 А. Сцепления отдельных частиц образуют пористую структуру, причем пустоты играют роль пространственного расположения пор, диаметры которых лежат в пределах 100—600 А.
Неймарк и Слинякова [214, 215] изучили влияние рН среды осаждения на пористую структуру меловидных силикагелей.
При использовании в качестве коагулятора раствора хлористого железа (табл. 28) увеличение рН суспензии приводит к возрастанию объема всех указанных в таблице разновидностей пэр.
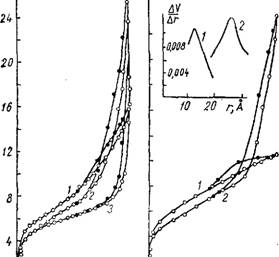
Сравнивая между собой изотермы сорбции на образцах, осажденных в кислой среде (кривая 1 на рис. 27) и в щелочной (кривая 2 и 3 на рис. 27), можно заметить значительное различие в характере их пористости. В первом
случае петля гистерезиса невелика, что указывает на небольшой объем переходных пор. Кривая 1 при малых и средних относительных давлениях расположена выше кривых 2 и 3. Образцы, осажденные в щелочной среде, обладают более крупнопористой структурой. На изотермах
|
Рис. 27. Изотермы сорбции паров метилового спирта на меловидных силикагелях, осажденных FeCl3 с различными рН суспензий. Вверху кривые распределения объема пор по эффективным радиусам: А) 1 — рН 0,43; 2 — рН 8,2; 3 — рН 10,9; б) 1 — рН 0,44; 2 — рН 10,9. 0,8 0 |
|
О |
|
0,k 0,6 pjps |
|
А |
Наблюдается узкая петля гистерезиса. Предельно-сорб - ционный объем пор этих силикагелей при Plps = 1 велик.
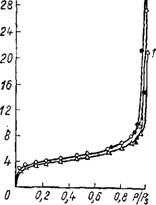
Влияние рН среды на пористую структуру меловидных силикагелей, полученных из силиката натрия и хлористого никеля, наглядно иллюстрирует рис. 28. Как и в предыдущем случае, при переходе от кислой среды осаждения к щелочной кривая изотермы сорбции располагается зничительно ниже. С увеличением рН суспензии от 0,5 до
10,5 суммарный объем пор возрастает от 0,23 до 0,88 см31г, А отношение предельно-сорбционного объема пор к объему макропор уменьшается от 7,4 до 1,4.
Изменять структуру меловидных силикагелей можно также добавкой гидрофилизаторов к реагирующим вещест-
|
А 5 Рис. 28. Изотермы сорбции паров метилового спирта на меловидных силикагелях, осажденных NiCla с различными рН суспензий: А) 1 — 0,5; 2 — 10,5; б) 1 — 0,6; 2 — 11,2. |
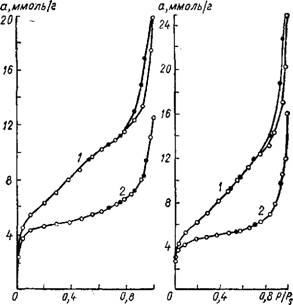
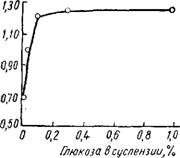
Вам в процессе осаждения. В качестве гидрофилизирую - щего вещества в работе [2141 была применена глюкоза. Как следует из данных, представленных в таблице 29 и 30, присутствие в суспензии незначительных количеств глюкозы вызывает резкое повышение адсорбционной емкости силикагелей. Так, если меловидный силикагель (исходный образец контрольный), полученный без добавки глюкозы, имел адсорбционную емкость 0,69 см3/г, то добавка 0,1% глюкозы увеличила ее почти вдвое (1,23 см3!г). Объем макро - пор при этом уменьшился с 0,83 до 0,21 см31г. Дальнейшее
Таблица 29
|
Изменение пористой структуры меловидных силикагелей под действием глюкозы
|
Возрастание содержания глюкозы в суспензии практически не отражается на адсорбционной емкости силикагеля.
|
Рис. 29. Изменение адсорбционной активности меловидного силикагеля в зависимости от количества добавляемой глюкозы в процессе осаждения. |
В работе [214] подробно было изучено влияние концентрации и природы кисло - ' а, ммоль[ъ Ты, применяемой для удаления 32 Г
|
Рис. 30. Изотермы сорбции паров метилового спирта на силикагелях, полученных без добавки глюкозы (/) и с добавкой 0,1% глюкозы (2). |
Гидроокисей металлов. Установлено, что природа кислоты не влияет на структуру конечного продукта.
Химизм образования меловидных силикагелей, полу
чаемых из жидкого стекла и легко гидролизующейся соли, До сих пор остается неясным. Холмс [31] предположил, что образование кремневой кислоты является следствием двух последовательно протекающих реакций по схеме
МеС12 + 2НгО = Me (ОН)2 | - f 2НС1
Na2Si03 + 2НС1 = H2Si03 ф - f 2NaCl
MeCl2 +NaaSi03 + 2HjO = Me (OH)2 I, + H4Si03 ф - f 2NaCl
Патрик [291, однако, показал, что при добавлении к силикату натрия соляной кислоты в количестве, равном количеству выделившейся кислоты в результате гидролиза соли, осадок не выпадает. Следовательно, схема Холмса, по-видимому, не соответствует действительности. Однако трудно представить, чтобы в осадке в щелочной среде гидрат окиси металла и кремневая кислота находились бы в несвязанном состоянии. Вероятней всего, они должны образовывать химическое соединение.
Для проверки этого предположения в работах [214, 215] была приготовлена гидроокись железа при действии аммиака на раствор FeCl3 и для сравнения осажден меловидный гель путем смешения растворов силиката натрия и FeCl3. Чтобы установить, присутствует ли в этом осадке Fe (ОН)3 в чистом виде или она химически связана с H2Si03, проверена растворимость в кислотах чистой Fe (ОН)3 и образованного осадка меловидного геля. Обнаружено, что свежая Fe (ОН)3 хорошо растворялась в 6-н. соляной И В-н. уксусной кислотах и плохо — в 4-н. уксусной кислоте. Железо осадка, выпавшего при смешении растворов FeCl3 и Na2Si03, растворялось в 6-н. НС1 и совершенно не растворялось в 6-Н. уксусной кислоте. По-видимому, кроме Fe (ОН)з в чистом виде железо осадка связано с кремневой кислотой. После обработки такого осадка 6-н. НС1 это соединение разрушается и в осадке остается только гель кремневой кислоты.
Рэй и Генгули [216] измеряли количество тепла, выделяющегося при полной реакции одной граммолекулы FeCl3 с растворами разной концентрации силикатов щелочных металлов; они обнаружили, что при возрастании содержания Na20 в растворах количество тепла, выделяющегося на граммолекулу FeCl2, заметно падает. Этот факт может свидетельствовать об образовании ионов при возрастании содержания в растворе кремнезема.
Более правильно подошел к объяснению химизма получения меловидных силикагелей (Григорьев [2121; он предположил, что реакция идет по схеме
МеС12 + Na2Si03=2NaCl + МеО • п SiO„.
Неймарк и Слинякова [215] дополнили эту схему, вводя в состав комплексов окись натрия.
|
А, ммоль/г 5" |
|
0,2 0,k 0,6 Ofi P/Ps |
|
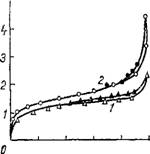
Рис. 32. Изотермы адсорбции паров метилового спирта на силикагелях: контрольном (1) и пропитанном золем кремневой кислоты (2). |
Ставя перед собой задачу увеличить объем мелких пор в меловидном силикагеле, авторы [214] осаждали в макропо-
|
12 3^5 Число пропиток |
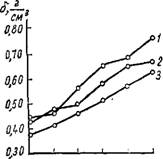
Рис. 31. Изменение кажущегося удельного веса меловидных силикагелей разной пористой структуры от числа их пропиток золем кремневой кислоты. Силикагель с объемом макропор, См3 /г: >t
/ — 1,50; 2 — 1,46; 3 — 1,21.
Рах последнего стекловидный силикагель. Для этого меловид - ные силикагели предварительно сушили при температуре 200° Си заливали свежеприготовленным золем в течение 3 ч, после чего золь сливали, силикагель ополаскивали водой и оставляли на одни сутки при комнатной температуре для созревания. Затем гель промывали от солей и сушили. По мере увеличения числа пропиток меловидного силикагеля золем кремневой кислоты кажущийся удельный вес увеличивается (рис. 31). Изотермы сорбции на пропитанных силикагелях лежат выше, чем на исходном (рис. 32). Следовательно, стекловидный силикагель, осаждаясь в макропорах меловидного, увеличивает объем мелких пор.
Таким образом, влияя на степень гидрофильности частиц кремниевой кислоты путем изменения реакции среды при
осаждении геля, применения специальных гидрофилизу - ющих добавок, можно изменять пористую структуру и,, следовательно, сорбционные свойства меловидных силикагелей.