СИЛИКАГЕЛЬ, Его получение, свойства и применение
РОЛЬ ЭЛЕКТРОЛИТОВ В ФОРМИРОВАНИИ ПОРИСТОЙ СТРУКТУРЫ СИЛИКАГЕЛЕЙ
Одним из существенных факторов, как указывалось выше, влияющих на пористую структуру силикагеля, является отмеченное многими исследователями [33—36, 38, 39, 46, 47, 104] действие на гидрогель электролитов. Результаты, полученные при промывке и пропитке гидрогеля электролитами, объясняются различными причинами (пептизация, дегидратация и др.). При этом игнорируются специфические особенности их действия. На основании литературных данных, часто несопоставимых (разные условия получения гидрогелей и обработки их электролитами, а также сушки), не представлялось возможным сделать заключение о природе эффектов, производимых электролитами при промывке и пропитке ими гидрогеля. Это обусловило необходимость специальной постановки работ по изучению роли электролитов в формировании пористой структуры силикагелей.
Нами было установлено [105], что промывка геля, осажденного в кислой среде, подкисленной водой (рН 3,5—5,5) приводит к образованию однородно тонко-
|
Таблица 1 Зависимость структуры силикагеля от характера промывной жидкости
|
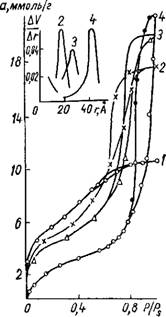
Пористых силикагелей с большой удельной поверхностью. При промывке геля водопроводной водой получены сравнительно крупнопористые силикагели с большой адсорбционной емкостью и значительно меньшей удельной поверхностью (табл. 1). Из изотерм, приведенных на рис. 3, видно, что для образца, промытого подкисленной водой,
Характерен крутой подъем кривой в области низких относительных давлений и отсутствие гистерезисной петли. Это позволило сделать вывод, что поры данного адсорбента однородны по размерам, очень тонки и заполняются в первичном адсорбционном процессе.
В случае образца, промытого водопроводной водой, изотерма обнаруживает гистерезис, свидетельствующий о капиллярной конденсации адсорбата в порах переходных размеров.
|
А^моль/г JV см Іґ'гА |
|
Рис. 3. Изотермы сорбции паров метилового спирта на силикаге - лях 200 (1) и 207 (2). Вверху кривая распределения объема пор силикагеля 207 по радиусам. Черные точки здесь и далее — десорбция. |
|
ОЛ |
|
Т |
Полученные результаты мы объяснили, пользуясь известными представлениями о корпускулярном строении коллоидной кремнекислоты и ее химических свойствах. При этом также учитывались свойства кремнегеля как ка- пиллярно-пористого тел а, формирование которого в процессе сушки в значительной степени определяется прочностью скелета [43]. Прочность каркаса геля, в свою очередь, связывали с влиянием электролитов на процесс агрегирования частиц геля. В соответствии с этим формирование мелкопористой структуры силикагеля из гидрогеля, промытого подкисленной водой, мы объясняли большей эластичностью его скелета, легко деформирующегося в процессе сушки; эффект водопроводной воды относили за счет увеличения жесткости каркаса геля вследствие
образования на поверхности его мицелл гидрофобных участков, способствующих ускорению слипания первичных частиц.
Мы предположили, что частичная гидрофобизация частиц связана с наличием на их поверхности нерастворимого силиката кальция, нарушающего связь между водой, окружающей мицеллу, и водой, проникающей в мицеллу [106]. В дальнейшем было установлено, что в наших
|
Таблица 2 Влияние условий промывки гидрогеля на структуру силикагеля
|
Условиях опыта при промывке геля водопроводной водой (рН 7,5) кремневая кислота вовлекается и в реакцию ионного обмена с катионами промывной жидкости (106— 110). При промывке гидрогеля подкисленной (рН 3,5) или дистиллированной водой (рН ~ 5,5) частицы обладают наибольшей гидрофильностью [107—109], так как в этих условиях подавляется диссоциация кремневой кислоты и емкость ионного обмена невелика. Усиление связи с водой затрудняет взаимное сближение частиц и дальнейшую их агрегацию, что обусловливает эластичность скелета геля и образование при сушке мелкопористого силикагеля.
Для проверки этого предположения провели опыты по промывке гидрогеля дистиллированной водой с различным содержанием ионов Са2+, вводимых в виде хлористого кальция и бикарбоната. Полученные данные (табл. 2) указывают на отсутствие различий в структуре (одинаковые объемы пор) силикагелей, образованных при промывке геля чистой дистиллированной водой и с добавками
СаС13. В то же время промывка геля дистиллированной водой с растворенным в ней бикарбонатом кальция (в количестве, соответствующем его содержанию в водопроводной воде) приводит к такому же изменению в пористой структуре, как и водопроводная вода.
Высоцкий и Шаля (111) высказали предположение, что влияние адсорбированных катионов металлов промывной жидкости на пористую структуру силикагеля не ограничивается облегчением агрегации мицелл и укреплением скелета гидрогеля. Адсорбция катионов влечет за собой, по мнению этих авторов, уменьшение стягивающего действия капиллярных сил, зависящих не только от поверхностного натяжения интермицеллярной жидкости, но также и от интенсивности смачивания ею мицелл. Свое заключение они основывают на обнаруженной ими связи между структурой силикагеля и теплотами гидратации катионов: чем меньше теплота гидратации в ряду исследованных ими катионов Н+ > Са2+ > Na+ > К+, тем более крупнопористым получается силикагель, тем меньше его поверхность.
В [112] приводятся результаты исследования ксероге - лей поликремневой кислоты, приготовленных из различных ионообменных форм гидрогелей. Авторы [112] полагают, что при обработке гидрогеля гидроокисью кальция ионы Са2+ занимают, наряду с другими, и «мостиковые» положения, в которых ионы Са2+ связывают две различные частицы в глобуле. При замещении иона Са2+ на иной ион могут наблюдаться различные явления в зависимости от соотношения ионных радиусов Са2+ и замещающего иона Ме"+.
Комаров и Дубницкая [113], изучая влияние катионов промывной жидкости на пористую структуру гидроокиси алюминия и алюмосиликагеля, пришли к заключению, что структура в значительной степени зависит от гидрат- ного объема иона. При этом они рассматривали структурные изменения в связи с влиянием гидратации иона на агрегативную устойчивость геля и его структурно-механические свойства. Уменьшение гидратации ионов, по мнению авторов, увеличение их поляризуемости, т. е. условия, приводящие к сжатию двойного электрического слоя, Уменьшают агрегативную устойчивость геля и упрочняют его пространственную структуру. С увеличением прочности скелета геля уменьшается деформация его при сушке и образуется все более крупнопористый адсорбент.
По мнению Гольдербитера [114], адсорбированные катионы приводят к образованию более крупнопористой структуры благодаря тому, что в этом случае становится, невозможным процесс конденсации кремневой кислоты по схеме
I 1 I I
—Si—ОН + HO—Si— Н20 + — Si—О—Si—
I! I I
Такое объяснение не нашло экспериментального подтверждения и было подвергнуто справедливой критике В работе [111].
Изучение взаимодействия между коллоидной кремне - кислотой и солями кальция показало, что эта реакция
|
Таблица 3 Изменение структуры силикагеля при промывке гидрогеля водами с радиоактивным кальцием
|
Носит характер обратимого ионного обмена [115]. Такая точка зрения еще ранее была выдвинута Гольдербитером, экспериментально установившим наличие ионного обмена на поверхности гидрогеля при обработке последнего растворами солей. Обменным характером адсорбции им также была объяснена обратимость структуры силикагеля. Оба положения, основанные на косвенных экспериментальных данных, доказаны с помощью прямого радиометрического метода в работе Янковской, Пионтковской и Неймарка [116]. Последние показали (табл. 3), что при промывке геля водопроводной водой с рН > 7, в которой имеются ионы радиоактивного кальция, образуется крупнопористый силикагель. При промывке гидрогеля дистиллированной водой, в которой растворен Са45 С12, силикагель имеет незначительную радиоактивность вследствие того, что ионы Са45 в данной среде слабо обмениваются с ионами водорода. Полученный в таких условиях силикагель оказался тонкопористым и по своей структуре мало отличался от силикагеля, промытого чистой дистиллированной
|
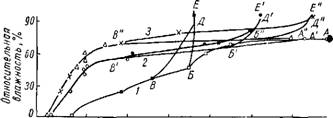
Рис. 4. Тензиметрические кривые оводнения и обезвоживания геля, промытого: Г"Г Г 0,6 1,0 /,4 1,8 2,г Нг0/Si0г, тль |
/ — подкисленной водой рН 2,5; 2 — водопроводной водой рН 7,8; 3 — аммиачным раствором рН 8,6.
Водой. Удаление ионов Са45 из геля, промытого водопроводной водой, путем обработки его кислотой воспроизводит тонкопористую структуру силикагеля.
Для проверки предполагаемого влияния рН промывной воды на степень эластичности скелета гидрогеля Неймарк и Слинякова [117] применили тензиметрический метод оводнения и обезвоживания гидрогелей. Известно, что такой критерий степени деформируемости гелей был принят Ван-Беммеленом [26, 27]. Авторы обнаружили смещение «точки поворота» с уменьшением рН промывной воды в сторону меньших значений влажности (рис. 4)[2]. Из рисунка следует, что при одинаковой влажности воздуха содержание воды в гидрогеле, промытом кислой водой, гораздо больше, чем в геле, промытом водопроводной водой и аммиачным раствором. Таким образом, эти данные
подтверждаютранее высказанное предположение 11053 о различиях в степени гидрофильности кремнегелей, промытых водами с различным рН.
|
33 |
Систематическое исследование влияния рН промывной жидкости на пористую структуру силикагеля было проведено Неймарком и Слиняковой [117]. Изменяя рН среды осаждения гидрогеля и промывной жидкости, они устаноВили ряд закономерностей, значительно расширившиХ;возмож - ности регулировки пористой структуры силикагелей. Ими было показано, что промывка кислых гелей * водами с рН от 1,8 до 4,5—5 приводит к образованию тонкопористого силикагеля. По мере дальнейшего увеличения рН промывной жидкости они наблюдали постепенное увеличение объема и радиуса пор.
|
Таблица 4 Влияние рН гидрогеля на пористую структуру силикагеля, полученного Из чистого силиката натрия
|
|
-* Кажущаяся плотность. |
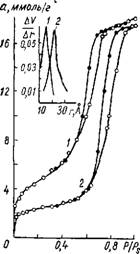
Эти результаты находятся в хорошем согласии с данными Стражеско и Янковской [118], установивших наличие ионного обмена на силикагелях при рН ^ 4. Изменением рН промывной жидкости кислого геля от 2 до 10, как показали Неймарк и Слинякова [117], можно постепенно увеличить объем пор от 0,27 до 0,80 смъ! г при одновременном уменьшении удельной поверхности от 700 до 360 м[3]/г. В то же время при промывке нейтрального геля водами с разным рН объем пор изменяется в более узких пределах от 0,52 до 0,79 см[4]1г. Возрастание объема пор силикагеля при промывке гелей водами с рН > 5 авторы связывают с увеличением жесткости каркаса геля вследствие обмена ионов водорода поверхностных гидроксильных групп мицелл кремниевой кислоты на находящиеся в окружающей среде катионы Са2+, Mg2"^, Na+, Fe3+ и др. Закономерное изменение пористой структуры силикагелей с повышением рН гидрогеля иллюстрируется данными табл. 4
и рис. 5. Увеличение объема пор с ростом рН гидрогеля сопровождается уменьшением удельной поверхности и увеличением радиуса пор. Аналогичные данные об изменении пористой структуры силикагеля с увеличением рН среды осажденного гидрогеля были получены в [46, 119, 120, 121].
|
Рис. 5. Изотермы сорбции паров метилового спирта на силика - гелях, Промытых ЖИДКОСТЯМИ с различным рН (1 — 2,9; 2 — 5,6; 3 — 6,8; 4 — 9,3). Вверху кривые распределения объема пор по радиусам. |
При осаждении геля кремниевой кислоты в условиях избытка силиката натрия получаются так называемые «щелочные» силикагели. Получение и свойства этих гелей изучались в работах [34, 39, 46]. В [34] было установлено, что гели, осажденные в щелочной среде, обладают крупнопористой структурой. Марков и Нагорная [39] заметили, что промывка щелочных гелей подкисленной водой приводит к увеличению количества мелких пор. Цитированные авторы основывали свои выводы на изучении статической активности, которая, как известно, не может характеризовать полностью пористую структуру.
Применив современные методы исследования пористой структуры адсорбентов, Сли-
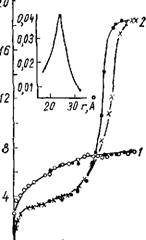
Някова и Неймарк[122] установили, что промывка щелочного геля подкисленной водой, в отличие от щелочной, формирует силикагель с высокоразвитой удельной поверхностью. Как видно из табл. 5 и рис. 6, полученные образцы обладают близкими величинами объемов пор, но разным характером распределения их по величинам эффективных радиусов. Изотермы адсорбции паров метилового спирта на силикагелях, полученных из гелей, промытых подкисленной водой, расположены выше в области низких относительных давлений адсор-
|
Таблица 5 Характеристика структуры силикагелей, получаемых из щелочных сред
|
Бага, что свидетельствует о наличии в этих образцах более тонких пор. Об этом также говорит сдвиг резкого подъема изотермы в области капиллярной конденсации паров в сторону меньших значений P/Ps. Соответственно кислая промывная вода, по сравнению со щелочной, приводит к образованию силикагеля со значительно большим объемом адсорбционного пространства (VB).
Увеличение удельной поверхности силикагелей при переходе от щелочной к кислой промывной воде авторы объясняют доосаж - дением в порах кремниевой кислоты, образуемой при взаимодействии остающегося в межми - целлярном пространстве силиката натрия с кислотой промывной жидкости.
При промывке щелочного гидрогеля подщелоченной ВОДОЙ Рис. 6. Изотермы сорбции па - образуются крупнопористые СИ - ров метилового спирта на ще - ликагели вследствие агрегации лочных силикагелях, промы-
Мицелл в частицы большего ^^То^Т-^ІГіГ™ размера и упрочнения скелета 1у распр'е^ения
|
|
|
3* |
|
35 |
Гидрогеля. Справедливость объема пор по радиусам.
Представлений о связи между степенью агрегирования частиц геля, зависящей от рН среды гелеобразования и промывной жидкости, и структурой ксерогеля доказана с помощью электронномикроскопического исследования [91].
В целом материалы этого раздела свидетельствуют о том, что пористая структура силикагеля зависит от рН промывной жидкости и рН осаждения гидрогеля. Варьируя эти условия, можно получать однородно тонкопористые силикагели, адсорбенты смешанной структуры, в которых наряду с развитой микропористостью содержатся поры переходных размеров и, наконец, крупнопористые образцы.
В развиваемых ныне взглядах на процесс застудневания золя кремневой кислоты отдается предпочтение химическому фактору. Скорость застудневания золя связывают с каталитическим влиянием ионов гидроксила и водорода на процесс поликонденсации кремневой кислоты [72]. Основываясь на этом положении, Оккерзе и Де-Бур [120] объясняют изменения в структуре силикагеля, вызываемые различиями в рН среды осаждения гидрогеля, разной скоростью поликонденсации кремневой кислоты. При этом в условиях минимальной скорости поликонденсации при рН 2 образуется наиболее тонкопористый силикагель. Изменение рН среды в одну и другую стороны от рН 2 приводит к увеличению объема пор силикагеля.
Накопленный в последние годы экспериментальный материал по влиянию среды старения гидрогеля на пористую структуру силикагеля (см. гл. 5) действительно свидетельствует, что изменение пористой структуры определяется факторами, влияющими на процесс поликонденсации кремневой кислоты. Однако нам представляется, что такой подход не исчерпывает полностью вопроса о влиянии этих факторов на пористую структуру силикагеля. С нашей точки зрения, необходимо учитывать при этом роль коллоидно-химических процессов (агрегация частиц, рост частиц полидисперсной системы вследствие частичной растворимости дисперсной фазы и др.).