СИЛИКАГЕЛЬ, Его получение, свойства и применение
Природа интермицеллярной жидкости
Как указывалось, влияние природы интермицеллярной ; жидкости на сжатие скелета геля кремневой кислоты при его обезвоживании было известно уже давно. В основу исследований в этой области была положена открытая Гремом [21 ] возможность замещения воды гидрогеля спиртом, уксусной кислотой, глицерином, концентрированной серной кислотой и рядом других веществ. Ван-Беммелен [27] получил ацетогель, обрабатывая гидрогель уксусной кислотой. Зигмонди, Бахман и Стевенсон [281 установили, что высушивание алкогеля и бензогеля, полученных вытеснением воды гидрогеля соответственно спиртом и бензолом, приводит к значительно меньшему сжатию геля по сравнению с гидрогелем. Иначе говоря, при замене воды гидрогеля ■ названными органическими растворителями образуется продукт с большим размером капиллярных пустот.
В 1931 г. Кистлер [42] получил силикоаэрогель замещением воды в геле спиртом с последующим удалением жидкости нагревом ее выше критической температуры.
Поляков с сотрудниками [40, 41] выявили возможность регулировки пористой структуры силикагелей обезвоживанием гидрогеля в присутствии различных органических веществ. При этом изменения в структуре они связывали с размером молекул последних (см. гл. II).
Веселовский и Селяев [43] полагали, что на пористую структуру силикагеля влияют поверхностное натяжение интермицеллярной жидкости и прочность скелета геля.
Идея о главенствующей роли поверхностного натяжения интермицеллярной жидкости в формировании пористой % структуры силикагелей в дальнейшем была положена в основу проводимых нами исследований. Убедительными в этом отношении оказались данные, полученные одним из авторов с Хацет [44] о влиянии на структуру силикагеля
Поверхностно-активных веществ, вводимых в гель на стадии желатинизации.
В [184] мы исследовали возможность регулирования пористой структуры силикагелей путем замены воды гидрогеля жидкостями с различным поверхностным натяжением. При этом лиогели получались замещением воды
|
Таблица 19 Поверхностное натяжение интермицеллярной жидкости и пористая структура силикагеля
|
Гидрогеля на органическую жидкость методом кипячения с непрерывным отгоном воды (дисчилляционный метод) или путем многократной декантации. В качестве объекта исследования был выбран гидрогель, осажденный в кислой среде и отмытый от солей водопроводной водой с рН 7. Полученные лиогели сушили при 250° С.
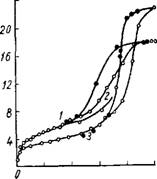
В табл. 19 приведены структурные характеристики силикагелей, полученных заменой воды в гидрогеле на органическую жидкость при помощи ДИСТИЛЛЯЦИОННОГО метода, а на рис. 22 — изотермы адсорбции паров метилового спирта на некоторых из этих образцов. Из данных таблицы видно, что замена воды на органическую жидкость приводит к значительному увеличению общего объема и радиуса пор ксерогеля. При этом также несколько возрастает и удельная поверхность образцов.
Анализируя приведенные в табл. 19 структурные характеристики силикагелей, можно заключить, что полного параллелизма между пористостью силикагеля и поверхностным натяжением (а) дисперсионной среды кремне-
Геля не наблюдается. Так, 93 2 разным величинам а соот - , ветствуют сходные структуры (образцы 2А и 5-Э) или близким значениям их от - . вечают разные структуры (образцы5-Э и 7-И). Не согласуется с ожидаемой закономерностью повышение ' пористости, вызванное уксусным ангидридом. Подобное несоответствие меж - 1 ду объемом пор силикагеля и а интермицеллярной жидкости было отмечено в более ранних и поздних исследованиях других авторов.
Так, при сушке гидрогеля в парах бензола, толуола и ксилола [40]—веществ с близкими значениями а, получаются силикагели, отличающиеся пористой структурой. Имеются О 0,2 ОЛ 0,6 0,8 1,0 данные о незначительном
Рис. 22. Изотермы адсорбции паров влиянии на структуру алю - Метилового спирта на силикагелях: мосиликагеля внесенных В 1—4 образцы В, ж, 6И, 2А соответ - ИНТерМИцеЛЛЯрНуЮ ЖИД-
Ственно' кость малых количеств
|
А, ммоль/г |
|
0.2 0,k 0,6 0,8 P/Ps О 0,2 О,It 0,6 0,8 1,0 О 0,2 0, It 0,6 Ь,8 I,0 |
Поверхностно-активных веществ [185]. В то же время в работе [186] отмечается существенное влияние последних на структуру магний-силикатных катализаторов. Вольф и Байер [164] обнаружили увеличение объема пор силикагеля при замене воды гидрогеля спиртами от метилового к пропиловому, хотя названные вещества обладают одинаковым а (табл. 20). Они пришли к заключению, что пористость силикагеля возрастает с увеличением размера молекул интермицеллярной жидкости. При этом
Уксусная кислота рассматривается ими как ассоциированная жидкость. Эти авторы полагают, что увеличение размера молекул интермицеллярной жидкости оказывает тормозящее влияние на стягивание геля при сушке.
Вместе с тем нет пока оснований сделать обобщение относительно связи структуры силикагеля с размерами молекул интермицеллярной жидкости. Такая связь проявляется в гомологическом ряду спиртов и не оправдывается для веществ других классов органических соединений.
|
Таблица 20 Природа интермицеллярной жидкости и пористая структура силикагеля [164]
|
Совокупность экспериментальных данных ряда работ [43, 44, 186—192], выполненных до и после нашего исследования [184], убеждает в справедливости общих представлений о роли поверхностного натяжения в проявлении капиллярных сил при высыхании дисперсных систем. Однако при этом нельзя не считаться с влиянием на процесс формирования пористой структуры силикагеля особенностей химического строения органических растворителей и с коллоидно-химическими свойствами мицелл кремнекислота. В частности, можно было ожидать известного влияния природы интермицеллярной жидкости на степень агрегирования частиц геля, что неизбежно должно сказаться на пористой структуре. Нельзя, очевидно, пренебрегать возможными различиями в интенсивности взаимодействия дисперсионной среды с дисперсной фазой [193, 150, 185]. Действительно, Высоцкий и др. [166] обнаружили связь между изменением пористости силикагелей, полученных из ряда алкогелей, и теплотами смачивания геля соответствующими спиртами. Результаты данного исследования приведены в табл. 21.
|
Структура силикагелей, полученных из разных алкогелей
|
|
Условный дипольный момент, характеризующий полярность интермицеллнр |
Наряду с теплотами смачивания, непосредственно определяющими эффект сродства, авторы [166] связывают интенсивность взаимодействия с полярностью дисперсионной среды, характеризуемой, в частности, ее условным моментом [194]. В таком случае, как нам казалось, можно было также связать изменения в структуре с истинным дипольным моментом жидкости [195]. Для этого мы заменили воду гидрогеля веществами разных классов органических соединений, их гомологов и изомеров, отличающихся теплотами смачивания силикагеля, величинами дипольных моментов, но обладающих близкими величинами поверхностного натяжения на границе с воздухом.
Так как в литературе еще нет справочника по тепло - там смачивания силикагеля различными веществами, то в некоторых случаях в качестве характеристики интенсивности взаимодействия мы использовали экспериментально найденные ряды адсорбируемости.
В первой серии опытов мы применили жидкости, составляющие элюотропный ряд растворителей [196], для которого порядок адсорбируемости согласуется с теплотами смачивания силикагеля; во второй — вещества, адсорбирующиеся в определенной последовательности на силикагеле из растворов в гептане [103, 197], в третьей—характеристикой интенсивности взаимодействия служила теплота сма - * чивания [166]. Замену воды гидрогеля органической жидкостью проводили путем многократной декантации. Вна-
|
Таблица 21
|
|
Ной жидкости [194]. |
Чале воду вытесняли метиловым спиртом, затем последний заменяли хорошо растворимым в ней органическим веществом. Для введения в гель четыреххлористого углерода и циклогексана применяли бензогель, полученный вытеснением спирта из алкогеля. Лиогели сушили при 120—150° С, а затем прокаливали в течение трех часов при 350° С. В табл. 22 приведены данные, характеризующие зависимость структуры силикагелей от величины дипольных моментов (р) и адсорбируемости жидкостей, заполняющих капиллярные пространства геля.
В каждой серии опытов эти жидкости расположены в порядке уменьшения адсорбируемости на силикагеле. Данные таблицы указывают на отсутствие закономерной связи между объемом пор названного сорбента и дипольным моментом интермицеллярной жидкости. Так, увеличение пористости происходит как при переходе от метанола к ацетону, обладающему большим, по сравнению с первым, дипольным моментом, так и при переходе к неполярным веществам. Нельзя связать с дипольным моментом ощутимые изменения в пористости, вызванные заменой спиртов нормального строения их изомерами.
Для ароматических углеводородов связь между этими характеристиками оказывается в одном случае симбатной (бензол, толуол, о-ксилол), а в другом — антибатной (изомеры ксилола), что также не дает возможности установить однозначную зависимость структуры от дипольного
Момента жидкости. Вместе с тем изменение предельно-сорб - ционного объема пор каждой серии образцов находится в хорошем согласии с рядами адсорбируемости примененных жидкостей на силикагеле. Чем слабее адсорбируется жидкость, т. е. чем меньше интенсивность ее взаимодействия со скелетом геля, тем более пористым получается сорбент. Следовательно, чем меньше сродство интермицеллярной
|
Таблица 22 Структура силикагелей, полученных из разных лиогелей
|
Жидкости к скелету геля, тем меньше величина капиллярного давления, сжимающего гель при сушке, тем более адсорбционноемким получается силикагель. Заметим, что различия в адсорбируемости не сказываются на величине удельной поверхности ксерогеля.
Аналогичная связь между сорбируемостью интермицеллярной жидкости и структурой силикагеля наблюдалась ранее при применении гомологического ряда спиртов от метилового к бутиловому [166]. Продление этого ряда до гептилового спирта подтвердило указанную зависимость. Так, теплота смачивания аэросила спиртами [198], как и адсорбируемость последних на данном сорбенте, убывает с ростом числа углеродных атомов в углеводородной цепочке спирта от одного до пяти, а затем остается практически постоянной. Соответственно этому меняется пористость,
возрастая при переходе от метилового к амиловому спирту, а затем оставаясь почти неизменной с дальнейшим ростом молекулярного. веса спирта.
В то же время условный момент жидкости, принятый в работе [166] в качестве характеристики интенсивности взаимодействия, закономерно возрастающий с увеличением молекулярного веса спирта, не может объяснить предела изменения объема пор.
|
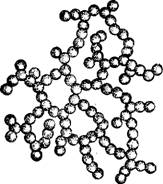
Рис. 23. Схематическое изоб. ражение скелета аэрогеля Ж- |
Таким образом, приведенные нами результаты со всей очевидностью подтверждают необходимость учета при фор ми-
|
|
|
А, ммоль! г 2K |
|
О, г |
|
0,8 Р/Р, |
|
Рис. 24. Изотермы адсорбции паров метилового спирта иа аэрогеле (2) и ксерогелях, полученных из аэрогеля (/) и гидрогеля (3)■ |
Ровании пористои структуры силикагелей интенсивности взаимодействия интермицеллярной жидкости со скелетом геля. При этом ни дипольный момент жидкости, ни условный момент как характеристики полярности не могут быть приняты в качестве количественного критерия интенсивности взаимодействия, хотя это не исключает возможности привлечения их в отдельных случаях для объяснения частных закономерностей.
При замене воды гидрогеля уксусным ангидридом с последующей сушкой при 200° С был получен высокоемкий силикагель с общим объемом пор 4,0 см3/г (образец «Ж») [184]. По своей структуре он относится к классу аэрогелей, которые обычно получают из алко - или эфирогеля при нагревании их в автоклаве выше критической температуры
органической жидкости. Таким образом, нам удалось получить аэрогель безавтоклавным методом.[8]
Согласно электронномикроскопическому исследованию, скелет аэрогеля Ж образован шаровидными частицами (рис. 23), сцепленными между собой в нити, которые переплетаются, образуя рыхлую структуру, наподобие сетчатой, с сохранением значительного объема свободного пространства. По своей структуре аэрогель обнаруживает сходство с
Гидрогелем, отличаясь от последнего газообразной дисперсионной средой [42].Подобно гидрогелю, он обладает эластичным скелетом и, будучи смочен водой, сильно сжимается при ее испарении.
|
Таблица 23 Деформация аэрогеля Ж под действием различных жидкостей
|
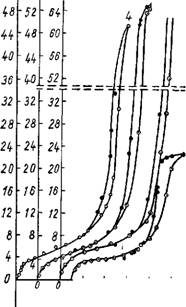
На рис. 24 представлены изотермы адсорбции паров метилового спирта на аэрогеле (адсорбционная ветвь до P/Ps = 0,6) и ксерогелях, один из которых получен высушиванием смоченного водой аэрогеля, другой —обезвоживанием гидрогеля (В). Как видно из сопоставления изотерм, сжатие аэрогеля сопровождается значительным уменьшением объема пор (почти в четыре раза), образуя сравнительно мелкопористую структуру ксерогеля. При этом адсорбционно-десорбционные изотермы в области низких относительных давлений совпадают, указывая тем самым на близкие величины удельной поверхности обоих образцов. Аналогичное явление наблюдалось в работе [200]. Ксерогель, полученный обезвоживанием гидрогеля, отличался от образца Ж-1 несколько большим объемом пор и меньшей удельной поверхностью (440 м2/г). Основываясь на этих данных, мы можем констатировать сходство структуры аэрогеля со структурой первоначально образовавшегося влажного геля.
В связи с этим аэрогель Ж был использован в качестве
модельного образца для выяснения роли капиллярных сил в формировании пористой структурысиликагелей. Втабл. 23 представлены, структурные характеристики силикагелей, полученных из аэрогеля Ж путем пропитки его различными жидкостями с последующим их испарением. Из данных таблицы следует, что наибольшее стягивание скелета аэрогеля и, следовательно, уменьшение объема пор происходят при пропитке его водой, затем эффект ослабевает с уменьшением поверхностного натяжения жидкости. Между
|
Таблица 24 Сжатие аэрогеля под действием водных растворов уксусной кислоты
|
Тем эти результаты можно связать с изменением диэлектрической проницаемости жидкой фазы є [201].
Таким же образом поддаются интерпретации изменения в пористой структуре аэрогеля, вызванные пропиткой его растворами различной концентрации уксусной кислоты. Как видно из табл. 24, с увеличением поверхностного натяжения жидкой фазы или увеличением диэлектрической проницаемости среды суммарный объем пор силикагеля уменьшается. Такая же картина наблюдается для водно - спиртовых растворов.
Как показали дальнейшие исследования [138], все си - ликагели, получаемые из органогелей, обладают такими же свойствами, как образец Ж. Будучи высушены после пропитки водой, они возвращаются к структуре силикагелей, соответствующей исходным гидрогелям.
Мицюк и Высоцкий [202, 203] установили, что лабильный скелет ксерогелей, полученных из алкогелей, претерпевает сжатие в процессе снятия изотерм адсорбции паров метанола, воды и бензола. Авторы пришли к заключению, что сжатие скелета геля происходит при десорбции капиллярно-сконденсированной в порах жидкости. Свои результаты
Они объясняют исходя из предположений, что изученные ими силикагели состоят из неплотноупакованных агрегатов первичных частиц, пронизанных порами. Эти поры доступны для воды, в меньшей степени — для метанола и практически недоступны для молекул бензола, что обусловливает различия в характере изотерм. При последовательном проведении адсорбционных и десорбционных циклов под действием капиллярных сил сжатия агрегаты уплотняются. В результате этого уменьшается удельная поверхность, увеличиваются зазоры между сжимающимися частицами при незначительном уменьшении сорбционного объема пор.
Следует заметить, что сжатие силикагеля с лабильным скелетом при удалении капиллярно-сконденсированной в порах жидкости было ранее установлено нами [184] в опытах по постепенному насыщению образца Ж водяными парами в статических и динамических условиях.
В [165, 168, 204, 205] замечено, что увеличение объема пор силикагеля при замене воды в гидрогеле органическими жидкостями сопровождается увеличением удельной поверхности (S) силикагеля. Было высказано предположение, что большая S (или более высокая степень дисперсности частиц) связана со стабилизацией частиц гидрогеля вследствие ориентированной адсорбции молекул органических веществ на поверхности мицелл кремнекислоты [168, 206]. Образование адсорбционно-сольватных оболочек вокруг частиц препятствует дальнейшей поликоиденсации кремневой кислоты или растворению кремнезема [163].
В работе Высоцкого и др. [168] указывалось, что чем сильнее молекулы органических веществ связаны с частицами кремнекислоты (сольватирующее действие), тем меньше эти частицы агрегируются в процессе созревания гелей и формирования их структуры и тем большей удельной поверхностью обладают соответствующие ксерогели. При этом подчеркивалось, что влияние органических веществ на пористую структуру ксерогеля не ограничивается структурообразующим действием на стадии геля, а оказывает также влияние на величину капиллярных сил (через смачиваемость скелета геля) при сушке.
Комаров и Дубницкая [113] рассматривают сольватацию как фактор, влияющий на пористую структуру силикагеля главным образом на стадии структурообразования геля. Их точка зрения сводится к тому, что чем выше срод
ство интермицеллярной жидкости к поверхности глобус лиогеля, т. е. чем выше их сольватация, тем выше их агре-- гативная устойчивость. При таких условиях глобулы гелей обладают определенной относительной подвижностью, вследствие чего при сушке они под действием сил поверхностного натяжения интермицеллярной жидкости наиболее плотно упаковываются в объеме, образуя мелкопористые адсорбенты.
Таким образом, по Комарову, интермицеллярная жидкость является агентом, формирующим структуру адсорбентов на стадии геля. Структурирующую (сольватирую - щую) способность жидкости он связывает с ее полярностью. Чем выше полярность жидкости, тем более мелкопористой структурой обладает адсорбент и, наоборот, с уменьшением ее полярности образуются адсорбенты с более крупнопористой структурой. В качестве меры полярности им использована диэлектрическая постоянная (є) интермицеллярной жидкости.
Мы полагаем, что диэлектрическая постоянная жидкости, как и а и, не является единственной характеристикой, определяющей изменения в пористой структуре. Совершенно очевидно, что нельзя пренебречь влиянием а жидкости на стягивающее действие капиллярных сил в процессе сушки. Кроме того, необходимо учесть, что диэлектрическая постоянная жидкости не может служить критерием ее сольватирующей способности [207]. Более надежны в этом случае ряды сольватирующей способности жидкости, составленные на основании данных об электроннодонор - ных свойствах органических веществ, характеризующих их адсорбируемость силикагелем.
Критическое рассмотрение обширного экспериментального материала о влиянии природы интермицеллярной жидкости на пористую структуру силикагеля показывает, что полученные результаты недостаточны для окончательного решения вопроса.