АТОМЫ И МОЛЕКУЛЫ КАК ЭЛЕМЕНТАРНЫЕ КИРПИЧИКИ, СОСТАВЛЯЮЩИЕ ПРИРОДУ
Вся органическая и неорганическая природа состоит из атомов химических элементов, весь набор которых представлен в периодической таблице Менделеева. Каждый атом имеет ядро, окруженное электронами, вращающимися вокруг него с огромной скоростью на разных орбитах, согласно планетарной модели Бора и Резерфорда. Вопросами строения атомов, их возникновения и распада занимается ядерная физика - целая отрасль научных знаний, рассматривающая самоорганизацию атомов. Здесь я этих вопросов не касаюсь, представляя, как это обычно делается, атомы в виде упругих шариков различного размера в зависимости от их массы.
Атомы являются первичной элементарной частицей материального мира; именно с них начинается его самоорганизация - сначала в молекулы, затем уже в конкретно осязаемые вещества, предметы, растения и живые существа. Атомы обладают двумя важнейшими свойствами, которые по существу определяют последующую самоорганизацию природы.
Первое свойство: атомы имеют способность химически соединяться друг с другом в молекулы веществ, количество разновидностей которых неизмеримо больше, чем количество разновидностей атомов. По существу, молекулы и придают всем химическим веществам свойства, которые мы наблюдаем в окружающем мире. По современным представлениям, химическая связь является результатом движения электронов внешних (валентных) оболочек атомов в пространстве между ядрами взаимодействующих атомов. Возникновения связи обусловлено тем, что электроны, которые принадлежат двум различным атомам, становятся для них общими при сближении атомов. Главнейшими типами связи являются ковалентная, ионная, металлическая, ван-дер-ваальсова (молекулярная) и водородная. Их можно сгруппировать в два типа: ориентированные относительно друг друга на поверхности атома и не ориентированные (терминология автора).
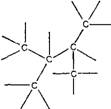
Типичным представителем первого типа является ковалентная связь. Для нее характерно, что на поверхности атома того или иного элемента эти связи размещены определенным образом и поэтому соединение атомов в молекулы происходит в определенных участках их поверхности. Можно образно сказать так: на поверхности имеются определенные "стыковочные узлы", к которым пристыковываются другие атомы, подобно тому как составляются модули на космической станции "Мир". Причем для состыковки "узлов" необходимо, чтобы атомы еще
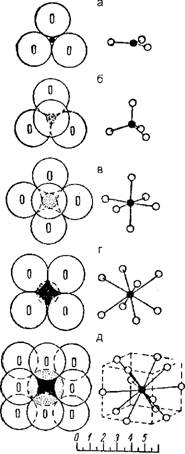
и соударились под определенным углом и с определенной минимальной скоростью. Таких "стыковочных узлов" на поверхности каждого атома может быть несколько, например, у углерода - четыре, у кислорода - два, у азота - три (рис. 1). Причем у разных атомов пространственное расположение "узлов" на поверхности может меняться. Ковалентная связь возникает при сближении атомов, когда образуется пара электронов, которые движутся одновременно в полях обоих атомов, связывая их таким образом. Причем атомы оказываются как бы вдавленными друг в друга, что несколько уменьшает их радиус.
Некоторой разновидностью ориентированной связи является водородная связь, которая проявляется благодаря поляризации двух соседних молекул, что можно наиболее четко видеть на примере молекулы воды - Н2О. В целом эта молекула электронейтральна, т. е. имеет равное число электронов и протонов в ядре, но электроны распределены несимметрично, что придает ей полярный характер. Атомы водорода "состыкованы" с атомами кислорода ковалентными связями с одной половины ее поверхности. Поэтому в целом молекула получается несимметричной. В ней ядро атома кислорода в некоторой степени оттягивает электроны от ядер атомов водорода, оставляя на них небольшой суммарный положительный заряд. Области с небольшим отрицательным зарядом располагаются вблизи атома кислорода в двух других углах воображаемого тетраэдра. Так получается дипольная молекула воды с положительным и отрицательным зарядами на двух противоположных концах, которые и способны притягивать другие атомы.
|
|
|
Существуют двойные связи, которые относительно других связей могут быть расположены по-разному |
|
|
|
Рис. 1. Схема размещения ковалентных связей на поверхности атомов углерода, азота и кислорода |
Неориентированные связи — ионная и металлическая — позволяют атомам соединяться также в определенных точках, распределенных по их поверхности равномерно и в достаточно большом количестве, так что при этом, в отличие от ковалентной связи, все равно, с какой стороны присоединяются атомы. Ионная связь возникает в результате того, что при взаимодействии атомов один из них притягивает в сферу своего ядра один или несколько электронов и становится отрицательно заряженным ионом (анионом), а другой, отдавая электроны, становится положительно заряженным ионом (катионом). Между разнозаряженными ионами появляется электростатическое взаимодействие притяжения.
Металлическая связь в наиболее чистом виде наблюдается между атомами одного и того же элемента - металла, рассматриваемого как совокупность положительно заряженных ионов - "атомных остовов", между которыми свободно перемещаются электроны в виде "электронного газа".
Ван-дер-ваальсова связь проявляется в результате взаимодействия нейтральных молекул. При вращении электрона вокруг положительного ядра атома в каждый момент образуется диполь - "ядро-электрон". При достаточном сближении соседних атомов возникает взаимодействие между их мгновенными диполями, так называемое диполь-дипольное взаимодействие, т. е. слабые силы притяжения, называемые остаточными, или ван-дер-ваальсовыми.
Второе важнейшее свойство атомов и образованных из них молекул: они постоянно находятся в движении с огромной скоростью (около 500 м /с). Причем они двигаются, соударяясь и ни на мгновение нигде не останавливаясь, даже находясь в составе твердых тел, растений и живых организмов, не говоря уже о газах и жидкостях. Непосредственным проявлением этого движения в газах или жидкостях является, например, передача в воздухе запаха растворенного газа из одной комнаты в другую или движение растворенного в воде вещества в процессе диффузии; в твердых телах - изменение температуры от более нагретых участков к менее нагретым за счет того, что двигающиеся в составе кристаллической решетки атомы передают энергию движения соседним атомам. Движение или имеет характер хаотического зигзагообразного перемещения с равной вероятностью во все стороны в газах и жидкостях при самодиффузии, или является колебательным около узлов кристаллической решетки в твердых телах, или хаотическим, но двухмерным на какой-либо поверхности, например, в биологических мембранах. Молекулы и атомы также могут вращаться вокруг своей оси - спиновое движение.
Именно это многообразие и большая скорость движения молекул и атомов позволяет им с огромной частотой соударяться друг с другом; при этом высока степень вероятности того, что произойдет их состыковка в более крупные частицы (молекулы) в зависимости от количества и расположения "стыковочных узлов", с учетом необходимости достаточно высокой концентрации атомов и молекул в определенном участке.
Значит, весь окружающий нас мир состоит из постоянно двигающихся атомов и молекул. Но в чем же принципиальное различие органической - живой - материи от неорганической - неживой - на атомно - молекулярном уровне?
Ca Na и и Mg К
|
|
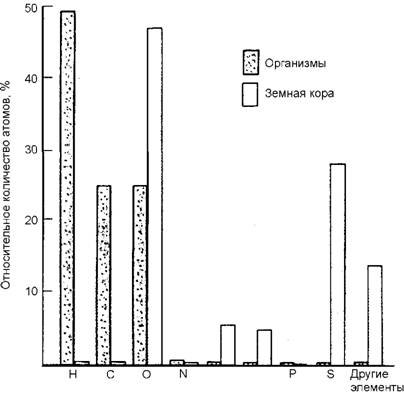
Рис. 2. Относительное количество (% к общему числу атомов) химических элементов, обнаруженных в земной коре (неживой мир) по сравнению с количеством тех же элементов в мягких тканях живых организмов Первое отличие заключается в количественном соотношении веществ, что можно видеть на рис. 2. Если в неживой природе количественно преобладают кислород (48 %) и кремний (28 %), то в живой - водород (49 %), углерод (24 %) и кислород (24 %). Известно, что, например, в биологической клетке человеческого организма содержится более чем по 1014 атомов водорода и кислорода, по 1012-1014 атомов углерода и азота, по 101О-1012 атомов кремния, фосфора, натрия, калия, магния, кальция и хлора, по 108-1010 атомов цинка, лития, рубидия, меди, марганца, алюминия, железа, брома, по 106-108 атомов олова, титана, молибдена, кобальта, йода, свинца, серебра, бора, стронция, никеля, ванадия, скандия, кадмия, хрома, селена, по 104-106 атомов урана, рту
ти, бериллия и по 102-104 атомов еще сорока элементов таблицы Менделеева, т. е. в нас самих есть все элементы, из которых состоит окружающий нас мир, и мы — часть этого мира.
Второе отличие заключается в том, что неорганические молекулы образуют твердые кристаллы с правильными кристаллографическими очертаниями, тогда как органические молекулы представляют собой обычно длинные цепочечные агрегаты из десятков, сотен, тысяч и даже миллионов атомов, которые сворачиваются в виде клубков, змеек, спиралей и являются, таким образом, тоже своеобразной разновидностью кристаллов, от физико-химических свойств которых зависит существование органического мира. Рассмотрим эти особенности подробнее сначала для неорганической природы.
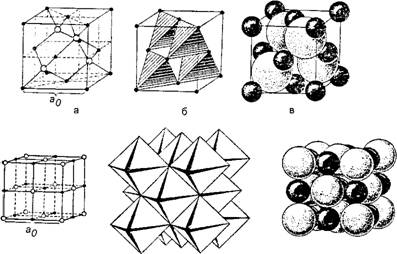
Из учебников минералогии известно, что в неорганическом мире атомы и ионы (т. е. положительно или отрицательно заряженные атомы), создавая кристаллическую решетку, попадают в окружение других ионов противоположного знака (катионов и анионов), притягивающихся друг к другу. Причем размер отрицательно заряженных анионов обычно гораздо больше, чем положительных катионов, так как анионы присоединили к своей внешней оболочке дополнительные валентные электроны, отняв их от катионов. В целом анионы и катионы разных элементов рассматриваются как упругие несжимаемые шарики, имеющие разные диаметры для различных веществ. Одним из необходимых условий устойчивости кристаллической решетки минералов является максимально плотная упаковка ионов разного диаметра, так, чтобы шары-атомы верхнего слоя попали в лунки между шарами-атомами нижнего по принципу плотнейшей кубической или гексагональной упаковки, образуя предельно минимальное свободное пространство и соприкасаясь друг с другом (рис. 3). Такая упаковка складывается самопроизвольно в процессе роста кристаллов в зависимости от размеров ионов.
Число ионов, находящихся на одинаковом или близком расстоянии от данного иона, называется координационным числом. В минералогии говорят о координационном числе катиона по отношению к анионам, которыми в большинстве случаев являются О2-, S2-, F-, Cl-, Br-, I-. При соединении прямыми линиями центров окружающих (координированных) атомов или ионов вокруг данного катиона образуется геометрическая фигура — координационный полиэдр.
|
А б в Рис. 3. Три типа моделирования кристаллической структуры сфалерита ZnS (вверху) и галенита PbS (внизу): а - разреженные модели; б - структуры в поллинговских тетраэдрах и октаэдрах; в - плотнейшая упаковка (черные шарики - катионы цинка или свинца, белые - анионы серы) |
Координационное число зависит от соотношения радиусов ионов и типов их химической связи. Принимая во внимание, что наиболее устойчивой будет такая кристаллическая структура, когда все ионы касаются друг друга, геометрически рассчитаны оптимальные отношения радиуса катиона к радиусу аниона для различных координационных чисел. Оказывается, в зависимости от различий в радиусах ионов их плотнейшая упаковка может быть достигнута различными способами. Например, если взять три больших шара-аниона и плотно положить их на плоскости, то в промежутке между ними сможет поместиться только очень маленький шарик - катион (рис. 4, а). Если на эти три шара положить сверху еще один, то в образовавшийся между ними промежуток сможет поместиться несколько больший шарик (см. рис. 4, б). Если сложить вместе (квадратом) четыре шара, то в промежутке между ними поместится еще больший шарик (см. рис. 4, в), и так далее. Последовательное увеличение размеров шарика-катиона позволяет ему быть окруженным все большим количеством шаров-анионов. В соответствии с этим координационное число будет расти вплоть до максимально возможного - 12, т. е. до тех пор, когда в окружении катиона окажутся 12 наиболее близко расположенных к нему анионов.
00,1- Q
Б 7 8 9 Ю'А 1 I ■ I, I iJ
|
02"0H1" F HoO |
|
[N03]1" |
|
[С03Г [B03]2 |
|
[S04]2" [Cr04]2" [W04]2" [PO4]3- [AS04]3" [VO4]3- [Si04]4" [AI04]5" |
|
AI06 MgOg SbOg TiOg LiOg NaOg и др. |
|
СаО РЬО |
|
NaOg CaOg CeOg Pb08 Рис. 4. Различные типы координации катионов и анионов |
|
12 12 |
Но такое последовательное увеличение координационного числа возможно, только если все катионы способны со всех сторон равномерно окружать себя анионами, как в случае ионной связи, не имеющей пространственной ориентировки на поверхности атома. Однако, например, ковалентные связи в каждом атоме строго ориентированы, т. е. здесь как бы имеются определенные "стыковочные узлы", к которым могут присоединиться другие ионы. Поэтому, например, способ упа
ковки позволял бы иметь еще несколько ближайших соседей, но для них нет соответствующих "стыковочных узлов". При этом следует учитывать, что количество и относительное размещение этих "узлов" на поверхности ионов может варьировать для разных их типов.
Поэтому нетрудно представить себе, что несмотря на такие в принципе простые формы связи атомов и молекул в кристаллической решетке, количество разновидностей таких решеток и соответственно минералов может быть огромным. В них меняются форма координационных полиэдров (пирамида, тетраэдр, октаэдр, куб, додекаэдр и т. д.) и пространственное размещение и сочетание в объеме кристаллической решетки.
В процессе минералообразования происходит формирование минералов, характеризующихся определенным химическим составом и соответствующей кристаллической структурой. Причем состав и структура взаимосвязаны, так как каждое сочетание атомов при данных условиях образования минералов может иметь лишь определенную структуру. Соединяясь в кристаллическую структуру, атомы химических элементов используют и все присущие им формы связи и очень плотно упаковываются в зависимости от соотношения размеров их атомов и ионов.
По степени однородности связей в структурах решетки все минералы могут быть разделены на два типа: гомодесмические и гетеродес- мические.
В гомодесмических минералах почти все атомы обладают одним и тем же типом связи: ионной, ковалентной, металлической и т. д. Поэтому все связи распределяются одинаково во всех направлениях и для кристаллов характерно равномерное распределение в пространстве всех атомов и ионов. Такими являются каменная соль (NaCl), галенит (PbS), флюорит (CaF2), алмаз (С), сфалерит (ZnS).
Гетеродесмические минералы характеризуются тем, что в разных частях и по разным направлениях в них связи одинаковые: одни группы атомов соединены друг с другом при помощи одних связей, а соединение между группами других атомов осуществляется при помощи других. По типам обособленных групп атомов они подразделяются на островные, цепочечные, ленточные, слоистые и каркасные.
Островные минералы характеризуются обособленными группами атомов (радикалов), связи внутри которых прочнее, чем связи с окружающими их атомами (рис. 5). Радикалы могут иметь линейную, треугольную, пирамидальную, тетраэдрическую и другие формы. Отдельные изолированные группы атомов в структуре минерала могут соединяться в кольца, как, например, в самородной сере или берилле.
|
А |
|
Рис. 5. Островной тип структуры (форстерит): а - плотнейшая упаковка; б - общая структура; в - в поллинговских окраэдрах |
Цепочечные минералы характеризуются наличием бесконечных групп атомов, расположенных в виде цепочки с существенно ковалент - ной связью между ними (рис. 6). Цепочечный характер структуры определяется четко выраженной направленностью наиболее прочных пространственно ориентированных ковалентных связей. К ним относится широко распространенная группа - пироксены. Наряду с такими оди
ночными цепочками часто бывают развиты сдвоенные, которые называют лентами, а структура, для которых они характерны, - ленточной. К ним относится группа амфиболов.
Слоистые минералы характеризуются наличием группировок атомов, составляющих "бесконечные" слои, внутри которых связи одни, а между слоями - другие (рис. 7). Им свойственно двухмерное распределение наиболее прочных связей, т. е. расположение структурных единиц и координационных полиэдров в плоскости. К слоистым типам с совершенной спайностью в одной плоскости относятся слюды, графит (С), молибденит (MoS), каолинит, брусит и др.
Рис. 6. Цепочечный тип структуры (диопсид - СаMg[Si2O6])
Каркасные минералы характеризуются наличием трехмерного каркаса, образующегося за счет равномерного пространственного распределения ковалентных и ионных связей между атомами. К ним относятся многие алюмосиликаты, в частности полевые шпаты.
|
|
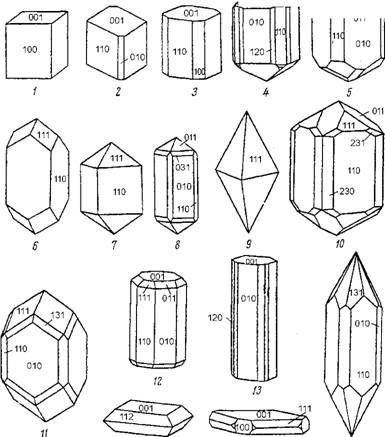
Таким образом, атомы и ионы химических элементов при формировании минералов неорганической природы способны плотно упаковываться в кристаллическую решетку определенного типа в зависимости от их размеров и видов химической связи. Форма геометрического узора, который получается при этом (цепочечный, слоистый, каркасный и др.), определяет и морфологию образующихся кристаллов (рис. 8). Форма кристаллов определяется их поверхностными гранями. Геометрическое расположение граней определяется законом Бравэ: при образовании кристаллов развитие и частота появления граней, ограничивающих кристалл, зависят от густоты расположения атомов и ионов на этих гранях (ретикулярная плотность). Чем гуще грани покрыты атомами, тем они важнее, т. е. чаще встречаются на кристаллах.
В зависимости от плотности распределения атомов и ионов в кристаллической решетке происходит рост кристаллов той или иной формы. Из любых возможных направлений в кристаллической решетке наиболее конкурентоспособными поверхностями роста являются те, где атомы ближе расположены друг к другу, так как здесь меньше расстояние между ними и поэтому они способны более прочно связываться друг с другом, РиС. 7.Структура графита отсекая все другие направления.
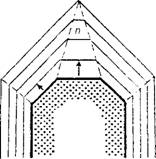
Но это еще не значит, что та или иная плоскость с высокой плотностью атомов будет быстрее расти. Даже совсем наоборот: согласно закону Бравэ грани кристалла растут со скоростью, обратно пропорциональной плотностям их распределения. Это понятно, ведь, например, при одинаковой концентрации в растворе грани с большей плотностью атомов больше их поглощают из раствора и этим быстрее снижается их концентрация около этой грани, что ведет к замедлению ее пространственного продвижения. Но именно эти медленно растущие грани и определяют в конечном счете основные черты конфигурации кристаллов, так как быстро растущие грани зарастаются ими (рис. 9).
|
|
Представляется интересным обратить внимание на механизмы роста кристаллов. Атомы, молекулы и ионы, составляющие газообразные или жидкие (растворы и расплавы) вещества, находятся в непрерывном движении. Они постоянно сталкиваются друг с другом, и периодически это столкновение ведет к образованию зародышей - микроскопических фрагментов будущей структуры. Чаще всего такие зародыши распадаются, что связано либо с собственными колебаниями, либо с бомбардировкой их свободными частицами. Для начала кристаллизации нужно, чтобы зародыш достиг критической величины, т. е. содержал такое количество частиц, при котором присоединение следующей частицы сделало бы разрастание зародыша более энергетически выгодным, чем его распад. Такая возможность для большинства веществ появляется либо с понижением температуры, в результате чего уменьшаются тепловые колебания, либо с повышением концентрации вещества в растворе или газе, что приводит к увеличению вероятности встречи частиц друг с другом, т. е. возникновению зародышей. Причем кристаллизация протекает не во всем объеме, а преимущественно там, где возникнут зародыши.
|
15 16 Ш Рис. 8. Габитусные типы кристаллов тетрагональной сингонии 1 - мелилит Ca2(Mg, Al)[(Si, Al)2 SiO7); 2 - скаполит (Na, Ca)4(Cl, CO3)[Al(Si, Al)Si2O8]; 3 - висмутит Bi2O2[CO3]; 4 - селаит MgF2; 57, 12 - касситерит SnO2; 6, 14 - циркон Zr[SiO4]; 8 - ксенотим Y[PO4]; 9 - анатаз TiO2; 10 - рутил TiO2; 11 - торит Th[SiO4]; 13, 16 - апофиллит Kca[Si4O10]2F-8H2O; 15 - шеелит Ca[WO4] |
Причина кристаллизации, т. е. перегруппировки беспорядочно расположенных частиц в регулярную кристаллическую постройку, заключается в том, что энергетически выгодно такое состояние, при котором силы, действующие на частицы, окажутся уравновешенными, а это дос
тигается лишь в случае упорядоченного расположения материальных частиц. Каждый растущий кристалл, стремясь к равновесному состоянию, приобретает в целом определенную для того или иного вещества форму. Но на эту форму определенное влияние оказывают также и изменяющиеся условия кристаллизации - температура, давление, химизм и динамика кристаллообразующей среды и т. д. И кристалл, приспосабливаясь к этим изменяющимся условиям, может менять, иногда и существенно, свой облик.
Ilk.
А б
Рис. 9. Схема зарастания быстро растущих граней кристалла
|
|
|
Т О* |
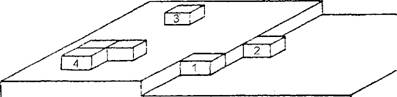
Теория Кооселя-Странского объясняет явление послойного роста граней кристаллов с позиций атомно-молекулярного состояния поверхности растущего кристалла, опираясь на энергетическую выгодность присоединения отдельных частиц вещества в зависимости от положения на свободной поверхности кристалла. На рис. 10 показаны позиции присоединения идеализированных (в форме кубов) частиц к поверхности растущего кристалла. Нетрудно понять, что новые частицы присоединяются к поверхности кристалла в самых энергетически выгодных позициях. Например, как показано для позиции 1 на рис. 10, где присоединившаяся частица, входя в угол постройки, наиболее прочно свяжется с кристаллом с трех сторон, обеспечивая, с точки зрения термодинамики, максимальное выделение свободной энергии, в результате чего достройка получит энергетическое преимущество. Это в принципе понятно и из чисто механических представлений: присоединение частицы к угловому углублению постройки свяжет ее наиболее прочной связью. Следующей по энергетической выгодности и механической прочности будет положение 2, вследствие связи в двух направлениях. И, наконец, наименее благоприятно положение 3 - на гладкой поверхности грани. Связь таких частиц слаба - в одном направлении, и поэтому они не в состоянии на ней удержаться. Чтобы грань росла, на ее по
верхности необходим устойчивый двухмерный зародыш (позиция 4), который может образоваться из нескольких случайно столкнувшихся частиц. Вероятность появления такого двухмерного зародыша зависит от степени пересыщения или переохлаждения. Такую теоретическую схему роста кристаллов сравнивают с кирпичной кладкой, где каждый новый слой не будет выложен, пока не закончится кладка предыдущего, поскольку достраивать всегда легче, чем начинать заново.
|
|
Рис. 10. Различные способы присоединения частиц к поверхности растущего
Кристалла
Далее перейдем к характеристике атомов и молекул органического мира природы в изложении авторов книги "Молекулярная биология клетки" (Албертс и др., 1994).
Главнейшие отличия живой природы от неживой обусловлены удивительными свойствами атомов углерода, которые он проявляет в условиях земной поверхности, входя в состав почти всех органических молекул биологической клетки. Уникальная роль углерода в клетке определяется его способностью к образованию четырех сильных кова - лентных связей с другими атомами углерода, благодаря малому размеру и наличию на внешней оболочке четырех электронов. В результате этого атомы могут соединяться друг с другом, образуя цепи, разветвленные деревья или кольца, создавая большие и сложные молекулы, на размеры которых не накладываются никаких видимых ограничений (рис. 11). Другие атомы, широко представленные в клетке (Н, N и О), имеют, как и углерод, небольшие размеры и способность также образовывать прочные ковалентные связи с углеродом и друг с другом, присоединяясь к цепочкам углерода. На разных звеньях цепочки количество соединенных таким образом атомов в одной биологической молекуле может достигать нескольких тысяч и даже миллионов.
Уникальная роль углерода в клетке определяется его способностью к образованию сильных ковалентных связей с другими атомами углерода. Таким образом, атомы углерода могут соединяться друг с другом, образуя цепи
С
УГЛЕРОДНЫЙ СКЕЛЕТ
|
Или кольца 7/'/ |
Или разветвленные деревья
|
|
|
Vwl |
|
ГТ |
|
ОС |
|
[Изображается также в виде |
|
Изображается также в виде |
|
Изображается |
Рис. 11. Схема соединения атомов углерода друг с другом в органически молекулах
Выделяются четыре основных класса малых органических молекул, входящих в состав клетки - аминокислоты, нуклеотиды, сахара и жирные кислоты. В принципе, их просто получить в процессе лабораторного опыта, если через нагретую смесь воды и газов (СО2, СН4, Н3 и Н2) пропустить электрический разряд или ультрафиолетовое излучение. Это основные кирпичики больших органических молекул, в состав которых они входят.
Последовательное соединение аминокислот ковалентными связями ведет к образованию больших полимерных молекул - белков, а соединение нуклеотидов образует рибонуклеиновую (РНК) и дезоксирибо - нуклеиновую (ДНК) кислоты; цепочки сахаров образуют полисахариды, а жирные кислоты участвуют в образовании фосфолипидных полимерных молекул. Все они являются важнейшими составными частями клеток, осуществляя определенные функции. В молекулах ДНК содержится вся генетическая информация, необходимая для создания и размножения новых клеток. Они вместе с молекулами РНК представляют как бы "программное обеспечение" инструкции, полученной клеткой от родительской. Белки выполняют важнейшую роль катализаторов большинства реакций в клетке, являясь ферментами. Сахара и полисахариды служат источником энергии в клетке, которая выделяется при их расщеплении. Жирные кислоты - основные компоненты при создании внешней и внутренних мембран клетки.
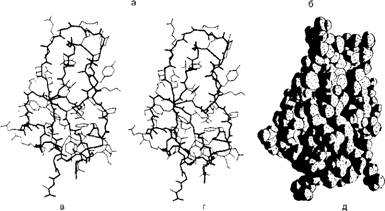
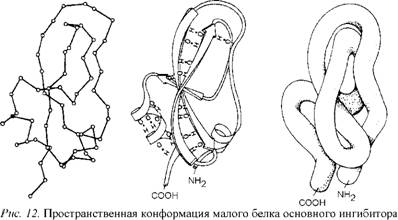
Универсальные "кирпичики", из которых состоят белки, - это 20 аминокислот, а молекулы ДНК и РНК состоят лишь из четырех типов нуклеотидов. Они в различном сочетании располагаются вдоль длинных цепей, создавая неповторимое своеобразие каждой из полимерных молекул. Причем в пределах каждой цепи эти "кирпичики" складываются обычно в виде не прямой линии, а спирали, напоминающей винтовую лестницу. Среди биологических структур весьма распространены лево - закрученная и правозакрученная спирали. В длинных цепях полимеров возможно свободное вращение атомов вокруг многих осей, что делает их остов очень гибким в отличие от неорганических молекул, жестко закрепленных в кристаллическом каркасе. Поэтому важнейшим свойством длинных молекул является также их способность сворачиваться в сложные структуры типа клубков, называемые конформациями. Это особенно характерно для белков; длинные полимерные цепи белковых молекул могут сворачиваться, как змейки, в молекулярные конформа - ции микроскопических размеров (рис. 12). Каждый тип полимеров, в зависимости от последовательности чередования в его цепи разных молекул, имеет свою, строго определенную, конформацию. Здесь существует определенная аналогия с неорганической природой, где сочетание
Трипсина поджелудочной железы в пяти обычно использующихся вариантах изображения (следует иметь в виду, что сердцевина всех глобулярных белков плотно заполнена атомами, и впечатление пустого пространства вызвано только характером моделей в, г и д) а - стереопара, показывающая положение всех неводородных атомов; основная цепь выделена жирной линией, боковые - тонкими;
|
|
|
|
Б - пространственная модель, показывающая ван-дер-ваальсовы радиусы всех атомов; в - скелетная проволочная модель, составленная из отрезков, соединяющих все атомы а-углерода вдоль полипептидного скелета; г - ленточная модель, которая представляет все участки регулярных водородных связей либо в виде спиралей (а-спирали), либо в виде набора стрелок (в-слои), указывающих на карбоксил-терминальный конец цепи; в этой модели также показаны водородные связи; д - "сосисочная" модель, которая демонстрирует расположение полипептидной цепи без всяких деталей
атомов разных веществ образует определенные типы кристаллической решетки и форму кристаллов, цвет, твердость, спайность и другие свойства. В органической материи роль кристаллов играют конформации полимерных цепей. Именно их индивидуальная форма свертывания определяет важнейшие свойства органических молекул.
Неполярные Главнейшим механиз-
Боковые группы г
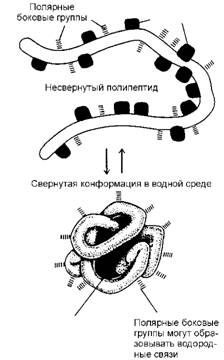
Мом, способствующим сворачиванию белковых молекул и созданию их конфор - маций, является различная способность отдельных участков тех или иных аминокислот, из которых состоит белок, смачиваться водой. Участки длинной цепи, не смачиваемые водой, стремятся собраться внутри белковой конформации, что позволяет им избежать контакта с водным окружением, подобно тому, как собираются вместе капельки масла в воде (рис. 13). В то же время смачиваемые участки, наоборот, стремятся расположиться на поверхности молекул белка, где могут контактировать с водой. В результате на поверхности молекулы оказываются полярные группы аминокислот создающие полярные (водородные) и ионные связи с другими молекулами при контакте с ними.
|
Рис. 13. Схематически показано, как белок свертывается в глобулу. Полярные боковые группы аминокислот стремятся расположиться на наружной поверхности белка, где могут взаимодействовать с водой. Неполярные боковые группы аминокислот расположены внутри, где образуют "спрятанное" от воды гидрофобное "ядро" |
|
Гиброфобный участок сердцевины содержит неполярные боковые группы |
При обработке определенными химическими реагентами белок можно развернуть, т. е. денатурировать; при прекращении действия денатурирующего реагента он обычно самопроизвольно возвращается к исходной конформации. Это говорит о том, что вся не
обходимая информация для определения формы белка содержится в самой последовательности аминокислот.
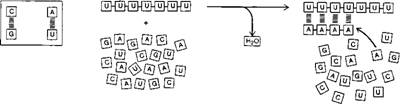
Органические молекулы, в отличие от неорганических, обладают и другими удивительными свойствами. Молекулы ДНК и РНК обладают способностью создавать копии себе подобных полимерных молекул. Это связано со способностью органических полимеров нуклеотидов служить матрицей для синтеза второго полимера, составленного из другого типа нуклеотидов. Подобные матричные свойства основаны на специфическом, так называемом комплементарном связывании поли - нуклеотидов друг с другом. Например, полимер Poly U способствует образованию Poly A, встраивая вдоль своей цепи необходимые субъединицы (рис. 14).
|
Рис. 14. Нуклеотиды способны связываться друг с другом (причем G предпочтительно связывается с C, а A - с U) при помощи сравнительно слабых химических связей (слева). Такое связывание позволяет одному полинуклео - тиду служить матрицей для синтеза другого (справа) |
Спаривание комплементарных нуклеотидов сыграло решающую роль в возникновении жизни на Земле. Это можно рассмотреть на простейшем примере полинуклеотида, подобного РНК и содержащего ура - цил (U), аденин (А), цитозин (С) и гуанин (G). Благодаря комплементарному спариванию оснований - А с U и G с С - при добавлении РНК к смеси активированных нуклеотидов в условиях, благоприятствующих полимеризации, синтезируется новая молекула РНК, последовательность нуклеотидов которой комплементарна последовательности нуклеотидов в исходной РНК. Таким образом, новые молекулы представляют собой как бы слепок исходной молекулы, каждому А которой соответствует U в копии и т. д. (рис. 15). На первой стадии информация, содержащаяся в последовательности исходной цепи РНК, сохраняется в новообразованных комплементарных цепях. На второй стадии копирование с использованием комплементарной цепи в качестве матрицы восстанавливает исходную последовательность.
Стадия 1
[IHMM^HIHZ]
Стадия 2
0{сНсНАНЖ1Кй]
|
Комплементарная последовательность образует исходную последовательность |
Исходная последовательность образует комплементарную последовательность
|
/ |
'
^^HgHJHCHOHA]
[иНсЖ}М1}Мй]
Рис. 15. Репликация последовательности полинуклеотида (здесь - молекулы РНК)
На стадии 1 исходная молекула РНК служит матрицей для образования молекулы РНК с комплементарной последовательностью. На стадии 2 эта комплементарная молекула в свою очередь служит матрицей для образования молекулы РНК с исходной последовательностью. Поскольку каждая матрица способна произвести много комплементарных копий, эти реакции могут привести к "размножению" исходной последовательности
Механизмы комплементарного матричного копирования изящны и просты, они занимают центральное место в процессах переноса информации в биологических системах. Генетическая информация каждой клетки закодирована в последовательности оснований ее полинуклео - тидов; эта информация передается из поколения в поколение, благодаря комплементарному спариванию оснований.
|
[uHCHCHAHGHG^ |
Важнейшей молекулой такого типа, несущей генетическую информацию, является дезоксирибонуклеиновая кислота - ДНК. Такое представление о ней возникло в научных кругах сравнительно недавно - в 40-50-х годах этого столетия. Собственно, и раньше было очевидно, что каждое зернышко или оплодотворенная яйцеклетка должны содержать скрытый план или схему развития организма. Поэтому возникла генетика, в основу которой легли представления о генах - невидимых содержащих информацию элементах, равномерно распределяемых между двумя дочерними клетками при каждом клеточном делении. Перед делением клетка должна сделать копию генов, чтобы передать дочерним клеткам полный их набор. Гены спермия и яйцеклетки передают наследственную информацию от поколения к поколению. Но что же это за молекула, которая могла храниться в клетке, направлять процесс развития организма и быть в то же время способной к точному и практически неограниченному самокопированию? В конце XIX века
биологи обнаружили, что хромосомы, которые становятся различимыми в ядре клетки в начале деления, являются носителями генетической информации. Но данные о том, что веществом, из которого состоят гены является ДНК хромосом, были получены значительно позже при изучении бактерий.
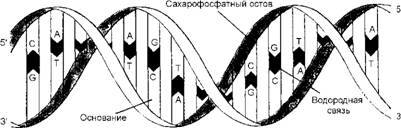
ДНК - это длинный неразветвленный полимер, состоящий всего из четырех субъединиц - дезоксирибонуклеотидов, азотистые основания которых представлены аденином (А), цитозином (С), гуанином (G) и тимином (Т). Нуклеотиды связаны между собой ковалентными фосфо - диэфирными связями, они как бы нанизаны на эту связь наподобие четырех типов бусинок на одной нитке. Молекулы ДНК имеют форму спирали, состоящей из двух цепей (рис. 16), причем каждая цепь этой спирали содержит последовательность нуклеотидов в точности комплементарную последовательности второй цепи - партнера, т. е. своего рода слепок этой цепи, поэтому они несут одну и ту же генетическую информацию. Если обозначить две цепи А и А1, то цепь А служит шаблоном или матрицей для образования новой цепи А1, а цепь А1 может играть ту же роль в образовании новой цепи А. Таким образом, генетическая информация может копироваться при разделении цепей А и А1, что позволяет каждой из них служить матрицей для образования нового комплементарного партнера.
Уже сам по себе механизм комплементарного копирования указывает, что наследственная информация ДНК записана в линейной последовательности нуклеотидов. Каждый нуклеотид (А, G, Т или С) можно рассматривать как букву в четырехбуквенном алфавите, которые используются для написания биологических инструкций в виде линейной "телеграфной ленты". Животные различных видов отличаются друг от друга потому, что молекулы ДНК их клеток имеют различную последовательность нуклеотидов и, следовательно, различное информационное содержание.
Характерным свойством полимерных биологических молекул и в первую очередь белков является их способность как ферментов ускорять биологические реакции в клетке. Такие каталические свойства белков полностью зависят от способа сворачивания их в конформации и связанного с этим расположения на поверхности аминокислотных остатков, способных образовывать слабые связи с другими молекулами. Чтобы взаимодействие белка с другой молекулой, называемой лигандой или субстратом (реактантом), было эффективным, между ними должно одновременно образовываться много слабых связей. Поэтому к белку прочно могут присоединяться лишь те лиганды, которые в точности подходят к его поверхности.
|
U 1 виток спирали = 3,4 нм |
|
Малая бороздка Большая бороздка Рис. 16. Двойная спираль молекулы ДНК, состоящая их двух антипараллельных цепей с комплементарной последовательностью нуклеотидов. Цепи завиты одна вокруг другой в правую спираль так, что на один виток спирали приходится приблизительно 10 пар оснований |
Ферментативный центр связывания, т. е. участок белка, взаимодействующий с молекулой субстрата, обычно имеет вид углубления, сформированного на поверхности белковой молекулы определенным расположением аминокислот. Эти аминокислоты часто принадлежат к удаленным друг от друга участкам свернутой в конформацию полимерной цепи и составляют лишь небольшую долю всех аминокислот белка. Остальные аминокислоты необходимы для поддержания правильной формы белковой молекулы и для создания дополнительных центров связывания, играющих регуляторную роль. Значение внутренней части белка ограничивается тем, что она обеспечивает нужную форму поверхности центра связывания и необходимую жесткость его структуры. Сущность ферментативного катализа заключается в том, что молекула субстрата на короткое время входит определенной своей частью в углубления
центра связывания, как ключ в замок, а затем распадается на две новообразованные молекулы, которые затем удаляются, освобождая центр связывания для новых молекул.
Важнейшим свойством одной из органических молекул - хлорофилла в растениях - является фотосинтез, т. е. способность использовать световую энергию солнца для превращения атмосферного СО2 и Н2О в органические соединения и кислород. Такими же свойствами обладают некоторые разновидности бактерий - цианобактерии (синезеленые водоросли). При фотосинтезе в растениях образуются молекулы сахаров, которые из листьев транспортируются в другие части (стебель, корни), участвуя в их построении. Запасенная таким образом энергия используется при жизнедеятельности растений, а затем ее используют живые организмы в качестве своеобразного топлива на энергетические нужды, и в частности на поддержание температуры тела.
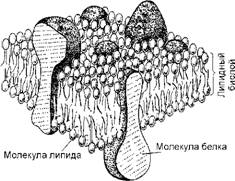
Некоторые органические молекулы - липиды, являющиеся разновидностью жирных кислот, - обладают еще одним удивительным свойством: они образуют клеточные мембраны, которые играют важнейшую роль в жизнедеятельности клеток (регуляция обмена веществ, придание клеткам определенной формы, разделение клетки на отдельные секции - компартменты, создание способов соединения клеток). Выделяются внешняя, так называемая плазматическая, мембрана, и внутренние. Они имеют общие структурные особенности: они представляют собой ансамбли липидных и белковых молекул, удерживаемых вместе с помощью нековалентных взаимодействий. Благодаря этим взаимодействиям поддерживается структурная целостность мембран. Однако сами по себе клеточные мембраны являются подвижными "текучими" структурами, большинство входящих в их состав молекул способно перемещаться в плоскости мембраны.
Липидные молекулы в мембране образуют непрерывный двойной слой толщиной около 5 нм (рис. 17). Липидный бислой - это основная структура мембраны, которая создает относительно непроницаемый, или, вернее, полупроницаемый барьер для большинства водорастворимых молекул. Белковые молекулы как бы растворены в определенных участках липидного бислоя и выполняют разнообразные функции мембраны - транспортировку молекул внутрь клетки, катализ ассоциированных с мембранами реакций, структурную связь плазматической мембраны с цитоскелетом, с внеклеточным матриксом и с соседней клеткой, роль рецепторов для получения и преобразования химических сигналов из окружающей среды.
В клеточной мембране присутствуют липиды трех типов - фосфо - липиды (наиболее распространенный тип), холестерол и гликолипиды.
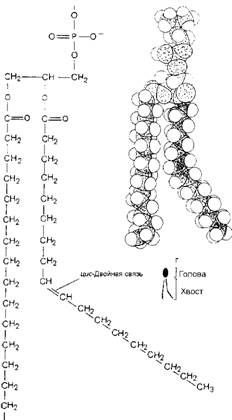
Все они представляют собой крупные органические молекулы, состоящие из многих десятков (до 150) атомов углерода, водорода, кислорода, фосфора, азота. Эти атомы соединены в цепи так, что молекулы имеют вытянутую форму (рис. 18). Липиды представляют собой так называемые амфипатические молекулы, т. е. у них есть гидрофильный ("любящий" воду, или полярный) и гидрофобный ("боящийся" воды, или неполярный) концы. Типичная молекула фосфолипида имеет гидрофильную голову и два гидрофобных углеводородных хвоста, представляя таким образом как бы двухвостого головастика (см. рис. 18).
|
|
|
Рис. 17. Схематическое трехмерное изображение небольшого участка клеточной мембраны |
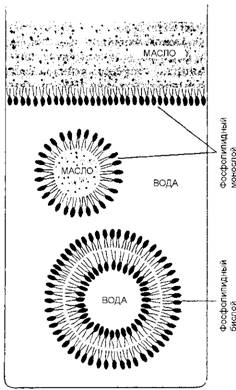
Амфипатический характер молекул липидов придает им удивительное свойство самопроизвольно формировать бислои в водном растворе. Когда амфипатические молекулы находятся в водном окружении, они стремятся агрегировать так, чтобы их гидрофобные хвосты были спрятаны от "боящихся" их молекул воды, а гидрофильные головки, наоборот, оказались бы в контакте с молекулами воды. Агрегация такого типа осуществляется двумя способами: путем образования либо сферических мицелл с хвостами, обращенными внутрь, либо бимолекулярных пленок, или бислоев (двойных слоев), в которых гидрофобные хвосты располагаются между двумя слоями гидрофильных голов. Большинство липидов в водной среде самопроизвольно образуют бислой (рис. 19). Более того, эти бислои имеют тенденцию к замыканию самих на себя, что приводит к формированию закрытых отсеков (компартмен - тов). При этом устраняются свободные края, на которых гидрофобные хвосты могли соприкасаться с водой. По этой же причине компартмен - ты, построенные из липидных бислоев, стремятся сами залечить свои повреждения, смыкая края разорванных участков.
Кроме способности к самосборке, липидный бислой обладает и другими характеристиками, делающими его идеальным материалом для
|
СН2 — N+(CH2)3 Сн2 |
|
ЛХОМи'и ; фосфат'. <тлйцёроН: ТТ 1 • :2"- |
|
О; х? £ го Q. I § С-0-5 О ае |
Сн2 I
Сн2 I
СН3
Рис. 18. Молекула фосфолипида фофсатилилхолина, представленная схематически (а), химической формулой (б), в виде пространственной модели (в) и символом (г). Чтобы отличить ненасыщенную цепь жирной кислоты от насыщенной, ненасыщенная цепь изображена с отчетливым изгибом. На самом же деле в ненасыщенной жирной кислоте жесткостью обладает только двойная связь. Вокруг всех одинарных связей возможно свободное вращение, поэтому в каждом липидном монослое обе цепи жирных кислот, как насыщенная, так и ненасыщенная, будут стремиться упаковаться параллельно
Клеточных мембран. Важнейшим из этих свойств является текучесть, которая обусловливает многие функции мембраны. Липидный бислой - это, по существу, двухмерная жидкость. Отдельные молекулы липидов способны диффундировать в пределах липидного бислоя. Они без труда меняются местами со своими соседями в пределах одного монослоя примерно 107 раз в секунду, что приводит к быстрой латеральной диффузии с коэффициентом 10 7 см-с-1, т. е. липидная молекула средних размеров диффундирует на расстояние, равное длине большой бактериальной клетки (2 мкм) за 1 с. Кроме того, молекулы липидов очень быстро вращаются вокруг своих продольных осей, а их углеводородные хвосты обладают большой гибкостью.
Рис. 19. Клеточные мембраны состоят из фосфолипидов, имеющих гидрофильные "головы" и гидрофобные "хвосты". На поверхности раздела воды и масла они самопроизвольно будут располагаться головными концами к воде, а хвостовыми - к маслу. В воде эти молекулы ассоциируют с образованием замкнутых
Двухслойных пузырьков, в которых гидрофобные хвосты контактируют друг с другом, а гидрофильные - с водой
|
|
Следует обратить внимание, что биологически клетки на 70 % состоят из воды, в присутствии которой только и возможны все процессы формирования и преобразования органических молекул.
Таким образом, принципиальное отличие неорганических и органических построек, создаваемых совершенно одинаковыми атомами (правда, в разном соотношении) заключается в том, что первые складываются путем непрерывной плотной упаковки атомов в виде кристаллической решетки (минерала), где все они сближены друг с другом, тогда как вторые образуются путем присоединения атомов к цепочкам атомов углерода, образуя длинные цепи, которые затем сворачиваются в молекулы разной конформации (часто в виде клубков и спиралей), или, присоединяясь друг к другу, образуют мономерные замкнутые сферические поверхности - мембраны клеток.