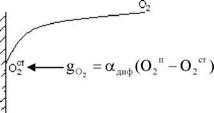Роль котлов в промышленной теплоэнергетике
Основы теории горения
При горение:
1. Окислительные (прямые) реакции:
С + О2 = > СО2 + 01!
2Н2 + О2 = > 2Н2О + 02!
2. Восстановительные (обратные) реакции:
СО2 = > со + о-0З!
Н2О = > он + ОН-04!
Различают горения:
1. Гомогенное (горючие и окислитель в одном агрегатном состоянии);
2. Гетерогенное (горючие и окислитель в разных агрегатных состояниях).
При гомогенном горении скорость реакции пропорциональна концентрации реагирующих веществ 'р = кЛтБп.
При гетерогенном горении скорость горения пропорциональна концентрации кислорода 'р =
|
Ш |
стенки
2 .
К - константа скорость химической реакции.
К = кое 'Е/КТ
Ко характеризует максимальное число активных молекул в реакционном объеме
К0 = Ал/Т
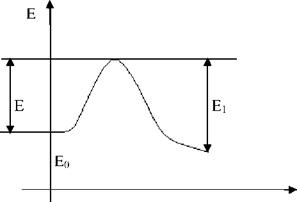
Е - энергия активации, которую необходимо сообщить системе для разрушения старых внутримолекулярных связей и образования активных осколков, дающих начало новым реакциям.
0 = Е1-Е
С + О2 = > СО2 + 140,
Гмоль
СО + 0, 502 = СО + 60, -^3^
Гмоль
|
|
Т
Для воспламенения смеси ее необходимо нагреть для, того чтобы увеличить долю активных молекул, т. е. таких у которых энергия больше энергии активации.
Ш !
Ыобщ
|
/ ////// / ъ ............................................ ^ э Е |
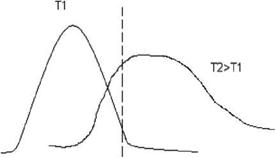
1. При Т = 0 к = 0;
2. С ростом Т растет и к;
3. При Т = го к = к°.
Скорость реакции горения зависит:
1. От Т
А/р
|
|
2.
|
УУр А |
|
Т |
![]() От Е
От Е
|
3. От концентрационных свойств смеси УУр
|
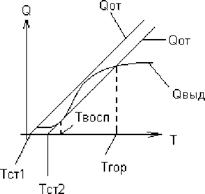
Температура воспламенения топливной смеси.
Это температура, при которой смесь воспламеняется и начинает устойчиво гореть. В топке происходит два процесса:
-Е
1. Тепловыделение 0Выд ~ к0 • eRT
|
|
2. Теплоотдача от факела к экрану 0 = а от' (Т _ Тст)
Для воспламенения необходимо, чтобы 0выд _> 0 от Твоспл зависит:
1. От состава топлива;
2. От условий расхолаживания топлива.
1воспл = 225 - 250 - 400 - 900, ?С
Торф БУ КУ Антр
Области горения топлива.
|
= т + т Хим физ |
![]() Общее время горения складывается из двух стадий: продолжительность химических реакций и продолжительности физических процессов.
Общее время горения складывается из двух стадий: продолжительность химических реакций и продолжительности физических процессов.
1.
Если продолжительность химических реакций много больше продолжительности физических процессов, то общее время горения равно продолжительности химических реакций и горение происходит в кинетической области (зависит от температуры).
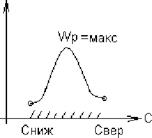
2. Если продолжительность химических реакций много меньше продолжительности физических процессов, то общее время горения равно продолжительности физических процессов и горение происходит в диффузионной области (определяется скоростью доставки окислителя).
3. Если продолжительность химических реакций равна продолжительности физических процессов - промежуточная область.
Горение твердого топлива.
Т = т + т
Общ тепл гор
1. ттепл - время тепловой подготовки топлива. Оно включает в себя нагрев, испарение влаги и выход летучих веществ.
2. Тгор включает в себя горение летучих веществ и горение коксового остатка.
_ лет. кокс
|
Гор |
![]() Тгор = т гор + т
Тгор = т гор + т
|
Общ |
![]() СКоксгор * 0,8 - т
СКоксгор * 0,8 - т
Механизм горения частиц.
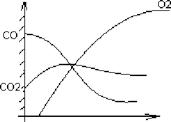
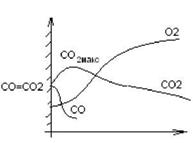
Поверхность частицы адсорбирует кислород с образованием комплексов Сх0у, которые генерируют СО и СО2.
 С + Ог = > СхОу = > гпСО + пСОг.
С + Ог = > СхОу = > гпСО + пСОг.
Соотношение СО и СО2 зависит от температуры.
1. При 1 = 1200?С
4С + 302 = 2С0 + 2С02
Из области С02макс часть С02 возвращается к частице и раскисляется С02 + С = 2С0 При малом расходе СО, О2 полностью не перехватываясь достигает поверхности частицы.
2. При І = 17007С ЗС + 2С>2 = 2СО + С02
|
|
При высоком расходе СО, 02 расходуется полностью, не достигая поверхности частицы.
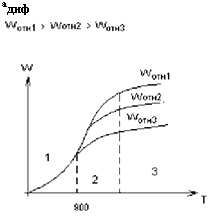
Скорость горения твердого топлива.
|
|
Бш - расход окислителя,
Адиф - константа скорости диффузии.
Скорость реакции горения
-Е
Wг = к° • е^ • 02Ст
Если решить эти два уравнения относительно 02ст, то получаем скорость горения: Wг = (——^—) • О2п = кг • О2п, кг - константа горения.
— + -
К а диф
1. При низких Т имеет место низкое значение к, значит
1 много больше —[1]—, поэтому Wг « к • О2П и Wг зависит от Т.
К а диф
2. При высоких Т имеет место высокое значение к, а значит
—1— много больше -1, поэтому Wг « а диф • О 2 п и Wг зависит от скорости
А диф к
Подачи окислителя.
|
АДиф |
|
Пути интенсификации горения. 1. Предварительное измельчение; 2. Интенсивное перемешивание в корне факела; |
 Где ё гв - размер частицы топлива.
Где ё гв - размер частицы топлива.
3. Эффективная доставка О2 к горючим в конце факела.
Горение жидкого топлива.
Мазут в факеле сгорает в виде капель при распылении форсунками. Стадии горения:
1. Нагрев до 1Кип ;
2. Испарение топлива;
3. Образование топливной смеси;
4. Ее воспарение и сгорание.
SHAPE \* MERGEFORMAT ![]()
1. 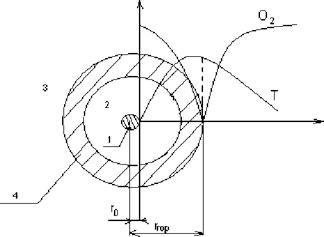 Капля;
Капля;
2. Зона диффузии паров;
3. Зона диффузии кислорода;
4. Зона горения;
5. Го - начальный радиус капли;
6. Ггор - радиус горения.
Ггор = (4-10) Го
Время горения капли определяется временем ее испарения.
2
Т =т « Г0
Гор исп _ п
-*т ■ О 2
1. при снижении Го, растет удельная наружная поверхность, а значит, растет теплота сгорания и снижается время испарения;
2. с ростом ТГ, растет АТ = ТГ — Тисп, а значит, растет теплота сгорания и снижается время испарения;
3. с ростом О2п, растет скорость горения, а значит, снижается время испарения.
За счет высокой теплоты сгорания QнР, мазут горит в диффузионной области.
Особенность:
При сжигании мазута имеет место термический крекинг (последовательное отщепление Н2 с образованием частиц сажи).
Недостатки сажеобразования:
• Неполнота сгорания (0, 1-0, 3%);
• Загрязнение окружающей среды;
• Загрязнение поверхностей нагрева (снижается коэффициент теплопередачи ^ поэтому снижается QoTд, а значит растет температура уходящих газов и снижается КПД котла).
Для исключения сажеобразования проводят окислительный крекинг при активном внедрении воздуха в корень факела. При этом кислород, разрывая зону горения, проникает в зону диффузии паров для насыщения углеводородов кислородом.