СТРОЕНИЕ МЕТАЛЛОВ И СПЛАВОВ
|
М |
Еталлы, как и все окружающие нас тела, состоят из отдельных невидимых даже в самый сильный микроскоп частиц, называемых атомами. Но атомы в свою очередь построены из ещё более мелких частиц: протонов, электронов и нейтронов. Протоны и электроны имеют электрические заряды: протон — положительный заряд, а электрон — отрицательный, нейтрон же не имеет никакого электрического заряда.
Если два протона «находятся близко, они отталкиваются друг от друга, так как они заряжены одноимённым электричеством. Так же ведут себя и два электрона. Напротив, протон и электрон притягиваются друг к другу, причём силы взаимного притяжения протона и электрона равны между собой, т. е. протон обладает элементарным электрическим зарядом, равным заряду электрона.
Атом в нормальном состоянии, т. е. когда он содержит одинаковое количество протонов и электронов, не обладает электрическим зарядом. Но бывают такие состояния атома, когда он приобретает или теряет электроны. Тогда атом становится электрически заряженным. При избытке электронов атом заряжен отрицательным электричеством, а при нехватке электронов он заряжен положительным электричеством. Вот такие атомы, в которых имеется избыток или недостаток электронов, называются ионами.
Как же располагаются элементарные частицы в атоме?
В настоящее время считают, что атом построен следующим образом. Протоны и нейтроны составляют ядро, находящееся в центре атома. Вокруг ядра обращаются электроны, которые образуют электронную оболочку атома. В каждом атоме количество электронов равно количеству протонов.
Электроны в электронной оболочке расположены слоями. В каждом слое может поместиться лишь опреде* лённое количество электронов. Первый слой, окружающий непосредственно ядро, может вместить лишь два электрона, второй слой — 8, третий — от 8 до 18 электронов. Каждый новый слой электронов при переходе от одного атома к другому образуется обычно после заполнения близлежащего к ядру внутреннего слоя.
Например, ядро атома натрия, как установлено, имеет 11 протонов, а его 11 электронов распределены в трёх оболочках: в первой — 2, во второй — 8 и в третьей —
1 электрон. Ядро атома рубидия содержит 37 протонов и окружено 37 электронами, котс^рые расположены в пяти оболочках: в первой — 2, во второй — 8, в третьей—18, в четвёртой — 8, в пятой — 1 электрон. Ещё более сложное строение имеет атом урана. Его ядро содержит 92 протона, а в электронной оболочке имеется 92 электрона.
Протон и нейтрон почти одинаковы по весу, а электрон почти в 1840 раз легче протона. Значит, основная масса атома содержится в его ядре. Чем большее количество нейтронов и протонов содержится в ядре, тем больший вес имеет атом.
Вес атома, например, в граммах выражать очень неудобно: потребовалось бы писать десятки нулей после запятой. Поэтому ввели понятие об относительном весе атомов, об атомном весе. Вначале за единицу был принят атомный вес водорода; с ним сравнивали атомные веса всех других элементов.
Стройную систему химических элементов создал великий русский химик Д. И. Менделеев в 1869 году, на основе открытого им периодического закона.
Сущность закона Менделеева состоит в том, что все химические элементы, расположенные один за другим в порядке возрастания атомных весов, образуют ряд, в котором химические свойства элементов через определённое количество элементов периодически повторяются.
Д. И. Менделеев расположил химические элементы в своей таблице так, что элементы, помещённые в одних и тех же вертикальных столбцах, обладают сходными химическими свойствами. Зная место элемента в таблице, можно определить большинство химических свойств элемента и его соединений. Каждый химический элемент в таблице Менделеева имеет порядковый номер. Его теперь называют числом Менделеева. Этот номер указывает число протонов в ядре. В одни и те же вертикальные столбцы таблицы попадают атомы с одинаковым числом электронов во внешней оболочке.
В зависимости от числа электронов во внешней оболочке меняются химические и физические свойства элемента.
Атомы одного и того же элемента, отличающиеся друг от друга лишь числом нейтронов в ядре, называются изотопами. «Изотоп» — греческое слово. Оно обозначает «занимающий одно и то же место». Изотопы каждого элемента располагаются в одной и той же клетке таблицы Менделеева, поскольку заряд ядра (количество прогонов) у изотопов одного и того же элемента одинаков. Металлы в отличие от жидких и газообразных тел в обычных условиях являются кристаллическими телами. Кристалл — это правильная фигура, ограниченная плоскими поверхностями.
Внутреннее строение кристаллов в настоящее время изучено довольно хорошо с помощью рентгеновских лучей. Освещая ими кристаллы, получают рентгенограмму, т. е. картину на фотопластинке, по которой определяют расположение атомов в кристаллической решётке и расстояния между ними. Рентгенограммы показали, что ионы металлов «укладываются» в кристалле примерно так же, как располагаются в ящике твёрдые шары.
Атомы разных металлов образуют неодинаковые кристаллические решётки. Чаще всего встречаются три типа решёток.
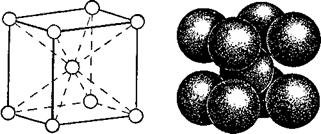
Первый тип — кубическая объёмноцентрированная решётка (рис. 1). Атомы металла в такой решётке находятся в вершинах и центре куба. Каждый атом окружён
|
Рис. 1. Кубическая объёмноцентрированная кристаллическая решётка Металла. |
Восемью атомами. Такую решётку имеют металлы ванадий, вольфрам, молибден, литий, хром и другие.
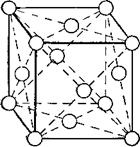
Второй тип решётки — кубическая гранецентрирован - иая (рис. 2). Атомы металла в ней расположены по вершинам граней куба. Такой решёткой обладают, например, алюминий, свинец, золото, серебро, никель, торий.
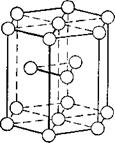
Третий тип — гексагональная (шестиугольная) плотно упакованная решётка (рис. 3). Она встречается у цинка, магния, кадмия, бериллия.
На рис. 1—3 атомы условно изображены в виде шариков. В зависимости от типа решётки атомы занимают в ней больше или меньше места. Например, в кубической объёмноцентрированной решётке атомы занимают 68% пространства, а в кубической гранецентрированной—74%.
Расположение атомов в кристаллической решётке оказывает большое влияние на свойства металла.
У некоторых металлов кристаллическая решётка может перестраиваться из одного типа в другой. Например, чистое железо при температурах ниже 910° имеет кубическую
объёмноцентрированную решётку, а выше 910° решётка становится гранецентрированной. Свойством изменять кристаллическую решётку обладают и такие металлы, как олово, уран, титан, таллий, цирконий, лантан, церий.
|
|
|
Рис. 2. Кубическая гранецентрированная решётка металла. |
 Свойство веществ образовывать решётки разной формы называют аллотропией; в переводе с греческого
Свойство веществ образовывать решётки разной формы называют аллотропией; в переводе с греческого
|
|
|
Рис. 3. Гексагональная (шестиугольная) плотно упакованная решётка. |
Языка это слово означает «другой поворот», «другое свойство». Общеизвестна аллотропия у кристаллического углерода. Он может находиться в виде графита и в виде алмаза. Графит и алмаз построены из атомов углерода; отличие их только в строении кристаллической решётки. А какая огромная разница в свойствах! Графит — мягкий,
Непрозрачный минерал чёрного цвега, алмаз, напротив, прозрачен, бесцветен и твёрд.
Атомы в кристаллической решётке металлов расположены столь близко друг к другу, что их внешние электроны имеют возможность двигаться не только вокруг одного атома, а вокруг многих атомов. Следовательно, внешние электроны, распределяющиеся в металле равномерно, свободно перемещаются по всему куску металла, образуя своеобразный электронный газ.
Таким образом, любой металл представляет собой решётку из правильно расположенных положительных ионов, заполненную электронным газом. Высокая прочность металлов и объясняется наличием электронного газа, который обволакивает все ионы, превращая металлический кристалл как бы в одно целое.
Ионы, находящиеся в определённых местах (узлах) кристаллической решётки, могут совершать, однако, движение — колебание. В ненагретом металле колебания ионов замедлены, в нагретом — ионы испытывают сильное колебание. Чем выше температура, тем сильнее раскачиваются ионы. Наконец, наступает момент, когда силы взаимодействия уже не могут удержать ионы в узлах кристаллической решетки и она разрушается; металл из твёрдого состояния переходит в жидкое. Это и есть температура плавления.
Если два расплавленных металла тщательно перемешать, то после затвердевания получится сплав этих металлов. Сплавы получаются и при сплавлении металла с неметаллом, например железа с углеродом, алюминия с кремнием и т. д. Свойства полученного сплава зависят не только от того, какие элементы входят в сплав, но и от внутреннего строения, или, как говорят, структуры сплава. Сплав является тоже кристаллическим телом.
Строение сплавов может быть различно. Составные части сплава могут образовать либо механическую смесь, либо твёрдый раствор, либо химическое соединение. Но есть сплавы, в которых имеются одновременно и механические смеси, и твёрдые растворы, и химические соединения.
Механическая смесь получается в том случае, когда составные части не взаимодействуют химически, а находятся в сплаве в виде самостоятельных мелких кристал
Ликов. Их можно наблюдать при рассматривании отполированной поверхности в микроскоп. Механические смеси образуются, например, при сплавлении свинца с сурьмой, висмута с кадмием и др.
Каждый знает раствор сахара или поваренной соли в иоде. Растворяя сахар или поваренную соль в воде, можно получить однородное вещество — жидкий раствор. В стакане воды можно растворить различное количество сахара
|
-(Ь---------- |
![]()
|
-"О-“О—О О" |
![]()
 Или поваренной соли. Поэтому такие растворы являются однородными веществами переменного состава.
Или поваренной соли. Поэтому такие растворы являются однородными веществами переменного состава.
|
Чр—ф—^—ф - 0) Атом тда Т Атом ткеля Рис. 4. Кристаллическая решётка твёрдого раствора замещения. |
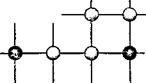
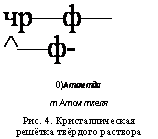 Оказывается, что подобные однородные системы переменного состава образуются и в твёрдых телах. Их называют твёрдыми растворами. В них атомы растворённого вещества и растворителя «рассеяны», перемешаны между собой. В кристаллической решётке вещества, являющегося растворителем, некоторые его атомы замещаются атомами растворённого вещества (рис. 4). Такие растворы называются твёрдыми растворами замещения. Их образуют при сплавлении, например, металлы медь и никель, железо и хром, золото и медь, серебро и золото, медь и платина и др.
Оказывается, что подобные однородные системы переменного состава образуются и в твёрдых телах. Их называют твёрдыми растворами. В них атомы растворённого вещества и растворителя «рассеяны», перемешаны между собой. В кристаллической решётке вещества, являющегося растворителем, некоторые его атомы замещаются атомами растворённого вещества (рис. 4). Такие растворы называются твёрдыми растворами замещения. Их образуют при сплавлении, например, металлы медь и никель, железо и хром, золото и медь, серебро и золото, медь и платина и др.
Замещение одних атомов другими в кристаллической решётке происходит в том случае, если атомы растворяемого металла близки по своим размерам атомам раство* рителя. Если разница в размерах атомов превышает 15%, твёрдый раствор замещения образоваться не может.
При очень большой разнице в размерах атомов образуются твёрдые растворы внедрения. Они чаще всего получаются тогда, когда металл растворяет в себе неметаллические элементы, атомы которых значительно меньше атомов металла. Самым распространённым сплавом, построенным по типу твёрдых растворов внедрения, является сплав железа с углеродом; этот сплав называется сталью. При образовании твёрдого раствора внедрения атомы внедряющегося элемента располагаются
в промежутках кристаллической решётки между атомами растворителя. Кристаллическая решётка твёрдого раствора внедрения показана на рис. 5.
А много ли можно растворить одного металла в другом? Неограниченная растворимость присуща далеко не всем металлам. В меди, например, может раствориться сколько угодно никеля, точно так же и в никеле можно растворить любое количество меди. Растворителем считают тот металл, которого больше в сплаве по весу.
|
О йтом дзота Рис. 5. Кристаллическая решётка твёрдого раствора внедрения. |
 Многие металлы обладают ограниченной растворимостью. Например, в алюминии можно растворить не более 5,5% меди по весу. При большем количестве медь находится в сплаве в виде отдельных нераст - ворённых частиц. Чем выше температура твёрдого раствора, тем больше меди можно растворить в алюминии (но не более 5,5%).При охлаждении этого сплава медь выделяется в виде мельчайших, очень твёрдых и хрупких частиц.
Многие металлы обладают ограниченной растворимостью. Например, в алюминии можно растворить не более 5,5% меди по весу. При большем количестве медь находится в сплаве в виде отдельных нераст - ворённых частиц. Чем выше температура твёрдого раствора, тем больше меди можно растворить в алюминии (но не более 5,5%).При охлаждении этого сплава медь выделяется в виде мельчайших, очень твёрдых и хрупких частиц.
Какова природа этих частиц? Оказывается — это не чистая медь, а её х и м и ч е - ское соединение с алюминием. Избыток меди в сплаве взаимодействует с алюминием химически. Кристаллики любого химического соединения в сплаве имеют вполне определённый состав. Так, например, при образовании химических соединений: железа с углеродом, называемого карбидом железа, три атома железа химически связаны с одним атомом углерода; алюминия с медью—два атома алюминия соединены с одним атомом меди. Для образования карбидов вольфрама или ванадия нужно, чтобы соотношение атомов этих металлов и атомов углерода было равно 1 : 1, а в карбиде хрома 23 атома хрома взаимодействуют с шестью атомами углерода.
Кристаллические решётки химических соединений очень сложны. При сильном разогревании сплава кристаллы химических соединений могут растворяться в твёр-
Дом растворе сплава, а при снижении температуры нагревания образовываться вновь.
Сплавы, применяемые в технике, имеют сложный химический состав. Высокопрочные стали, например, имеют в своем составе до десятка различных химических элементов. Чем сложнее состав и строение сплава, тем разнообразнее его свойства.
Редкие металлы, вводимые в состав сталей и сплавов, улучшают их качество, коренным образом изменяют первоначальные свойства сплавов, так как они часто образуют кристаллы химических соединений, упрочняющих твёрдый раствор.
Металлурги пользуются редкими металлами для того, чтобы выплавленные стали и сплавы были более прочны, более твёрды, обладали нужной пластичностью, упругостью, жароупорностью, химической' стойкостью и т. д. О том, какие это свойства и как они изменяются при добавке редких металлов, будет рассказано ниже.