ПРЕОБРАЗОВАТЕЛИ МЕТАЛЛУРГИИ
|
Ш |
Ироко известно высокое качество стальных дамасских клинков. Воины считали за честь держать в руках такое оружие. Поэты слагали стихи о крепости и остроте этих клинков. Секрет их изготовления знали немногие мастера; они строго хранили свой секрет, передавая его лишь своим сыновьям и внукам.
Методы изготовления дамасских клинков теперь раскрыты. Начало разгадке их положил великий русский металлург П. П. Аносов.
Один из секретов заключался в том, что дамасская сталь содержала редкий металл вольфрам. Незначительная примесь этого элемента, попадавшая в сталь, придавала клинкам их замечательные свойства.
Разгадан ныне и другой секрет древних мастеров — секрет остроты самурайских мечей: их сталь содержала редкий металл молибден.
Шведское железо, которое добывалось с древних времён в Скандинавии, особо хорошо ковалось по сравнению с обычным железом. Этим свойством скандинавское железо обязано редкому металлу ванадию.
В наши дни вольфрамовые, молибденовые и ванадиевые стали приобрели огромное значение в технике. Вольфрам, молибден, ванадий, а также цирконий теперь называют преобразователями металлургии.
Вольфрам — один из замечательных металлов. Это самый прочный и в то же время самый тугоплавкий на нашей планете металл. Прочность тонкой проволоки из чистого вольфрама вдвое выше прочности самой лучшей стали — около 400 кг/мм2. Предел прочности вольфрама при нагревании до 800° снижается только в три раза. Обычная же сталь при 800° имеет предел прочности лишь 5—7 /сг/лш2 — уменьшение более чем в 20 раз. Плавится
Вольфрам при температуре 3387°. Почти все металлы при такой температуре находятся в парообразном состоянии и очень немногие остаются в жидком состоянии. Чтобы расплавить вольфрам, нужно иметь температуру, лишь вдвое меньшую, чем температура поверхности Солнца, Температура кипения вольфрама — около 6000°.
Вольфрам открыт в 1781 г. шведским химиком К. Шееле. Почти сто лет вольфрам не находил промышленного применения. Только после того, как были определены его свойства, он занял прочное место в металлургии.
Вольфрам — металл серебристо-белого цвета. Атомы вольфрама образуют объёмноцентрированную кристаллическую решётку. Вольфрам более чем в два раза тяжелее меди. Его удельный вес—19,3. Твёрдость вольфрама по минералогической шкале — 8,5.
Несмотря на высокую прочность и твёрдость, вольфрам обладает редкой пластичностью: болванку весом в
|
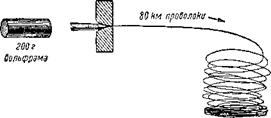
Рис. 11. Из куска вольфрама весом в 200 граммов можно вытянуть проволоку длиной 80 километров. |
200 граммов можно превратить в тончайшую проволоку длиной в 80 километров (рис. 11).
Промышленный способ производства ковкого вольфрама разработал русский химик Н. Н. Бекетов в 1860— 1870 годах.
В земной коре вольфрама немало — 0,007%. Предполагают, что в силу большого удельного веса вольфрам большей частью сосредоточился в центре земли. Однако вольфрамовые руды не рассеяны, они образуют скопления и удобны для промышленной добычи.
В настоящее время 90% всего добываемого вольфрама используется для изготовления сталей. Благодаря вольфраму созданы все быстрорежущие и почти все сверхтвёрдые стали.
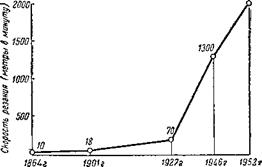
В 1865 году в городе Перми из 3 пудов вольфрамовой руды изготовили вольфрамовую сталь. Резцы для сверления пушек из этой стали оказались превосходными. С тех пор сотни металлургов и учёных трудились над созданием вольфрамовых сталей для инструментов. В результате многих исследований, наконец, создали замечательный вольфрамовый быстрорез. Менее чем за полвека вольфрамовые стали и сплавы дали возможность увеличить скорости резания металлов в 200 раз: от 10 метров
|
Гооо
Рис. 12. Сплавы, содержащие вольфрам, увеличили скорость резания металлов в 200 раз. |
До 2000 метров в минуту и выше (рис. 12). Вольфрам совершил настоящую революцию в машиностроении.
Но вольфрамовый быстрорез — не предел крепости. Теперь изготовляются сверхтвёрдые резцы. Основу их сплава составляет карбид вольфрама. В этом сплаве 85% всего объёма занимают частицы карбида вольфрама. Они впрессовываются в пластичный металл кобальт — связующую основу сверхтвёрдого сплава. Современные рекордные скорости резания, достигнутые новаторами наших заводов, получены резцами, изготовленными из твёрдых сплавов на основе карбида вольфрама.
Свойства стали, содержащей вольфрам, ещё в прошлом столетии изучил профессор Петербургского горного института В. И. Липин.
По физическим свойствам очень похож на вольфрам молибден. Он имеет такую же кристаллическую решётку, как и вольфрам. По своей прочности молибден
Тоже превосходит сталь: предел прочности молибденовой проволоки достигает 250 кг/мм2. Прочность молибдена при температуре 800° — около 60 кг/мм2, а твёрдость по минералогической шкале достигает 6.
Молибден имеет светлосерый цвет с золотистым отливом. Удельный вес его 10,3, температура кипения 4800°.
Молибден и вольфрам похожи и но химическим свойствам. Они одинаково активно соединяются с углеродом в стали и образуют твёрдые и устойчивые при нагревании карбиды. Эти металлы и придают прочность и твёрдость сталям. Интересна их взаимозаменяемость в стали: один процент молибдена заменяется тремя процентами вольфрама. Вольфрамовые и молибденовые стали сохраняют высокую прочность не только при обычных температурах, но и при температуре красного каления. Такие стали называются жаропрочными. Они употребляются, кроме инструментального дела, для изготовления деталей реактивного двигателя, работающих при сильном разогревании.
Не менее важную роль в металлургии играет редкий металл ванадий. Ванадий открыт в 1801 г. Инженер Шубин в 1839 г. обнаружил ванадий в медистых песчаниках. Спустя несколько десятилетий медистые песчаники, содержащие в себе ванадий, начали разрабатываться в Англии с целью получения ванадия. Промышленное применение ванадия началось значительно позже.
Ванадий — ковкий металл светлосерого цвета. Кристаллизуется в кубической объемноцентрированной решётке. Он почти в полтора раза легче железа: удельный вес его 6,0, твёрдость по минералогической шкале 7,5. Несмотря на сравнительную лёгкость, по тугоплавкости ванадий превосходит железо: его температура плавления 1725°. Металлический ванадий по прочности не уступает закалённой стали.
В СССР промышленные способы получения ванадия разработал профессор М. Н. Соболев.
Редкие металлы вольфрам, молибден и ванадий, добавляемые к сталям вместе с хромом и никелем, создали броневую защиту кораблям и танкам. Английские танки, появившиеся на фронтах первой империалистической войны, несмотря на 76-миллиметровую броню, изготовленную из обычных сталей, легко поражались бронебойными снарядами немецких пушек. Секрет заключался в
Том, что немцы изготовляли головку бронебойного снаряда из вольфрамовой стали.
Разгадав причину гибели своих танков, англичане ввели в броню танков вольфрам, молибден и ванадий. Вольфрам пошёл против вольфрама. В соревновании снаряда и брони в то время победила броня. Несмотря на троекратное уменьшение толщины броневых плит из новой стали, снаряды не могли их пробить.
В 1915 году в разгар империалистической войны Англия потеряла два дредноута и тяжёлый крейсер: они погибли, натолкнувшись на мины. Потопленные корабли имели толстую броню из обычной стали. Через 16 лет английский миноносец столкнулся у берегов Испании с такой же миной. Хотя броня его была значительно тоньше брони прежних боевых кораблей, взрыв не потопил миноносца. Тонкая броня его была изготовлена из стали, в состав которой входили редкие металлы.
Можно привести немало примеров, когда применение редких металлов даёт огромную экономию обычных металлов. Например, при отливке чугунных тюбингов, которыми укрепляются тоннели метро, к чугуну были добавлены небольшие количества некоторых редких металлов. Кольца получились прочнее прежних, что дало возможность уменьшить их толщину. Вес каждого кольца снизился с 7100 до 5760 кг. Небольшая добавка редких металлов улучшила качество изделий и позволила сэкономить много тонн чугуна.
Ванадий, добавленный в ничтожных количествах, повышает упругость и прочность стали почти на 50%. Ванадиевая сталь не боится перегревания, что делает её более устойчивой при закалке. В настоящее время все марки пружинных сталей содержат в себе до 0,5% ванадия. В сталях, употребляемых для изготовления нагруженных деталей машин, ванадия содержится всего от 0,10 до 0,15%.
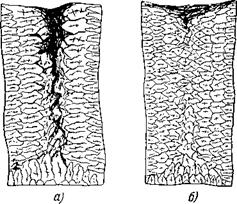
Чем объясняется благотворное влияние на сталь небольших добавок ванадия? Расплавленная сталь поглощает много газов — кислорода и азота, входящих в состав воздуха. При застывании стальных изделий азот и кислород в виде мельчайших пузырьков остаются в стали и нарушают её сплошность (рис. 13, а).Когда такую сталь куют, пузырьки с газом вытягиваются в виде нитей и образуют так называемые волосовины. Эти пороки сильно снижают прочность стальных изделий. Деталь из стали с волосовинами имеет неодинаковую прочность в разных направлениях.
Ванадий, добавленный в ванну, легко соединяется с кислородом и азотом, растворёнными в кипящей стали. В результате этого азот и кислород всплывают на поверхность ванны в виде шлака и удаляются. Сталь получается плотной, мелкозернистой (рис. 13, б) и менее хрупкой.
Часть ванадия, которая остаётся в стали, также не пропадает даром. Атомы ванадия активно связываются
|
Рис. 13. Строение стального слитка: а — без добавки ванадия, б — с добавкой 0,2% ванадия. |
С атомами углерода и образуют карбиды. Они-то и упрочняют сталь, действуя подобно карбидам вольфрама.
По своему влиянию на сталь редкий металл цирконий подобен ванадию. Он также выполняет роль «очистителя». Стали, содержащие сотые доли циркония, пригодны для изготовления броневых плит высокого качества. Циркониевые стали отличаются большой пластичностью, они отлично выдерживают высокие температуры, легко подвергаются свариванию.
Цирконий не только улучшает свойства стали, но и повышает качество сплавов алюминия. Без циркония некоторые алюминиевые сплавы после отливки имеют грубое пористое строение. Они не выдерживают гидроиспытаний. Под высоким давлением вода просачивается сквозь стенки алюминиевого цилиндра, так как он имеет много мельчайших пор. Достаточно в этот сплав при отливке доба -
Ёить небольшую дозу циркония или его соединения СО фтором,, как сплав становится мелкозернистым, пластичным и почти вдвое более прочным.
Цирконий—металл серого цвета. Чистый металлический цирконий имеет высокую пластичность.
При обычных температурах цирконий имеет гексагональную плотно упакованную кристаллическую решётку. Выше температуры 865° происходит перекристаллизация: цирконий имеет уже кубическую решётку. Удельный вес циркония 6,5. По температуре плавления цирконий находится в первом десятке наиболее тугоплавких металлов; он плавится при 1930°. Твёрдость циркония по минералогической шкале равна 6,7. Чистый цирконий в два-три раза более прочен, чем железо. Предел прочности циркония около 60 кг/мм2. Цирконий очень стоек в щелочах. Он не разъедается не только в крепких растворах щелочей, но и весьма устойчив при действии расплавленных щелочей. Цирконий при температурах 300—400° способен поглощать большой объём водорода. Но достаточно его нагреть до 1000°, как весь водород выйдет из металла. Это свойство циркония используется в технике для создания защитной водородной атмосферы при спекании порошков металлов.
Расплавленный цирконий является мощным источником света. Яркость его свечения составляет Vi6 яркости Солнца, в то время как яркость свечения расплавленного железа составляет лишь тысячные доли яркости Солнца.
Не менее интересные свойства имеет редкий металл литий. Ничтожная добавка его (всего 0,005%) облагораживает медь. Литий, активно взаимодействуя с кислородом, серой, азотом и водородом, растворёнными в меди, выполняет роль очистителя. Небольшие добавки лития способны повышать прочность алюминия, магния и других металлов и в то же время делать их более стойкими против разрушения щелочами и кислотами.
Литий — самый лёгкий металл на Земле. Его удельный вес — 0,534. Он в пять раз легче алюминия, иногда называемого за небольшой вес и широкое применение в авиации «крылатым» металлом. Самолёт из лития смогли бы легко поднять два человека.
Литий обладает самой сильной из металлов химической активностью. Он настолько активно соединяется с кислородом и азотом, что в плотно закрытой банке, где он хранится, вскоре образуется почти полная пустота, так
Как находящийся в банке воздух соединяется с литием и образует плёнку окислов и нитридов лития. Эта плёнка весьма стойка при нагревании; её можно расплавить лишь
|
Гидрид лития Рис. 14. Два килограмма гидрида лития содержат водорода столько, сколько его в этом баллоне. |
 При температуре 1700°, в то время как сам литий плавится при температуре 179°.
При температуре 1700°, в то время как сам литий плавится при температуре 179°.
Литий не менее активно соединяется с водородом, образуя твёрдую губчатую массу (соединение — гидрид лития). Два килограмма гидрида лития при разложении могут выделить столько же водорода, сколько содержится его в стальном баллоне (рис. 14) под давлением 120 атмосфер, т. е. 5664 литра. Поэтому гидрид лития может быть применён как компактная «упаковка водорода».
У металлургов огромное поле деятельности. Им предстоит изучить, как и почему действуют на сплавы микроскопические добавки редких металлов, найти законы изменения свойств сплавов под влиянием редких элементов, уточнить, какие качества сообщают сплаву различные добавки в тех или иных условиях. На основе теории сплавов советские учёные создали замечательные сплавы для постоянных магнитов. Новые магниты обладают колоссальной силой притяжения. Так, пластинка из одного специального сплава весом 90 граммов способна поднять груз весом в 25 килограммов. Этот груз превосходит вес магнита более чем в 250 раз.
Редкие металлы вольфрам, ванадий, кобальт и др. входят в состав сплавов для постоянных магнитов.
В царской России добывалось и использовалось в технике всего лишь 17 химических элементов. «Глину привозят из-за границы!» — с горечью и гневом писал в те годы академик В. И. Вернадский. После Великой Октябрьской социалистической революции произошёл переворот в
использовании природных ресурсов страны. В СССР в настоящее время добывается и используется в различных областях науки и техники около 90 химических элементов. Металлургическая промышленность нашей страны осваивает всё новые и новые редкие металлы.