ПРОИЗВОДСТВО ЭЛЕКТРИЧЕСКИХ АККУМУЛЯТОРОВ
ОДНОВРЕМЕННОЕ КАТОДНОЕ ВЫДЕЛЕНИЕ МЕТАЛЛА И ВОДОРОДА
Нанесение гальванических покрытий относится к числу процессов, для которых желательно иметь высокое значение перенапряжения водорода, так как в этом случае, как уже указывалось, скорость выделения водорода заметно уменьшается, а коэффициент использования тока (выход металла по току) повышается.
Важную роль водородного перенапряжения для процессов эле - хтрсосаждения металлов можно проиллюстрировать следующим примером.
Рассмотрим процесс осаждения цинка и кадмия из нейтральных растворов сернокислых солей этих металлов. Равновесные потенциалы цинка и кадмия в соответствующих растворах равны —0,76 и —0,4 В. Равновесный потенциал водородного электрода в этих растворах равен приблизительно —0,4 В.
Если бы выделение водорода на цинке и кадмии из этих растворов не сопровождалось заметным перенапряжением, то потребляемый при электролизе ток в ванне с сернокислым цинком полностью расходовался бы на выделение водорода, а в ванне с сернокислым кадмием на выделение металла расходовалось бы лишь ~50% тока.
Но в действительности ввиду того, что выделение водорода на цинке и кадмии связано с высоким значением перенапряжения, использование тока на выделение этих металлов из соответствующих растворов достигает довольно высоких значений (>90%).
Рассмотрим теперь различные случаи совместного выделения металла и водорода в зависимости от хода изменения значений их потенциалов в процессе электролиза. Это удобно сделать с помощью кривых плотность тока — катодный потенциал.
|
Рис. 7. Зависимость катодных потенциалов ионов металла и водорода от плотности тока при выделении только водорода |
На практике могут наблюдаться следующие случаи:
|
Металл ВоЭороо
Катодный потенциал Рис. 6. Зависимость катодных потенциалов ионов металла и водорода от плотности тока при выделении только металла |
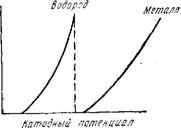
Потенциал металла при всех значениях плотности тока положи - тельнее, чем потенциал выделения водорода (рис. 6). Этот случай имеет место при электроосаждении серебра, меди, свинца и неко - - торых других электроположительных металлов, потенциалы выделения которых значительно отличаются от потенциала выделения водорода. Выход по току при осаждении указанных металлов достигает 100%, т. е. электролиз протекает без выделения водорода;
Потенциал выделения водорода более положителен при всех значениях плотности тока, чем потенциал, при котором происходит выделение металла (рис. 7). Данный случай противоположен предыдущему и характерен для электроотрицательных металлов (магний, алюминий и др.), осаждение которых из водных растворов невозможно, так как в указанных условиях выделяется только водород;
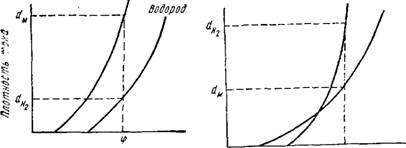
Потенциал металла остается более положительным, чем потенциал выделения водорода при сравнительно малых значениях плотностей тока, но, начиная с некоторого значения плотности тока, катодный потенциал становится отрицательнее потенциала выделения водорода. В этом случае при тех плотностях тока, при которых катодный потенциал не достигает потенциала выделения водорода, выделяется только металл. Прн тех же плотностях тока,
При которых катодный потенциал более отрицателен, чем потенциал выделения водорода, выделяются совместно металл и водород в количествах, пропорциональных плотностям тока dM и dHa (рис. 8);
Потенциал металла, иачииая с некоторых значений плотности тока, становится более отрицательным, чем потенциал водорода {рис. 9).
В точке пересечения поляризационных кривых металл и водород выделяются в эквивалентных количествах. При меньших плотностях тока преобладает металл, а при больших — водород.
|
Металл |
|
Водород |
|
Металл |
|
Катодньш потенциал |
|
Катодный потенциал |
|
Рис. 9. Зависимость катодных потенциалов нонов металла н водорода от плотности тока прн преимущественном выделении водорода |
|
Рис. 8. Зависимость катодных потенциалов ионов металла н водорода от плотности тока прн преимущественном выделении металла |
В заключение надо отметить, что. приведенные в данном параграфе рассуждения в равной мере относятся и к одновременному (совместному) выделению двух металлов, не образующих между собой твердого раствора или химического соединения.
В том случае когда осаждающиеся совместно металлы образуют твердый раствор, потенциал выделения иоиов обоих металлов может оказаться менее отрицательным, чем потенциал более отрицательного металла. При этом преимущественно выделяется более положительный металл, ио с увеличением плотности тока катодный потенциал становится все более отрицательным и в осадке увеличивается относительное количество более отрицательного металла. Так, например, из растворов, содержащих циик и никель, одновременное осаждение этих металлов происходит вследствие образования сплава этих двух металлов.