ПРОИЗВОДСТВО ЭЛЕКТРИЧЕСКИХ АККУМУЛЯТОРОВ
ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ. РЯД НАПРЯЖЕНИЙ
Если погрузить какой-либо металл в раствор, содержащий соль этого металла, то происходит самопроизвольный переход ионов металла в раствор или из раствора на поверхность металла.
Направление этого перехода определяется соотношением энергии ионов металлов в кристаллической решетке металла и в растворе. Ионы переходят из той фазы, где они обладают большим запасом энергии. Последний зависит от природы металла, природы и состава раствора и, в частности, от концентрации соли металла в растворе.
В результате этого перехода поверхность металла оказывается заряженной относительно раствора. Знак заряда будет положительным, если имеет место переход ионов металла из раствора, и отрицательным, если преобладает переход ионов металла в обратном направлении. В первом случае поверхность металла будет содержать некоторое избыточное количество положительно заряженных ионов металла, а во втором — избыток электронов.
В обоих случаях на поверхности раздела металла с раствором электролита возникает скачок потенциала, т. е. потенциал металла относительно раствора.
Потенциал металла, устанавливающийся на его поверхности при погружении в раствор соли того же металла, называется равновесным потенциалом (<рр). Значение <рР зависит от концентрации ионов металла в растворе cMz+. Эта зависимость приближенно выражается, уравнением
C?P=?o + - j1g См+, " (26)
Где фо—стандартный потенциал данного металла, равный равновесному потенциалу при CMZ+=1; z — валентность металла; 0 — константа, зависящая от температуры и равная 0,058 при / = 25° С.
Уравнение (26) выполняется наиболее точно в случае разбавленных растворов, когда величина CMZ+ мала. В более крепких растворах величина концентрации CMZ+ должна быть заменена активностью — сложной функцией концентрации, значение которой может быть найдено в специальных справочниках.
Некоторые окислы (РЬ02, МпОг и др.) могут, подобно металлам, служить электродным материалом. Причиной возникновения разности потенциалов на границе раздела окисел — раствор также является переход ионов из твердой фазы в жидкую либо в обратном направлении. Однако в данном случае в отличие от металлических электродов в переходе могут наряду с ионами металла участвовать также ионы водорода и гидроксила. Равновесное значение потенциала устанавливается, когда окисный электрод и электролит находятся в равновесии в отношении всех видов ионов, участвующих в электродной реакции.
Измерение потенциалов может быть проведено относительно электродов, потенциал которых (ф) известен. Такие электроды называются электродами сравнения. Для измерений составляется цепь из электрода с неизвестным потенциалом (фж) и электрода сравнения. Такая цепь называется гальванической ячейкой, или гальваническим элементом. Электродвижущая сила гальванической ячейки (Е) определяется уравнением
Откуда
?, = £ + ?.
Измерив значение Е и зная ф, можно рассчитать потенциал исследуемого электрода (ф*). В качестве электрода сравнения может быть использован водородный электрод, потенциал которого условно принят равным нулю.
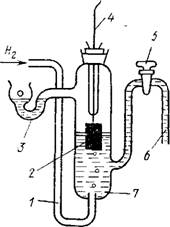
Одна из конструкций водородного электрода показана на рис. 1. Сосуд наполняют 1,8 н раствором серной кислоты. В раствор погружают платиновую пластинку, предварительно покрытую губчатой платиной (так называемой платиновой чернью). Платина омывается пузырьками водорода, непрерывно поступающими в сосуд под избыточным давлением «100 кПа. В табл. 3 приведены значения стандартных потенциалов металлов, используемых в химических источниках тока, измеренных относительно водородного электрода, а также соответствующие окислительно-восстановительн ы е реакции. Последовательность значений стандартных потенциалов носит название ряда напряжений.
|
|
|
Стандартный |
|
Рис. 1. Водородный электрод: |
|
1 — трубка для подачи водорода, 2 — платиновый электрод, 3 — трубка для отвода водорода, 4 — внешний провод, 5 — кран. 6 — сифон; 7 — раствор, содержащий ионы водорода |
Необходимо отметить, что если потенциал металла в растворе равен равновесному значению, определяемому формулой (26), то на поверхности раздела метал1 ла с раствором наблюдается равновесие между ионами металла в растворе и в кристаллической решетке металла. Если сместить потенциал от равновесного значения в положительную сторону, то начинается растворение (окисление) электрода. При изменении же потенциала в отрицательную сторону происходит выделение металла из раствора вследствие разряда (восстановления) ионов металла.
|
Таблица 3 Ряд напряжений
|
Естественно, что чем менее отрицательное или более положительное значение имеет стандартный потенциал данного электрода, тем легче осуществить разряд ионов этого металла и выделение их из раствора.
Рассмотрим электролиз раствора, содержащего ионы серебра и меди с анодами из серебра и меди.
В процессе электролиза на катоде в первую очередь будут разряжаться наиболее электроположительные ионы, т. е. в данном случае ионы серебра. Ионы же меди начнут выделяться на катоде только после удаления из раствора всех ионов серебра.
. На аноде, наоборот, в первую очередь растворится медь, так как ее потенциал (+0,34 В) менее положителен, чем потенциал серебра ( + 0,80 В).
Подбором ряда условий, затрудняющих выделение водорода, удается выделить из водных растворов также металлы, нормальный потенциал которых гораздо отрицательнее водорода (никель, цинк, железо).
Однако ионы алюминия (—1,7 В) или магния (—1,87 В) ни при каких условиях не могут разряжаться из водных растворов.