Процессы и аппараты упаковочного производства
РАВНОВЕСИЕ ПРИ АБСОРБЦИИ
При взаимодействии какого-либо газа с жидкостью возникает система, состоящая как минимум из трех компонентов (распределяемое вещество и два распределяющих вещества или носителя) и двух фаз - жидкой и газовой. Такая система по правилу фаз имеет три степени свободы (С = К — Ф + 2 = 3 — 2 + 2 = 3).
Для данного случая массообмена переменными являются температура, давление и концентрации компонента А В газовой и жидкой фазах. Следовательно, в состоянии равновесия при условии постоянства температуры и общего давления зависимость межд концентрациями распределяемого в газовой и жидкой фазах компонента (или парциальным давлением газа и составом жидкости) будет однозначной. Эта зависимость выражается Законом Генри: Парциальное давление растворенного газа пропорционально его моляр-
Ной доле в растворе:
![]() , (16.1)
, (16.1)
Или Растворимость газа (поглощаемого компонента А ) В жидкости при данной температуре пропорциональна его парциальному давлению над жидкостью:
Где Е - Коэффициент пропорциональности, называемый Коэффициентом, Или Константой Генри; ![]() Парциальное давление поглощаемого газа, находящегося в ран новесии с раствором, имеющим концентрацию Ха (в мол. долях);
Парциальное давление поглощаемого газа, находящегося в ран новесии с раствором, имеющим концентрацию Ха (в мол. долях); ![]() -концентрация газа в растворе (в мол. долях), равновесная с газовой фазой, в которой парциальж-давление поглощаемого компонента равно
-концентрация газа в растворе (в мол. долях), равновесная с газовой фазой, в которой парциальж-давление поглощаемого компонента равно ![]() .
.
Чем выше растворимость газа в абсорбенте, тем меньше расход этого абсорбента. Поэтому при выборе абсорбента растворимость в нем поглощаемого газа рассматривается как важнейшее свойство данного абсорбента (наряду со стоимостью, доступностью, токсичностью, пожаро - и взрывоопасностью и т. п.)
Величина Е для данного газа не зависит от общего давления в системе, но зависит от природы абсорбента и поглощаемого газа и от температуры.
Зависимость константы Генри от температуры выражается следующим уравнением:
![]() , (16.2)
, (16.2)
Где q-дифференциальная теплота растворения газа;с-постоянная, зависящая от природы газа и абсорбента.
|
|
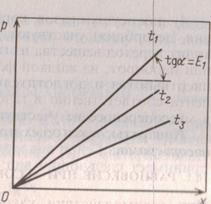
Рис. 16-1. Растворимость газа в жидкости при различных температурах ![]() и соответственно
и соответственно ![]()
В идеальных растворах силы
взаимодействия между молекулами
каждого из компонентов раствора,
а также молекулами различных
компонентов равны между собой.
Поэтому улетучивание того или
иного компонента из жидкой фазы
в газовую не зависит от присутствия
в растворе других компонентов и определяется содержанием в
растворе данного компонента. i
Для идеальных растворов на диаграмме P-X (рис. 16-1) зависимость равновесных концентраций от давления изображается прямой с наклоном, равным Е. С повышением температуры значение ' увеличивается и соответственно уменьшается растворимость газа в жидкости [см. уравнение (16.1 а)].
При общем давлении Р В системе и концентрации ![]() (мол. доли) извлекаемого компонента А В газовой cмеси парциальное давление этого компонента по закону Дальтона
(мол. доли) извлекаемого компонента А В газовой cмеси парциальное давление этого компонента по закону Дальтона
![]() (16.3)
(16.3)
С учетом уравнения (16.1) получим
![]() , (16.4)
, (16.4)
Тогда закон Генри можно выразить следующим образом:
![]() , (16.5)
, (16.5)
Где ![]() -Коэффициент распределения или константа фазового равновесия.
-Коэффициент распределения или константа фазового равновесия.
Из уравнения (16.5) следует, что зависимость между концентра -
Миями данного компонента в газовой смеси и в равновесной с ней
Жидкости выражается прямой линией (линия равновесия), прохо -
Дящей через начало координат и имеющей угол наклона ![]() тангенс которого равен m. Значения величины m уменьшаются при снижении температуры и увеличении давления в системе. Поэтому растворимость газа в жидкости увеличивается с повышением давления и снижением температуры.
тангенс которого равен m. Значения величины m уменьшаются при снижении температуры и увеличении давления в системе. Поэтому растворимость газа в жидкости увеличивается с повышением давления и снижением температуры.
Если в равновесии находится смесь газов, то закону Генри может следовать каждый из компонентов этой смеси в отдель-ности.
Как уже отмечалось, закон Генри справедлив для идеальных растворов, поэтому он применим лишь к сильноразбавленным растворам. При повышенных давлениях(порядка нескольких мегапаскалей и выше) изменение объёма жидкости вследствие растворения в ней газа соизмеримо с изменением объёма газа, и равно
Весне в этом случае не следует закону Генри. При этих условиях константу фазового равновесия можно определить так (см. гл. 2):
![]() , (16.6);
, (16.6);
где /0 фугитивность (летучесть) поглощаемого газа, выраженная в единицах давления.
Расчет величины ![]() приводится в специальной литературе.
приводится в специальной литературе.
При выражении состава фаз в относительных концентрациях запись закона Генри видоизменяется. В этом случае уравнение (16.5) принимает следующий вид:
|
Илиили Или |
![]() (16.7)
(16.7)
Т. е. равновесие в системе газ-жидкость при выражении состава фаз в относительных концентрациях изображается кривой линией. Для сильноразбавленных растворов, т. е. при низких концентрациях газа в жидкости, можно принять ![]() . При этом в уравнении (16.7) знаменатель обращается в единицу, и оно принимает вид
. При этом в уравнении (16.7) знаменатель обращается в единицу, и оно принимает вид
![]() , (16.8)
, (16.8)
Т. е. при низких концентрациях закон Генри изображается прямойлинией.
Для хорошо растворимых газов, при больших концентрациях их в растворе, растворимость меньше, чем следует из закона Генри. Для систем, не подчиняющихся этому закону, коэффициент Т В уравнениях (16.5) и (16.7) является переменной величиной, линия равновесия представляет собой кривую, которую обычно строят по
Опытным данным.
При абсорбции многокомпонентных смесей равновесные зависимости существенно сложнее, чем при абсорбции одного компонента, особенно тогда, когда раствор сильно отличается от идеального. В этом случае парциальное давление каждого компонента в газовой смеси зависит не только от его концентрации в растворе, но также и от концентрации в растворе остальных компонентов, т. е. является функцией большого числа переменных. Поэтому обычно в таких случаях равновесные зависимости основываются на опытных данных.
Если раствор является идеальным и только в газовой фазе наблюдается отклонение от идеального состояния, то в этом случае компоненты раствора не воздействуют друг на друга. Поэтому концентрация данного компонента в газовой фазе зависит только от концентрации его в жидкости (при постоянных температуре и давлении).Тогда к каждому компоненту i можно применить уравнение (16.5):
![]() ,(16.9)
,(16.9)
В котором константа фазового равновесия m зависит от температуры и общего давления в системе.
Следовательно, при постоянной температуре равновесие данного компонента i в разбавленном растворе на диаграмме Y-X Представляется прямой линией с наклоном, тангенс которого равен ![]() .
.