РОСТ ЦЕПИ
Рост цепи заключается в быстром последовательном присоединении молекул зтилена к радикалу:
R - + СН2=СНг RCHz—СН2 , RCHz—СН2 + СН2=СНг RC Н2—СН2—СН2 —СНг,
R(CH2)„—£Пг + СН2=СНг R(CH2)„+2—6нг.
Скорость этой стадии выражается уравнением
Vp------- = (4.23)
Где [R-] и [М] - концентрации радикалов и мономера.
Следует отметить, что скорость роста практически совпадает с общей скоростью полимеризации, так как количество образовавшегося полимера равно количеству израсходованного мономера.
Влияние температуры и давления на константу роста явилось предметом многочисленных исследований [37, с. 251; 38].
Если значения энергии активации реакции роста цепи Ер, полученные разными авторами в различных условиях, близки между собой и составляют 25-33 кДж/моль (эти значения хорошо согласуются с данными о взаимодействии этилена с алифатическими радикалами, для которого Е= 23-36 кДж/моль) [37, с. 252], то значения объемов активации AV* (табл. 4.2) существенно различаются. Эти различия обычно связывали с большой сложностью измерений при высоком давлении. Однако приведенные в табл. 4.2 данные четко указывают на уменьшение значений Л УФ с ростом давления
В работах [45, 46] сделана попытка объяснить наблюдаемую зависимость, а также ряд других особенностей полимеризации этилена при высоких давлениях особенностями поведения этого мономера в надкритических условиях. Гипотеза основывается на известном факте, что плотность этилена при высоком давлении выше таковой для плотно упакованных индивидуальных молекул. При повышении давления в этилене возникают различные надмолекулярные образования — молекулярные пары, бимолекулы и олигомолекулы, удельный объем которых меньше удельного объема этилена при плотной упаковке его молекул. Так, объем молекулярной пары (в пересчете на одну молекулу этилена) составляет 127,6 см3/моль, объем бимолекулы 57,1 см3/моль, объем олигомолекулы 37,8 см3/моль. Эти частицы в зависимости от давления и температуры могут находиться в равновесии друг с другом. На рис. 4.5 показаны полученные расчетным путем области существования вышеупомянутых
|
Таблица 4.2. Объемы активации реакции роста цепь при полимеризации этилена
* Приведены значения объема активации суммарной реакции, которые близки к AV$. ** Рассчитано по экспериментальным данным указанных источников. |
Рис. 4.5. Фазовое состояние этилена ргМГ1а в надкритической области:
А — равновесие индивидуальные молекулы — молекулярные пары; (3 — равновесие молекулярные пары — бимолекулы; у — равновесие бимо - лекулы — олигомолекулы; I — область рабочих параметров автоклавных реакторов; II — область рабочих параметров трубчатых реакторов
Частиц. В области а существуют индивидуальные молекулы и молекулярные пары, причем, чем ближе к границе перехода, которой является критическая изохо - ра FKp, тем больше концентрация молекулярных пар. При переходе границы индивидуальные молекулы из смеси исчезают и в области (3 появляются бимолекулы, концентрация которых возрастает по мере приближения к границе следующего перехода - критической изоэнтропе SKр, выше которой в области 7 сосуществуют бимолекулы и олигомолекулы. Описанные переходы являются фазовыми переходами второго рода, их реальное существование подтверждается характером экспериментально установленных зависимостей некоторых физических свойств зтилена, например, отношения теплоемкости к температуре, произведения pV, вязкости и др., от давления.
На основании изложенной гипотезы значительные различия в объемах активации полимеризации, проводимой в различных условиях, объясняются следующим образом.
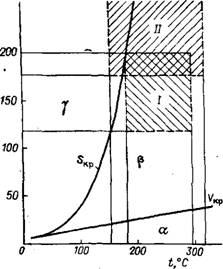
В реакции роста участвуют только бимолекулы или олигомолекулы, которые присоединяются к радикалу сразу целиком. Когда полимеризация проводится при параметрах, соответствующих /3-фазе с малой концентрацией бимолекул, определяющей стадией становится переход молекулярных пар в бимолекулы (вследствие сохранения равновесной концентрации) по мере вхождения бимолекул в образующийся полимер. Изменение молярного объема при этом (127,6 см3/моль — 57,1 см3/моль = 70,5 см3/моль) близко к экспериментально определяемым объемам активации. При параметрах, соответствующих высокой концентрации биіуіолекул, или в области 7-фазы (при низкой концентрации олигомолекул) разности молярных объемов бимолекул и олигомо - лекул (~ 19 см3/моль) или бимолекул и полимера (~27 см3/моль) также близки к объемам активации полимеризации, определенным
экспериментально. И, наконец, при очень высоких давлениях объем активации процесса полимеризации становится совсем небольшим, что приблизительно отвечает разности молярных объемов полимера и олигомолекул — 3-г—6 см3/моль. Как показано на рис. 4.5, при используемых в промышленности температурах и давлениях этилен находится в 0-фазе с высокой концентрацией бимолекул или в 7-фазе вблизи границы Р — 7-перехода. Поэтому наиболее приемлемым следует считать значение объема активации AV^^AVобщ = 20-і-25 см3/моль.