Стойкость к термической и термоокислительной деструкции
Сложные эфиры карбоновых кислот и гидроксилсодержащих соединений (спиртов, гликолей и пр.) при обычных условиях довольно устойчивы к воздействию кислорода воздуха. Однако при повышенных температурах вследствие протекания термоокислительных и деструктивных процессов их первоначальные физико - химические показатели могут изменяться.
Исследование поведения сложных эфиров при воздействии температуры и кислорода было предпринято в связи с их применением в качестве пластификаторов и высокотемпературных смазок [51—57]. Изучение термостойкости сложных эфиров синтетических жирных кислот и пентаэритрита при 160—300 °С без доступа воздуха с помощью масс-спектроскопии показало, что эти эфиры не изменяют своих свойств до 260 °С [54].
Сложные эфиры полиолов характеризуются повышенной термостойкостью по сравнению с диэфирами, имеющими в молекуле алкильные радикалы [51].
|
2 |
Термическое разложение сложных эфиров алифатических и ароматических дикарбоновых кислот и спиртов было подробно исследовано Зильберманом и др. [52, 53] и Федяниным [57]. . Федянин [57] изучал ряд диэтиловых эфиров дикарбоновых кислот от янтарной до 1,10-декандикарбоновой кислоты, а также адипиновой кислоты с нормальными и замещенными в а-, Р-, у - положении спиртами от С2 до С5. Термостойкость полных эфиров определялась скоростью образования олефина по реакции, протекающей в две стадии:
С2Н5ООС(СН2)4СООС2Н5 ------- S - НООС(СН2)4СООС2Н5 + сн2=сн,
НООС(СН2)4СООС2Н5 >■ НОО(СН2)4СООН + сн2=сн2
Механизм элиминирования олефина при жидкофазном термическом разложении эфиров дикарбоновых кислот включает образование полярного переходного состояния, степень разделения зарядов в котором зависит от структуры эфира, в первую очередь, от ближайшего окружения алкоксисвязи.
|
|
Шестичленный переходный комплекс, через который протекает ц«с-элиминирование, по мнению автора [57] имеет следующее строение:
О-'-Н
|
|
Отрицательное значение энтропии активации процесса позволяет предположить «жесткое» строение активированного комплекса, который может распадаться по согласованному р-азрыву С—О-
|
7* |
99-
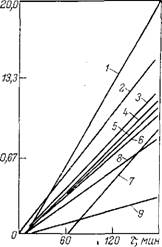
Таблица 3.18. Термостойкость эфиров дикарбоновых кислот [57]
Эфир
Диэтилсукцинат
Диэтилглутарат
Диэтиладипинат
Дипропиладипинат
Ди-к-бутиладипинат
Ди-к-амиладипинат
Диэтилазелаинат
Диэтилсебацинат
Диэтиловый эфир 1,10-декандикарбоновой кислоты
|
Констаиты скорости элиминирования олефииа при температуре ■ К-102, ч-1
|
Связи и С—Н-связи [57]. Однако помимо активированного комплекса ограничение вращательной степени свободы молекулы может быть следствием наличия ионной пары:
Из ряда диэтиловых эфиров алифатических дикарбоновых кислот наименьшую термостойкость имеет эфир янтарной кислоты (сук- цинат), наибольшую — эфир адипиновой кислоты (табл. 3.18). Однако по степени декарбоксилирования дикарбоновых кислот, образовавшихся после элиминирования олефина на второй стадии, адипиновая кислота менее устойчива, вероятно, ввиду легкости внутримолекулярной циклизации в циклопентанон:
|
Чс=о + н2о |
|
Со2 + |
НООС(СН2)4СООН
Зильберман и Салтанова [58] установили, что в ряду сложных эфиров моно - и дикарбоновых кислот нормального строения термостойкость повышается с увеличением длины цепи кислотного и спиртового остатков. Так, для эфиров адипиновой кислоты константа скорости элиминирования первого порядка, рассчитанная по кислоте, уменьшается в следующем ряду (ч-1):
Изо-С3Н7 изо-С4Н9 изо-С5Нп изо-С8Н17 < изо-С8Н19 0,16 0,16 0,14 0,11 0,10
С2Н5 < н-С3Н7 < н-С4Н9 < к-С5Ни < к-СвН13 < н-С7Н15 < 0,16 0,15 0,15 0,13 0,10 0,08 < "-С8Н17 < н-С9Н1э < к-С10Н21 < к-С13Н27 0,07 0,06 0,05 0,04
Термостойкость эфиров со спиртовыми радикалами изострое - ния ниже, чем эфиров со спиртовыми радикалами нормального строения одинаковой молекулярной массы. Менее термостойкими являются и адипинаты вторичных спиртов. Отсутствие (5-водород- ных атомов в алкильной части адипината способствует увеличению термостабильности пластификатора [57, 58].
Термостойкость сложных эфиров дикарбоновых кислот с увеличением длины цепи кислотного остатка возрастает. Константа скорости реакции первого порядка по кислоте изменяется в следующем ряду (ч-1):
С3Н202 > С4Н402 > СвН802 > С9Н1402 > С10Н1вО2 > С12Н20О2 0,15 0,12 0,10 0,08 0,07 0,07
Малоновая янтарная адипиновая азелаииовая себацииовая деканди-
Карбоновая
Зильберман и др. [52] изучали механизм термодеструкции практически чистых сложноэфирных пластификаторов и пластификаторов со следами кислотности, вдаги, примесями поливинил - хлорида. Установлено, что интенсивность запаха пластификатора прямо пропорциональна его кислотности до нагревания.
Пластификаторы с кислотными числами до 0,1 мг КОН/г вещества не изменялись при нагревании до 200 °С. Лишь при выдержке ди (2-этилгексил)-о-фталата и ди (2-этилгексил) себацина - та при температурах их кипения (300°С и выше) при атмосферном давлении происходило разложение пластификаторов. Так, ди (2-этилгексил)-о-фталат разлагается до фталевого ангидрида, 3-метиленгептана, З-метилгептена-2, З-метилгептена-З, 2-этилгек - санола и воды. Это подтверждает механизм {5-^.ыс-элиминирова - ния сложных эфиров фталевой кислоты:
TOC \o "1-3" \h \z ^COOR ^СООН
СвН4 ------------- СвН4 + С„Н2„ (1)
\cOOR \cOOR
УСООЯ, соон
Свн4 --------------- СвН4 + С„Н2Г1 + Н20 (2)
\соон \соон
YCOOR J1®
С6н4 ------------- * CeH4 )0 + R0H (3)
\соон \/
При деструкции ди (2-этилгексил) себацината образуются себа - циновая кислота и 3-метиленгептан с примесью продуктов его изомеризации, что позволяет предположить механизм распада, подобный распаду эфиров фталевой кислоты, но без образования ангидрида.
В присутствии искусственно введенной серной кислоты или ПВХ также происходит термический распад пластификаторов с.
Образованием 3-метиленгептана и его изомеров, а также себацино - вой кислоты. 2-Этилгексиловый спирт при разложении не найден, что может свидетельствовать о протекании распада без образования ангидрида:
,СООС8Н17 уСООН
При термическом разложении ди (2-этилгексил)-о-фталата, вероятно, образуется не кислота, а фталевый ангидрид, не катализирующий р-цис-элиминирование.
Механизм терморазложения сложных эфиров при катализе протонными кислотами состоит в синхронном электронном переносе, протекающем в циклическом переходном состоянии с восемью или шестью центрами (НВ — кислота):
О н—в О-н в—н
О—с^-сС °
-С-Оч/С< —
Термический распад пластификаторов ускоряется под влиянием влаги, например в ди (2-этилгексил) фталате [52]:
Содержание влаги, %
До нагревания............................... 0,047 0,069 0,090
После нагревания в течение 35 ч
При 200 °С....................................... 0,056 0,083 0,126
При 320 °С, . . . . 0,068 0,116 0,184
Следовательно, присутствие до 0,05% влаги в сложноэфирном пластификаторе практически не влияет на его термодеструкцию.
Термическая деструкция сложноэфирных пластификаторов может быть значительно уменьшена применением стабилизаторов ■[53]. Данные о кинетике терморазложения ди (2-этилгексил) - и дибутилсебацинатов, а также ди (2-этилгексил)-о-фталата, полученные путем прогрева пластификатора со стабилизаторами при 180+1 °С в предварительно вакуумированной ампуле, показывают, что наиболее эффективными являются стабилизаторы фенольного типа (ионол и я, л-дифенол). Изменение концентрации стабилизатора в интервале 0,015—0,10% существенно не меняет их стабилизирующего действия. «-Нитрофенол и. м-аминофенол слабо стабилизируют терморазложение ди (2-этилгексил) себацината. 2,4-Дигидроксибензофенон и 2-гидрокси-4-метоксибензофенон, будучи кислыми соединениями, даже катализируют разложение сложных эфиров, ускоряя реакцию элиминирования. Подобное действие на сложные эфиры оказывают и ароматические амины (дифениламин, а-нафтиламин).
Путем исследования спектров ЭПР ди (2-этилгексил) себацина - та в присутствии стабилизатора фенольного типа установлено, что терморазложение сложноэфирных пластификаторов происходит по свободнорадикальному механизму.
Значительное уменьшение кислотности и запаха, например ди (2-этилгексил) себацината, установлено в присутствии алифатических и ароматических эпоксисоединений. При совместном использовании полиалкилзамещенных фенолов и эпоксидных соединений в качестве стабилизаторов термического разложения сложноэфирных пластификаторов наблюдается синергический эффект, проявляющийся в подавлении разложения по свободнорадикальному механизму и ионному механизму путем связывания образующегося при разложении ПВХ хлористого водорода эпоксидной группой.
На основании изучения кинетических закономерностей термического разложения, а также определения механизма этого процесса для сложных эфиров алифатических моно - и дикарбоновых кислот и спиртов или гликолей, ароматических дикарбоновых кислот и спиртов установлено, что до 200 °С разложение сложных эфиров незначительно [51—53, 57].
Разрушение пластификаторов при нагревании вызывается главным образом окислением.
При изучении термоокислительной деструкции эфиров арилмо - нокарбоновых кислот (арилстеариновой при 300 °С и 7,7-диарил - масляных при 200 °С) установлено, например, что введение ариль - ного заместителя в молекулу стеариновой кислоты увеличивает стойкость эфиров к термоокислительной деструкции по сравнению с аналогичными эфирами алкилстеариновой кислоты. - Из эфиров 7,7-дифенилмасляной кислоты более термостабильными являются эфиры, содержащие в спиртовой части молекулы неразветвлен - ные алкильные радикалы от С4 до С9. Наибольшую стабильность по отношению к окислению проявляют эфиры с более длинным алкильным радикалом [55]. Это связано с экранирующим действием спиртового радикала, который защищает кислотную часть молекулы от воздействия кислорода, предотвращая декарбоксили - рование [55].
Термоокислительная деструкция промышленных сложноэфирных пластификаторов [59, 60] исследовалась с помощью метода Неймана [61] по изменению скорости окисления в области автокатализа при 180 °С в монометрической системе и статических условиях при давлении кислорода около 40 кПа.
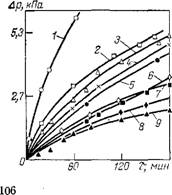
Из эфиров алифатических дикарбоновых кислот С6—Сю и спиртов наименьшую скорость окисления имеет ди-2-этилгексилсе - бацинат (рис. 3.9).
Рис. 3.9. Кинетика поглощения кислорода различными пластификаторами (без стабилизаторов):
1 — ди(2-этилгексил)адипинат; 2 — ди-2-этилгексиловый; эфир дикарбоновых кислот (С5—Сщ); 3 — дналкил-о-фта - лат (Сб—С8); 4 — диалкил-о-фталат (Сг—С9); 5 — дикап - рил-о-фталат; 6 — ди (2-этилгексил)-о-фталат; ди(2,4-ди - этил-н-октил)-о-фталат;- 7 — ди(2-этилгексил)себацииат; 8 — тетра (2-этилгексил) пиромеллитат; 9 — три(2-этилгек,- сил)тримеллитат.
Введение ароматического радикала в молекулу сложного эфира увеличивает его термоокислительную стабильность. При наличии в эфире ароматических дикарбоновых' кислот одинаковых алкиль - ных радикалов тримеллитаты обладают большей стабильностью, чем фталать; и пиромеллитаты. Влияние длины алкильного радикала в молекуле эфиров ароматических дикарбоновых кислот проявляется также, как и в случае эфиров алифатических кислот: с увеличени ем длины алкильного радикала термостойкость эфиров возрастает.
Для предотвращения термоокислительной деструкции пластификаторов при высокотемпературной переработке полимеров к эксплуатации изделий необходимо применять ингибиторы окисления. Большинство антиокислителей, применяемых для интиби - рования процессов окисления в полимерах можно использовать и для сложных эфиров [53, 62]. К таким антиокислителям относятся фенолы, ароматические амины, фосфиты и др. Сравнение эффективности ингибирования соединений различных классов по отношению к пластификаторам сложиоэфирного типа показало высокую активность амидов, имидов, ароматических аминов, бисфе - нолов, фенолов различного строения [63, 64]. Например, введение в сложные эфиры от 6,01 до 1% формамида, бензамида, ацетами - да, сукцинимида, ацетанилида устраняет вредное действие следов соединений серы, попадающей в систему в процессе {63] синтеза. Особенно эффективны первичные амины. Свойства полимеров с такими стабилизированными пластификаторами не ухудшаются [63].
При этерификации дикарбоновых кислот спиртами в присутствии катализатора (серной кислоты) одновременно с ним в качестве антиоксидант'ов могут использоваться соединения типа 2,4-ди - метил-6-грег-бутилфенола или 2,5-ди-грег-бутилгидрохинона [64].
|
Лр, к Па |
|
|
Ароматические амины обладают сильным ингибирующим действием, но ухудшают цвет сложноэфирных пластификаторов [59, 65], поэтому применение их для предотвращения термоокислительной деструкции нежелательно. В качестве ингибиторов термоокисления сложных эфиров карбоновых кислот и спиртов рекомендуются дифенилолпропан (бисфенол А), 2,2-метилен-бис(6-
грег-бутил-4-метил) фенол (ингибитор 2246), вводимые в количестве 0,1% от массы пластификатора. Эффективно также использование фосфитов (например, трис(нонилфенил) фосфита), полифосфитов, способствующих сохранению требуемых физико-механических свойств пластифицированного полимера.
При применении пластификатора очень важное значение имеет сохранение его цвета в процессе переработки пластифицированного полимера и при эксплуатации готового изделия. В этой связи большое влияние на цвет пластифйкатора оказывает технология его получения. Особенно это относится к способу очистки сложного эфира от примесей катализатора этерификации (серной кислоты, арилсульфокислот, алкилатов металлов) и продуктов его этерификации. Так, при взаимодействии арилсульфокислот со спиртами образуются термостойкие диалкилсульфаты, разлагающиеся с образованием радикала сильной кислоты, которая вызывает ос- моление органических соединений. Смолообразные продукты способствуют изменению первоначального цвета пластификаторов. Для сохранения цвета пластификатор-сырец осветляют различными способами [59, 65—76]. Так, эфир-сырец обрабатывают озоном при 10—100 °С с последующим восстановлением (водородом в присутствии никеля Ренея, сульфитами щелочных металлов и пр.) и дополнительной промывкой водными растворами гидрооксидов щелочных металлов [65, 68]. Сообщается об осветлении сложного эфира воздухом или кислородом [66]. Чаще всего эфир - сырец подвергают действию сухой кальцинированной соды [68, 69] или ее 10%-ным водным раствором [70], 0,1—5%-ным вод - . ным раствором гидроксида, карбоната или бикарбоната, аммония, •натрия, калия [71]. Применяется также обработка сложного эфира оксидами, гидрооксидами щелочно-земельных металлов [72], активированным оксидом алюминия или оксидом алюминия с примесью оксида кремния [73]. Готовый пластификатор дополнительно обрабатывают сорбентами в индивидуальном виде или в виде смеси с оксидами натрия, магния, алюминия, кремния, железа, взятыми в количестве до 10% от массы эфира в токе инертного газа при 100—150 °С в течение 0,1—3 ч [74]. Для тех же целей может применяться щелочной активированный уголь [75] или ионообменные смолы [76].
Сложноэфирные пластификаторы, которые получают в отсутствие серусодержащих катализаторов этерификации, обладают лучшим цветом и более стабильной окраской во времени и при термообработке [59, 77—79]. Однако применение одного из указанных выше способов улучшения цвета эфиров карбоновых кислот и спиртов позволяет получить пластификатор с цветностью 20—80 единиц Хазена по платино-кобальтовой шкале при использовании катализатора этерификации серной кислоты или арилсульфокислот.
Стойкость полиэфирных пластификаторов к термоокислительной деструкции зависит в основном от химического состава „ди-
карбоновой кислоты и гликоля и в меньшей степени от модифицирующего компонента — спирта или монокарбоновой кислоты.
При исследовании стойкости к термоокислительной деструкции полиэфирных пластификаторов общей формулы C4H9OOC(CH2)4CO[OR'OOC(CH2)4CO]OC4H9
Где R'— остаток гликоля. Установлено [80], что увеличение числа метиленовых групп в гликоле приводит к снижению стойкости полиэфирного пластификатора. Полиэфирные пластификаторы на основе гомологического ряда гликолей отличаются друг от друга' содержанием атомов водорода, по которым, может происходить инициирование и развитие цепного процесса окисления:
RH + 02- ».R.+HO2.
R.+02 ------ ► RO2.
R02+RH ------- ►ROOH + R.
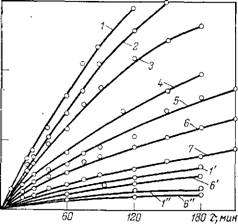
Из данных о кинетике термоокисления полиэфирных пластификаторов (ри. с. 3.10) следует, что полиэфиры на основе оксиал - киленгликолей наиболее подвержены окислению. Это, по-видимо - му, связано с подвижностью атома водорода а-метиленовой группы,' соседней с кислородом простой эфирной связи. Уменьшение термостойкости полиэфирных пластификаторов на основе оксиал - киленгликолей (диэтилен-, триэтилен - и полиэтиленгликолей) может быть связано с увеличением числа простых эфирных связей (и, следовательно, а-метиленовых атомов водорода).
Высокую стойкость к термоокислительной деструкции проявляют полиэфирные пластификаторы на основе изогликолей: 1,2- пропиленгликоля, 1,3-бутандиола, 2,2-диметил - 1,3-пропандиола (рис. 3.10).
Полиэфирные пластификаторы на основе гомологического ряда дикарбоновых кислот общей формулы
С4Н9ООС(СН2)4СОО[(ОСН2СН2)2ООС(СН2)пСО]3ОС4Н9
|
|
Где п= 1, 2, 3 и 10 ведут себя аналогично полиэфирным пластификаторам на основе гомологического ряда алкиленгликолей: по мере увеличения числа метиленовых групп в дикарбоновой кислоте количество поглощенного кислорода возрастает (рис. 3.11). При повышенных температурах (170—200 °С) термо-
Рис. 3.10. Кинетика поглощения кислорода при окислении полиэфирных пластификаторов различного строения (Г=200 °С, Ро2 =26,7 кПа):
1 — полиэтиленгликоль с молекулярной массой 400;
2 — триэтиленгликоль; 3 — гександиол-1.6; 4 — диэти - ленгликоль; 5 — пентандиол-1,5; 6 — этилеигликоль; | 7—бутандиол-1.3; 8— 2,2-диметилпропандиол-1,3; 9 ->—
Пропандиол-1,2.
Рис. 3.11. Кинетика поглощения 3D кислорода при термоокислении полиэфирных пластификаторов яа основе декандикарбоновой (1, Г, 1"). себациновой (2), ^ азелаиновой (3), адипиновой ^ (4), глутаровой (5), янтарной О 20 (6, 6', 6") и малоновой (7) кис - S лот при 200° (1-6), 150° {Г, 6') и 130 °С (/", 6"). |
CU
£Г
СЗ
5 10
О
Стойкость уменьшается {81]. При более низких температурах (130—150°С) различие в термостойкости не столь существенно (рис. 3.11).
Такая же зависимость термостойкости полиэфирных пластификаторов от числа метиленовых групп в дикарбоновых кислотах наблюдается и для ряда их дибутиловых эфиров.
При низких температурах окисление атомов водорода при а - и р-углеродном атоме более вероятно, однако при повышении температуры такое преимущественное окисление проявляется все в меньшей степени, так как энергия связи С—Н при у-, р - и других атомах углерода, вероятно, выше энергии связи С—Н, соседней с карбонильной группой. Таким образом, наблюдающееся при температуре около 200 °С поглощение кислорода связано с возможностью участия в радикальноцепном процессе окисления всех атомов водорода в полиэфире.
Увеличение длины алкильных радикалов концевых алкоксиль - ных и ацильных групп практически не влияет на кинетику поглощения кислорода. Очевидно, водородные атомы метиленовых групп гликолей и дикарбоновых кислот, находящиеся между высокополярными сложноэфирными группами, в большей мере подвержены действию кислорода, чем водородные атомы концевых радикалов. У смешанных полиэфирных пластификаторов скорость поглощения кислорода имеет аддитивный характер.
Все кинетические кривые поглощения кислорода полиэфирными пластификаторами характеризуются отсутствием на них периода индукции даже при 170°С, однако уже при этой температуре намечается S-образная форма начального участка кривой, что указывает на автоускорение окисления.
|
|
На примере дибутилового эфира полидиэтиленгликольадипи - ната {82] была исследована роль гидролитических процессов при термоокислительной деструкции полиэфирных пластификаторов.
'При окислении полиэфира кислотное число возрастает, в то время как число омыления при 200 °С в течение 10 ч окисления практически не изменяется. Постоянство числа омыления при термоокислительной деструкции показывает, что увеличение содержания карбоксильных групп происходит преимущественно в результате расщепления сложноэфирных связей исходной полимерной молекулы. Образование карбоксильных групп вследствие протекания процесса термоокислительной деструкции, инициированного по связи С—Н, практически не наблюдается [82].
Вода, гидролизующая полиэфир при его термоокислительной деструкции, образуется при распаде гидропероксидов.
Характерно, что в присутствии антиоксиданта кислотное число полиэфирных пластификаторов практически не изменяется после прогрева в течение 4—5 ч при 180 °С.
Для повышения стойкости полиэфирных пластификаторов к термоокислительной деструкции исследовали антиоксиданты, относящиеся к классу фенолов, бисфенолов, тиобисфенолов и фос - форорганических соединений [80].
Анализ кинетических кривых термоокисления полиэфиров, стабилизированных указанными антиоксидантами, показал, что одно - и двухатомные фенолы менее эффективны, чем. бисфенолы. Наиболее эффективными являются тиобисфенолы особенно СаО-6 и фосфорсодержащие соединения — полигард, полифосфинит.
Поведение фосфорсодержащих полных сложных эфиров при термоокислительной деструкции подчиняется закономерностям, установленным для эфиров карбоновых кислот и спиртов [8, 45,. 62, 83—85]. Так, эфиры ортофосфорной кислоты и алифатических спиртов менее стойки к термическому и термоокислительному воздействию, чем смешанные алкиларилортофосфаты или три - арилортофосфаты.
Триалкилортофосфаты при комнатной температуре довольно устойчивые соединения, но при нагревании до 150 °С в течение 24 ч разлагаются [45]:
Och2ch2r rch=ch2 + hopoch, ch2r
I
|
OCH2CH2R
|
|
II О |
О
Где R — алкильный радикал.
Следовательно, разложение молекулы полного фосфата протекает с разрывом наиболее слабой С—О-связи.
Термическое разложение катализируется кислотами, поэтому дальнейшая термодеструкция протекает автокаталитически. Причем образовавшиеся диалкил - и моноалкилортофосфорные кислоты сами разлагаются с большей скоростью, чем триалкилортофосфаты. Например, Хохвальд и др. [86] при перегонке смеси моно - и диэтилортофосфатов обнаружили этанол, этилен, триэтил-
Ортофосфат, а в остатке — кислые конденсированные фосфорные кислоты.
Строение алкильной части молекулы триалкилортофосфата влияет на скорость термического разложения — наличие заместителя водорода у p-углеродного атома резко снижает скорость процесса. Это особенно заметно при сравнении термостойкости три-м-октил - и три-2-этилгексилотофосфатов, выражающейся в потере массы при 150 °С, равной 3,2 и 2,8% соответственно [8]1. В этом случае образование олефина с концевой двойной связью не происходит [45].
По отношению к термоокислительной деструкции триалкилор - тофосфаты также менее стойки по сравнению с другими классами фосфорсодержащих пластификаторов. В отсутствие антиоксидан - тов при 180 °С в атмосфере кислорода триалкилортофосфаты не имеют периода индукции до начала разложения [84].
Триарилортофосфаты более стойки к термическому и термоокислительному разложению (скорость разложения в 30—50 раз меньше), чем триалкилортофосфаты [8, 84, 85], так как у них не происходит отщепления ненасыщенного углеводорода (олефина). Ниже приведены данные об изменении исходного давления кислорода (40 кПа) при термоокислительной деструкции в изотермических условиях (180 °С, 2 ч):
Д Р, кПа
TOC \o "1-3" \h \z Триалкилортофосфат (С7—С9)............................................................... 5,3
Три (2-этилгексил) ортофосфат............................................................. 4,3
Три (2-бутоксиэтил) ортофосфат.......................................... 1,87
Ди (2-этилгексил) фенилортофосфат. . ... . . 1,6
Дифенил-трет-бутилфенилортофосфат..................................................... 0
По нашим данным дифенилизопропилфенилортофосфат и ди- фенил-л-г/зег-бутилфенилортофосфат без дополнительных ингибиторов окисления могут применяться при температурах около 200—250°С.
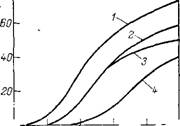
Особенно высокая стойкость этих триарилортофосфатов к термоокислительной деструкции объясняется, с одной стороны, наличием фенильных ядер с разветвленными заместителями, а с другой,— возможностью дополнительной стабилизации по отношению к окислению вследствие незначительных примесей в пластификаторах и-шо-пропилфенола и я-трег-бутилфенола. Так, на рис. 3.12 показано влияние содержания этих примесей на термоокислительную стабильность дифенил-я-грет-бутилфенилортофосфата.
Смешанные алкиларилортофосфаты занимают промежуточное положение между триалкил - и триарилортофосфатами. Термостабильность этих эфиров подробно исследована Гамратом и др. [8] с помощью определения потери в массе и кислотности после термообработки в течение 24 ч при 150 °С. Результаты исследований указывают, что алкилдикрезилортофосфаты более стабильны, чем алкилдифенилортофосфаты. При сравнении эфиров с различными алкильными группами в молекуле алкилдиарилорто-
|
|
|
0,80 0,67 0,53 О, ио 0,27 0,13 О |
|
Рис. 3.12. Зависимость газовыделения от времени выдержки дифенил-л-трет-бу - тилфенилортофосфата при 300 °С и давлении кислорода 40 кПа: 1 — 0,16% фенола; 2 — 0,3%; 3 — 0,45%. |
|
20 W ВО 80 100 г; мин ^OJWW------------------------------------ ОА~С$> |
Рис. 3.13. Зависимость периода индукции от содержания бисфенола А при термоокислительной деструкции полных фосфатов:
1 — дн(2-этнлгексил)фенилортофосфат; 2 — три(2-зтилгексил)ортофосфат; з — триалкилорто - фосфат (С7—Сэ); 4— три(2-бутоксиэтил)ортофосфат.
Фосфатов, видно, что соединения с алкильными радикалами нормального строения значительно стабильнее изомерных разветвленных алкилдиарилортофосфатов. Причем, чем более разветвленной является алкильная группа, тем меньше термостойкость ал - килдиарилортофосфата. Кроме того, чем ближе разветвление к а-углеродному атому алкильного радикала в эфире, тем менее стабилен пластификатор (потери массы 6-метилгептил - и 2-этил- гексилдиарилортофосфатов составляют 1,6 и'2,9% соответственно).
Для предотвращения термоокислительной деструкции полных эфиров ортофосфорной кислоты применяются те же ингибиторы. окисления, что и для эфиров карбоновых кислот и спиртов. Изучение ряда стабилизирующих добавок указывает на эффективное действие бисфенолов А и 2246 [4,4-дифенилол-1,1-диметилметан и 2,2-метилен-бис(6-грег-бутил-4-метил) фенол] и ариламина (неозон Д) [84]. Несмотря на очень эффективное действие ариламинов в качестве стабилизаторов термоокисления фосфорсодержащих пластификаторов эти соединения применяются редко вследствие резкого ухудшения цвета пластификаторов.
Для защиты фосфорсодержащих пластификаторов от термоокисления применяют бисфенолы, причем в несколько большем количестве, чем для эфиров карбоновых кислот (0,2—0,5% вместо 0,1—0,2% от массы эфира) (рис. 3.13).
В результате рассмотрения поведения пластификаторов слож - ноэфирного типа при термическом и термоокислительном воздействии можно сделать вывод, что ряд соединений, содержащих арильные радикалы в кислотной или спиртовой части молекулы, вполне устойчивы к термоокислительной деструкции без стабилизаторов при температурах переработки полимеров. Такие наиболее широко используемые в промышленности пластификаторы і как ди (2-этилгексил-о-фталат, ди (2-этилгексил) себацинат, ди(2- -
этилгексид) фенил-ортофосфат при введении ингибиторов окисления могут перерабатываться с полимерами при довольно высоких температурах (около 180—200°С) без термоокислительной деструкции.