Растворимость примесей в водном теплоносителе и закономерности образования отложений
В достаточно широком диапазоне высоких и сверхкритических параметров однородного водного теплоносителя (пара и воды) термодинамическая растворимость малолетучих неорганических соединений как функция свойств растворителя определяется двумя параметрами — плотностью и температурой. Растворимость описывается предложенным О. И. Мартыновой уравнением
Радиоактивные продукты коррозии металлов Fe, Mn, Со, AI, Zr и др., газы Ns, 02, Хе, Кг и др.
Соли фосфорной кислоты, аммиак, гидразин, комплексоны
Процесса растворения; R — универсальная газовая постоянная; Т — температура; AS— энтропия растворения вещества; тп—координационное число (гидратационная характеристика) .
Расчеты растворимости веществ в водном теплоносителе по (14.1) возможны при наличии надежных данных по трем параметрам, характеризующим процесс растворения: АН, AS и т. Эти данные известны только для отдельных примесей и ограниченного диапазона параметров.
Поэтому впредь до накопления необходимых данных закономерности растворимости веществ в воде и паре изучаются экспериментально. Ниже рассматриваются общие закономерности растворимости примесей в водном теплоносителе.
|
150 200 250 300° с |
|
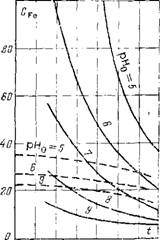
Рис. 14.2. Растворимость магнетита в кипящей воде в зависимости от температуры при различных значениях рН0. |
|
Too |
|
ПО |
|
ВО |
|
Го |
|
---- ■ восстановительная сре- -------- ■ — окислительная |
|
Да; - среда. |
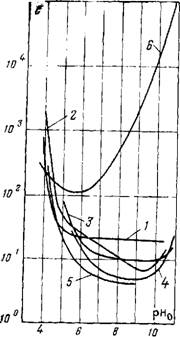
Растворимость примесей в воде и закономерности образования отложений. Все вещества, находящиеся в воде парового котла, по своей растворимости делятся на две группы: трудно (мало) растворимые и легко (хорошо) растворимые. К числу труднорастворимых соединений относятся соли и гидроокиси кальция и магния, окислы конструкционных материалов, с которыми соприкасается водный теплоноситель. Растворимость некоторых труднорастворимых примесей, находящихся в воде высокой температуры ТЭС и АЭС, приведена на рис. 14.1—14.3. Легкорастворимыми соединениями, присутст-
|
Rnrfmr
Рис. 14.3. Зависимость растворимости кислородных соединений в кипящей воде (р= = 7 МПа). I — Fe (окислительная среда); 2— Fe (восстановительная среда); 3 — Си; 4 — 2п; 5 —Ni; 6 — А!. |
Вующими в воде паротурбинных установок, являются соли и гидроокись натрия. Их растворимости приведены на рис. 14.4. Из приведенных зависимостей следует, что растворимость одних соединений с повышением температуры увеличивается, других, наоборот, уменьшается.
Учитывая различные источники поступления в воду паротурбинных установок труднорастворимых соединений, а главное — их специфические особенности поведения в водном теплоносителе, соединения кальция и магния и окислы металлов рассматриваются отдельно.
Труднорастворимые соединения. Поступление с питательной водой труднорастворимых соединений, главным образом солей кальция и магния, ограничено. При нарушениях в работе конденсатоочистки, возрастании присо - сов в конденсаторе и неполадках системы водоподготовки увеличиваются их поступление и концентрация в питательной воде.
В растворе любого электролита часть растворенного вещества диссоциирует на ионы (катионы Ме"1* и анионы Асп_), а часть остается в виде молекул. Степень диссоциации, т. е. доля диссоциированной части молекул зависит, от индивидуальных свойств растворенного вещества и температуры процесса.
At
С учетом возможного состава питательной воды в котловой воде одновременно могут присутствовать катионы Са2+, Mgs+ и анионы SO*-, SiOj", Р043_, СО*~, СГ. В процессе
Упаривания концентрация всех содержащихся в воде ионов повышается, в пределе достигается произведение растворимости соединений.
Растворенные в воде вещества кристаллизуются. В первую очередь из раствора выпадают те соединения, произведение растворимости которых при данных условиях меньше. Некоторые из них кристаллизуются на поверхности нагрева, образуя накипь. Такие вещества называются накипеобразователями. Другие — кристаллизуются в объеме раствора и образуют шлам, и сами вещества называются шламообразователями. Центрами накипе - образования являются шероховатости поверхности нагрева (выступы, впадины), а шламообразования — грубодисперсные и коллоидные частицы, пузырьки газов.
Условие предотвращения отложений основных накипеобразователей Са и Mg с анионами SCV- находящимися в воде, записывается так:
ACa2+-aS02-<nP: )
(14.3)
AMg2+-aS02-<nP-J
|
Для насыщенного раствора при данной температуре произведение активных концент |
|
■ п" '"+ а до |
|
Рации ионов а' |
|
Казываемое про |
|
Me |
Для определения допустимых значений содержания соединений Са (или Mg) и анионов накипеобразователей в воде необходимо знать растворимости в воде всех соединений, которые могут образоваться в указанных условиях, в зависимости от температуры. Такие данные для основных накипеобразователей приведены на рис. 14.1. Видно, что основные накипеобразователи имеют отрицательный температурный коэффициент растворимости, и при высоких температурах растворимость этих соединений составляет всего лишь несколько мг/кг, т. е. на три — пять порядков меньше растворимости легкорастворимых со
лей. На основании данных о растворимости той или иной примеси при заданной температуре, например CaSC>4, определяются активные концентрации соответствующих ионов
Са2+ и SO^, по которым затем рассчитывается произведение растворимости по (14.2).
Продукты коррозии конструкционных материалов. С питательной водой в парообразующий тракт поступают продукты коррозии ряда конструкционных материалов: железа, меди, цинка, кобальта, алюминия и др. Возможности этих соединений образовывать отложения определяются растворимостью в водной среде в условиях протекания процесса. Для большинства продуктов коррозии эти значения не превышают нескольких десятков микрограммов на килограмм[5] (рис. 14.3).
Наибольшее количество продуктов коррозии поступает в виде окислов железа, основного конструкционного материала паротурбинных установок любого давления. Железо в соединении с кислородом образует ряд окислов, основными из которых в условиях работы парообразующей установки являются гематит Fe203 и магнетит Fe304. Наибольший интерес представляют свойства и в первую очередь растворимость магнетита, являющегося основным окислом железа при температуре ниже 550—570°С, т. е. в установках высокого давления (ВД) и сверхкритического давления (СКД).
На растворимость магнетита в воде высокой температуры очень сильное влияние оказывает рН среды. Зависимости растворимости магнетита в кипящей воде от температуры при различных значениях рН в окислительной и восстановительной средах показаны на рис. 14.2. Видно, что для широкой области высоких температур 250—350°С (4—18 МПа) ^ рН = 6-=-9 растворимость магнетита в восстановительной среде не превышает 40— 50 мкг/кг, а в окислительной среде 20— 30 мкг/кг. Действительные концентрации этого соединения в воде много выше. Это означает, что в воде присутствуют не только истинно - растворенные окислы железа, но и коллоидные и грубодисперсные частицы. Последние независимо от размеров образуют отложения на поверхностях нагрева. Наибольшие отложения (несколько сотен граммов на квадратный метр за год работы) образуются на высокофорсированных участках водопарового тракта. По составу это на 70—90% окислы железа.
Отложения продуктов коррозии железа состоят из основных двух различных по физико-химическим свойствам слоев. Внутренний слой плотный, хорошо сцеплен с металлом. Он образуется в процессе коррозии поверхности самого металла. Наружный слой рыхлый, значительно более пористый, относительно слабо сцеплен с поверхностью. Отложения внутреннего слоя не представляют опасности для работы металла и даже желательны, так как плотная, прочная, хорошо сцепленная с металлом окисная пленка защищает его от дальнейшей коррозии. Наоборот, рыхлые, пористые отложения наружного слоя (формирующиеся главным образом из коллоидных и грубодисперсных частиц), обладая малой теплопроводностью, ухудшают отвод теплоты от поверхности.
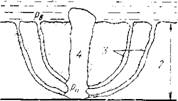
Вместе с тем в условиях железоокисных отложений при пузырьковом кипении может возникать так называемый «.фитильный эффект» подсасывания воды через множество капилляров в пористых отложениях к поверхности нагрева, от которой через широкий канал — «паровую трубу» выбрасывается образующийся пар (рис. 14.5). При такой своеобразной циркуляции у основания капилляров происходят глубокое упаривание и концентрирование находящихся в водном теплоносителе примесей, в том числе и коррозионно-агрес - сивных (щелочей, хлоридов и др.), приводящих к усилению коррозионных процессов. В пористом слое отложений значительная доля теплоты отводится за счет испарительного эффекта. Это определяет высокие значения так называемой «эффективной теплопроводности» отложений, включающей теплопроводность как физическую константу этих отложений, так и теплоотдачу от стенки к рабочей среде. Поэтому в условиях «фитильного кипения» рост температуры металла не превышает 10—20°С даже при значительной толщине слоя отложений (несколько десятков и даже сотен микрометров). Резкое ухудшение теплообмена наступает при закупорке капилляров из-за концентрирования и отложения в них примесей других компонентов, находящихся в воде.
При пористых отложениях из-за увеличения шероховатости поверхности каналов, а
/
|
|
|
Рис. 14.5. Модель циркуляции в слое железоокисных отложений. 1 — поток воды; 2 — толщина слоя железоокисных отложений; 3 — капиллярные каналы— «фитили» ; 4 — выход пара из «паровой трубы» под давлением рп; рв — давление потока воды. |
При значительных толщинах слоя и из-за сужения проходного сечения возрастает гидравлическое сопротивление каналов, приводящее к снижению рабочего давления.
Процесс образования наружного слоя же - лезоокисных отложений представляется тремя этапами: доставкой взвешенных частиц из ядра потока в пристенный слой, движением частиц в этом слое и закреплением их на рабочей поверхности. На первом этапе наибольший вклад дают силы гидродинамической природы. На втором и третьем этапах в зависимости от конкретных условий процесса наряду с гидродинамическими силами и силами межмолекулярного взаимодействия сильное влияние оказывают силы электрохимической природы. Эти силы вызывают движение заряженных частиц продуктов коррозии в электрическом поле, возникающем в тепловом пристенном слое теплоносителя под действием термо-э. д. с. Последняя возникает в цепи, состоящей из поверхности нагрева (проводника первого рода) и водного теплоносителя (проводника второго рода) при наличии между отдельными участками разницы температур. Одновременно с процессами, приводящими к отложениям взвешенных в воде продуктов коррозии, протекает и частичный их смыв с поверхности.
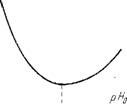
Важнейшей характеристикой, определяющей возможность бесперебойной длительной эксплуатации любого парообразующего аппарата, является скорость формирования отложений. Применительно к железоокисным отложениям эта скорость зависит от большого числа параметров процесса: массовой скорости, тепловой нагрузки, режима кипения, рН водного теплоносителя, фракционного состава, дисперсности частиц и др. Ввиду большой сложности и многофакторности процесса же - лезоокиряых отложений до настоящего времени еЩе не разработана физическая модель, которая бы учитывала влияние всех перечисленных параметров процесса. На рис. 14.6 показано влияние рН теплоносителя на скорость образования при ДКД и концентрации Ог на железоокисных отложений наружного
|
|
|
Рис. 14.6. Влияние рН0 на скорость образования железоокисных отложений. |
Г
Мг. ч
Рис. 14.7. Изменение скорости образования железоокисных отложений.
Слоя на уровне 0,4 мг/кг. Видно, что минимум скорости отложений приходится на значение рН, отвечающее изоэлектрической точке продуктов коррозии.
Процесс отложений взвешенных частиц продуктов коррозии сопровождается одновременным смывом продуктов коррозии. В начальный период процесса, когда поверхность свободна от отложений, преобладает отложение взвешенных частиц, и скорость образования отложений наибольшая (рис. 14.7). С течением времени по мере накопления слоя отложений увеличивается их смыв. Через некоторое время устанавливаются определенное для конкретных условий соотношение между отложением и смывом, а следовательно, и определенная скорость накопления отложений. Смываемые с одного участка контура продукты коррозии могут откладываться на других участках. Это свойство отложений отрицательно сказывается на работе контуров АЭС, так как оно является одним из источников переноса активности по контуру.
Легкорастворимые соединения. На рис. 14.4 приведены характеристики растворимости легкорастворимых примесей. Температурные коэффициенты растворимости для одних из них положительны (NaOH), других (Na2S04, Na3P04) — для области, имеющей практический интерес для паровых котлов и парогенераторов (более 200°С), отрицательны.
При нормальном протекании гидродинамических и теплообменных процессов, обеспечивающих надежный температурный режим поверхностей нагрева, концентрации каждого из перечисленных соединений в воде барабанных котлов во много раз ниже допустимых. Так, при температуре воды 343°С (р — = 15,5 МПа) растворимость Na2S04 составляет около 10 г/кг воды, что при максимально допустимой концентрации солей в котловой воде[6] около 2 г/кг составляет пятикратный запас. Из приведенного примера следует, что выпадение из раствора твердой фазы возможно только при очень большой кратности упаривания раствора в пограничном кипящем слое жидкости, которая при нормальном гидродинамическом режиме в барабанных котлах никогда не достигается. Следовательно, в этих
|
0П S |
J 1 ?1°г |
|||||
|
С= |
J2 |
/ |
||||
|
НС |
^ 1 , |
|||||
|
Сс |
.sc |
У 4 |
1 |
Пе |
|
To |
|
Iff |
|
250 350 Ш 550°C |
Рис. 14.8. Изобары рас - Рис. 14.9. Растворимость
Творимости некоторых NaCl в перегретом паре
Соединений в Н20 СКД ДКД. (25 МПа).
Условиях присутствие в воде легкорастворимых солей в отношении образования отложений на поверхностях нагрева барабанных котлов не опасно.
Растворимость примесей в рабочей среде СКД и ее влияние на отложения. Температура рабочего процесса оказывает существенное влияние на растворимость веществ в Н20 при СКД, особенно в зоне больших теплоем - костей. Эти данные для давления 25 МПа приведены на рис. 14.8. Из сопоставления зависимостей растворимости с рядом теплофизических параметров водного теплоносителя, например плотностью р и диэлектрической проницаемостью є при СКД (см. рис. 9.6), следует, что характер этих зависимостей один и тот же. Во всем диапазоне температур растворимость большинства примесей в водном теплоносителе снижается с ее повышением так же, как и плотность и диэлектрическая проницаемость.
|
Мкг/кг |
|
10 |
|
Ш Ш 500 °С |
|
W |
Описанные закономерности свидетельствуют о том, что основная масса примесей, находящихся в рабочей среде паровых котлов СКД, должна выпадать в сравнительно узком диапазоне изменения теплофизических параметров — зоне больших теплоемкостей (см. § 9.5). Исключение составляет растворимость продуктов коррозии железа, главным образом магнетита Fe304, которая мало изменяется с температурой (рис. 14.8). Она мало зависит и от плотности теплоносителя, а следовательно, и от состояния рабочей среды. Это приводит к тому, что отложения продуктов коррозии железа склонны к «размазыванию» по всей поверхности котла и турбины. Вместе с тем толщина железоокисных отложений сильно зависит от тепловой нагрузки. Поэтому на интенсивно обогреваемых поверхностях нагрева (НРЧ прямоточных котлов) железоокисных отложений существенно больше, чем на других поверхностях с меньшей тепловой нагрузкой.
Растворимость примесей в перегретом паре ДКД и ее влияние на отложения. Растворимость веществ в перегретом паре ДКД определяется свойствами растворителя — перегретого пара и свойствами твердой примеси, с которой соприкасается перегретый пар. Те и другие свойства зависят от параметров рабочего процесса: давления и температуры.
Прочность связей между ионами, молекулами или атомами твердой примеси сильно зависит от температуры. Повышение температуры ослабляет эти связи, способствует переходу твердой фазы в перегретый пар. Изменение давления в том диапазоне, в каком это наблюдается в паровых котлах, мало влияет на поведение твердой фазы.
Температура и давление, определяющие плотность перегретого пара, оказывают сильное влияние на его свойства как растворителя. При постоянном давлении с повышением температуры перегрева плотность пара уменьшается. Это приводит к уменьшению диэлектрической проницаемости Н20 и полярности ее молекул. В результате с повышением температуры растворяющая способность перегретого пара сначала падает из-за уменьшения плотности растворителя — перегретого пара. Однако, несмотря на снижение плотности, дальнейшее повышение температуры при постоянном давлении приводит уже к ослаблению связей в кристаллах твердого вещества и соответствующему повышению растворимости. На рис. 14.9 показаны изобары растворимости NaCl от температуры при постоянном давлении. Видно, что в минимуме растворимости одинаково влияние обоих факторов. В левой ветви характеристики преобладает влияние плотности с изменением температуры, в правой ветви — силы связей в кристаллической решетке.
Давление перегретого пара также сильно влияет на его растворяющую способность. Чем выше давление, тем выше плотность пара и больше растворимость веществ, однако влияние давления уменьшается с ростом температуры перегрева пара. Качественно подобны изобары растворимости и других соединений, например Na2S04, CaS04. Количественные зависимости различны.
Практическое значение растворимости веществ в перегретом паре состоит в том, что если в паре концентрация примеси меньше ее растворимости по изобаре, то он будет растворять эту примесь и уносить с собой, образуя обычно отложения в турбине. Если в пере-
Гретом паре концентрация примеси выше, чем растворимость по изобаре, то избыток будет выпадать в тракте пароперегревателя, а после него — в турбине.