Переход примесей из воды в насыщенный пар
Известны два пути перехода примесей из воды в пар: с капельным уносом кипящей воды и вследствие растворимости в паре.
|
|
|
|
Концентрация примесей в насыщенном паре характеризуется суммарным коэффициентом выноса kT*, 0:
Сп
(14.4)
Где to — влажность пара, %, характеризует содержание примесей, поступающих в насыщенный пар вместе с капельной влагой; kv — коэффициент распределения, %, характеризует содержание примесей в паре вследствие его растворяющей способности.
Роль составляющих коэффициента выноса зависит от ряда факторов и главным образом от давления. Так, при низком давлении растворяющая способность пара для большинства нелетучих примесей, находящихся в воде, ничтожно мала (&Р>С(о), и потому ^ын ^
С повышением давления растворяющая способность пара возрастает, увеличивается вклад коэффициента распределения, и при высоком давлении может оказаться, что£р^>(о,
Т0ГДаСш
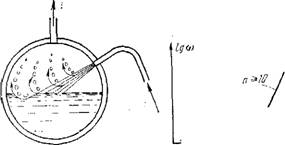
^Механизм и закономерности уноса, влаги пйром. В зависимости от схемы подвода пара в барабан механизм образования капель в паровом объеме имеет различную природу. При подводе водяных струй под уровень воды в барабане отдельные пузыри пара, всплывая к поверхности раздела фаз (рис. 14.10,а, б), образуют двухфазный динамический слой. При этом пузырек пара подвержен воздействию двух сил: внутреннему давлению, вызывающему разрыв водяной пленки, окружающей пузырек пара, и силе поверхностного натяжения этой пленки, тормозящей ее разрыв. В чистой воде с образовавшегося купола пленки жидкость стекает, и пленка утоняется (рис. 14.10,в). Образуется отверстие в верхней части купола, которое под действием сил поверхностного натяжения расширяется, пленка втягивается в основную массу воды, пузырек пара выходит в паровой объем, а с образующейся при этом кольцевой волны отрываются капельки воды, выбрасываемые в паровой объем (рис. 14.10,г). В образовавшуюся лунку устремляется вода, которая при встрече дает
Рис. 14.10. Схема образования капельной влаги в паровом объеме барабана при вводе парообразующих труб в водяной объем.
A — всплывающий пузырек пара; б — начальный период выхода пузырьков на зеркало испарения; в — перед разрывом водяної! оболочки; г и д — разрушение водяной оболочки с образованием капелек влаги.
Всплески в виде столбика, от которого также отделяются капельки воды (рис. 14. 10,(5). При барботаже пара через слой маломинерализованной воды пленки, окутывающие пузырьки пара перед их выходом в паровой объем, имеют резко различную толщину, и потому они образуют капельки влаги также различных размеров.
|
Л ^JjJ^^-lg В (if wjj |
|
Рис. 14.12. Зависимость влажности пара от нагрузки. |
|
Рис. 14.11. Схема образования капельной влаги при вводе пароводяной смеси в паровой объем аппарата. |
При подаче пара выше зеркала испарения капельки в паровом объеме образуются в результате дробления влаги, поступающей с паром в барабан из парообразующих труб (рис. 14.11). Степень дробления зависит от кинетической энергии пароводяных струй. При больпгой нагрузке, а следовательно, большой скорости входа пароводяных струй в барабан большая кинетическая энергия вызывает сильное дробление влаги и более интенсивный капельный унос. В паровом объеме устанавливается динамическое равновесие между поступающими и оседающими каплями. Наибольшая их концентрация оказывается у поверхности раздела фаз, она падает по мере
удаления от этой поверхности. Наиболее крупные капли выбрасываются на высоту до 600—700 мм.
При малой подъемной скорости пара сним увлекаются только капли очень малых размеров. С увеличением расхода пара в унос включаются капельки все больших размеров. Поэтому чем выше нагрузка, тем больше влажность выдаваемого пара (см. рис. 14.12).
Влажность пара со определяется нагрузкой D:
Ю=;4£К (14.5)
Значения А и п зависят от конструкции парового объема аппарата, давления, концентрации и ионного состава примесей воды. Показатель степени п резко изменяется с нагрузкой. Зависимость влажности пара от нагрузки в логарифмических координатах аппроксимируется ломаными прямыми участками, которые выражаются степенными функциями (14.5). Таких участков три (рис. 14.12). Для нагрузок, характеризующихся очень малой влажностью пара со<0,01%, п— 1-Н2, для нагрузок, при которых со = 0,01ч-0,1%, п= — Зч-4 и для больших нагрузок, когда ш> >0,2%, n^slO. Для ТЭС характерна работа барабанных котлов в начале второго участка с п=3-f-4. Скорость пара пропорциональна его^расходу D. Средний расход пара, отнесенный к 1 м2 зеркала испарения, называется удельной нагрузкой зеркала испарения
Rf=D/F. (14.6)
Средняя скорость пара, отнесенная к 1 м3 парового объема, называется удельной нагрузкой парового объема
Rv=D/V. (14.7)
Высота парового объема оказывает существенное влияние на влажность выдаваемого пара. Чем меньше высота парового объема, тем при const больше крупных капель достигает области высоких скоростей пара у пароотводящих труб, и потому влажность пара выше. С увеличением высоты парового объема уменьшается число крупных капель, попадающих в пароотводящие трубы и уносимых паром, и потому влажность пара уменьшается (рис. 14.13). - Начиная с некоторого значения высоты ( — 0,8 м), которую не достигают даже самые дальнобойные крупные капли, обладающие наибольшей кинетической энергией, дальнейшее увеличение высоты парового объема уже практически не приводит к снижению влажности пара. В этих условиях в уносе содержатся только капли малых размеров, для которых подъемная скорость пара w"о при Rf = const больше скорости витания капли wBHT. Эти капли будут транспортиро-
О)
0,9
Рис. 14.13. Зависимость Рис. 14.14. Зависимость влажности пара от высо - влажности пара от соле - ты парового объема. содержания воды.
|
Nd3 |
Ваться потоком пара независимо от высоты парового объема. Под скоростью витания понимают относительную скорость капли, при которой возникающая при ее обтекании паром сила сопротивления уравновешивает вес капли. Для этих условий можно записать:
An Р"»2вит
Г0'
6
Откуда
OU^.ISSJ/V^-1)* (14'8)
Где й^кап — диаметр капли; g — коэффициент сопротивления.
С повышением давления увеличивается плотность пара, при этом возрастает сопротивление паровой с{Яеды подъему капель. С другой стороны, уменьшение разности плотностей воды и пара усиливает транспортирующую способность пара. Последняя усиливается еще и потому, что с ростом давления меньше становится поверхностное натяжение, благодаря чему размер выносимых в паровой объем капель жидкости также уменьшается. В целом влияние транспортирующей способности пара с ростом давления преобладает над сопротивлением, оказываемым движению капель более плотным паром, и потому рост давления приводит к более высокой влажности.
Выше рассматривались закономерности капельного уноса для чистой или слабоминерализованной воды. Эти закономерности имеют место в сравнительно широком диапазоне изменения концентраций. В этом диапазоне при постоянстве других условий влажность пара постоянна. Начиная с некоторой концентрации, характерной для данного растворенного в воде вещества, размеры пузырьков пара в воде уменьшаются, и, следовательно, снижается скорость их всплытия, увеличивается фбар. Итогом такого процесса являются набухание уровня, выброс в паровой объем большого количества капелек воды высокой концентрации и резкое ухудшение качества пара (рис. 14.14). Концентрация веществ в воде, при которой наступает резкое набухание уровня и увеличение уноса влаги, называется критической.
Физико-химические основы распределения примесей между водой и равновесным с ней насыщенным паром. Двухфазная однокомпонентная система в зависимости от количественного состава фаз может представлять собой либо кипящую воду, содержащую пузырьки пара, либо влажный пар, содержащий капельки влаги, либо, наконец, кипящую воду, соприкасающуюся с насыщенным водяным паром. Независимо от того, какова структура двухфазной системы, вода и пар представляют собой два растворителя, имеющие одну и ту же химическую природу, но различные плотности и диэлектрические свойства (см. § 9-5), определяющие их способность растворять неорганические соединения.
Если двухфазная система находится в термодинамическом равновесии, содержащиеся в ней нелетучие примеси распределяются между фазами в соответствии с законом распределения растворенных веществ между двумя несмешивающимися растворителями. Количественно это равновесие характеризуется коэффициентом распределения kv, который выражают через активности растворенного вещества в паре а„ и воде ав:
(14-9)
Для разбавленных растворов (что характерно для условий образования пара на ТЭС и АЭС) активности можно заменить соответствующими концентрациями растворенного вещества, тогда
ЈP=^c;;acrB/cfcTR. (14. ю)
Коэффициент распределения зависит от формы, в которой вещество находится в водном растворе. Наибольшей способностью к переходу в пар обладают вещества, находящиеся в воде в молекулярной форме. Вещества, содержащиеся в воде в ионной форме, растворяются в паре существенно меньше. Закон распределения строго справедлив для вещества, находящегося в обоих растворителях (паре и воде) в одной форме — молекулярной или ионной. Коэффициенты распределения 1&мр и &ир, отвечающие этому условию, являются термодинамически истинными и записываются так:
Рм па
KM — _IL и ka — П 4 1П
Р. ист рм 11 "-р. ист — ри • Н^-11/
^ в ^ в
При постоянной температуре истинный коэффициент распределения для каждого вещества является величиной постоянной, не зависящей от начальной концентрации вещества в одной из фаз. Определение истинных коэффициентов распределения представляет значительные трудности из-за практической невозможности раздельного определения концентраций веществ в молекулярной и ионной формах. Поэтому коэффициент распределения обычно определяют через общие концентрации вещества без учета форм их существования в растворителях, т. е. определяют так называемый видимый коэффициент распределения.
Связь видимого молекулярного коэффициента распределения &мр. вид и истинного &мр. исТ выражается в следующем виде:
£мр. вид = &мр. истР - (14.12)
Аналогично для ионной формы
А"р. мвд = А"р. нст(1—Р), (14.13)
Где р — доля молекулярной формы в общем содержании соединения в растворе (р зависит от рН и температуры); (1—р) —доля ионной формы.
Суммарный видимый коэффициент распределения равен сумме молекулярного и ионного видимых коэффициентов распределения.
Переход веществ из воды в пар в соответствии с распределением между двумя несмешивающимися растворителями протекает в адиабатных условиях при постоянной температуре насыщения и соответствующем давлении (плотности). Вместе с тем из рис. 9.8 следует, что на линиях плотностей ВОДЫ и пара для любой температуры (давления) нет реальной области постепенного перехода веществ из воды в пар. Этот переход характеризуется не постепенным плавным переходом веществ из воды в равновесный с ней насыщенный пар, а скачкообразным переходом в соответствии с законом распределения. По мере приближения к критическому давлению, когда р'7р'-»-1, этот скачок уменьшается, и только при р=ркр наблюдается плавный переход растворенных в воде веществ в равновесный с ней насыщенный пар.
При низких концентрациях водного раствора зависимость коэффициента распределения между водой и находящимся с ней в контакте сухим насыщенным паром (<о = 0) от параметров процесса описывается предложенным академиком М. А. Стыриковичем уравнением
K=(cv)n - О4-14)
Уравнение (14.14) справедливо для условий, когда растворенное вещество находится в воде и равновесном с ней паре в одинаковой форме (молекулярной или ионной).
В (14.14) п — координационное число, которое отражает физико-химические свойства
|
Рис. 14.15. Зависимость коэффициента распределения веществ от отношения р'/р" водного теплоносителя. |
Растворенного вещества и количественно выражает степень его гидратации. Величина п сохраняет постоянное значение в широком диапазоне параметров. Чем больше степень гидратации, тем больший вклад ионной формы в общем содержании вещества в растворе. Такие вещества лучше удерживаются полярными молекулами воды, что затрудняет их переход в паровую фазу.
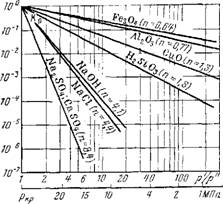
В логарифмических координатах зависимости коэффициентов распределения от отношения плотностей воды и пара по формуле (14.14) изображаются лучевой диаграммой (рис. 14.15). Начало координат лучей всех соединений в точке, соответствующей критическому давлению (для воды 22,85 МПа) и коэффициенту распределения &р=1.
Все соединения, находящиеся в воде, по их растворимости в паре условно можно разделить на три группы: в первую группу входят вещества, для которых я< 1; во вторую — п—1-=-3; в третью—-вещества, для которых п>4. Наибольшей растворимостью в паре обладают соединения первой группы. Это наиболее слабые электролиты, большей частью продукты коррозии конструкционных материалов Fe304, AI2O3 и др., которые, однако, имеют малую растворимость в воде, и поэтому содержание их в паре тоже невелико. Особое значение имеет кремниевая кислота H2Si03 —