Основы кинетики химических реакция
'I Горение топлива в топочной камере определяется сложными физическими и химическими процессами. Из физических явлений, подготавливающих и сопровождающих воспламенение и последующее горение, следует особо выделить процесс смесеобразования топлива и окислителя (аэродинамический фактор). К химическим факторам в первую очередь относятся температура и концентрация реагирующих веществ. В топочных устройствах приходится иметь дело со сложными полями скоростей, концентраций и температур, которые в совокупности определяют кинетику химических реакций.
|
3—833 |
Протекающие при горении топлива химические реакции совершаются с выделением теплоты. Такие реакции называют экзотермическими. К ним относятся реакции горения углерода, водорода, серы в атмосфере воздуха. В условиях высоких температур в ядре факела могут протекать и реакции, идущие с поглощением теплоты. Они являются эндотермическими реакциями. К ним, например, относятся реакция образования окислов азота: N2+02=2N0 — 180 кДж/моль или реакция восстановления двуокиси углерода до окиси на раскаленной поверхности коксовой частицы при недостатке кислорода: С+С02= =2СО—7,25 МДж/кг. Реакция является химически обратимой, если она может идти как в прямом, так и в обратном направлении, однако1 внешние условия для протекания реакции в том или другом направлении могут существенно отличаться. Так, реакция образования окислов азота наблюдается только в зоне очень высоких температур, а обратная реакция их разложения на газообразные кислород и азот протекает в земной атмосфере под действием солнечной радиации. При горении топлива в топочных камерах скорость прямого процесса несоизмеримо больше скорости обратного, поэтому химическое равновесие этих реакций смещено в сторону образования конечных продуктов, и в указанных условиях эти реакции можно считать необратимыми.
Интенсивность горения характеризуется скоростью реакции. Под скоростью гомогенной реакции понимают массовое количество вещества, реагирующее в единице объема в единицу времени. Скорость реакции в этом случае измеряют по изменению концентрации одного из реагирующих веществ А СА, моль/м3 или г/м3, за определенный промежуток времени Ат, с:
ГдР=—АСа/Дт. (4.1)
Скорость гетерогенной реакции выражают количеством вещества Ag, г, реагирующего на поверхности твердого горючего 5, м2, за период времени Ат, с:
= (4-2)
Скорости реакций подчиняются закону действующих масс, согласно которому в однородной среде при постоянной температуре в каждый момент времени скорость реакции пропорциональна произведению концентраций реагирующих веществ:
Wv=kC™AC"B, (4.3)
Где k — константа скорости реакции, зависящая от температуры и химической природы, реагирующих веществ; С а, Св — текущие концентрации реагирующих зеществ Л и В в газовой смеси; т, п — числа молей реагирующих веществ.
Поскольку в газовой смеси при постоянной температуре парциальные давления веществ пропорциональны их концентрациям, можно формулу (4.3) записать в виде
Шр=kp™ApnB. (4.4)
В условиях гетерогенного горения концентрация горючего (твердого топлива) неизменна, поэтому скорость такой реакции будет зависеть только от концентрации окислителя (кислорода) у поверхности топлива
Шр = *Спо,. (4-5)
Где Сп0 — концентрация кислорода у поверхности топлива.
При неизменной концентрации реагирующих веществ во времени скорость реакции определяется константой скорости реакции k, которая зависит от температуры и природы вступающих в реакцию веществ. Эта зависимость выражается законом Аррениуса
K=koe~BJRT, (4.6)
Где — предэкспоненциальный множитель; Е — энергия активации; R — газовая постоянная; Т—абсолютная температура процесса.
|
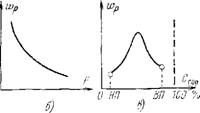
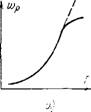
Рис. 4.1. Зависимость скорости реакции от температуры (а), энергии активации (б) и концентрации горючего вещества (е). ИТ! — нижний предел; ВП — верхний предел. |
|
|
Таким образом, скорость реакции с ростом температуры быстро увеличивается (рис. 4.1,а). Химическая реакция может происходить при столкновении молекул веществ между собой. Если бы все столкновения приводили к реакциям, то горение происходило бы с огромной скоростью, тогда константа скорости равнялась бы k0. В действительности реакция может произойти только в том случае, когда за счет энергий соударения произойдет разрушение старых молекулярных связей и образовавшиеся осколки старых молекул могут перегруппироваться и создать молекулы новых веществ.
Энергия, достаточная для разрушения внутримолекулярных связей исходных веществ, называется энергией активации Е, Чем выше уровень энергии активации, тем труднее происходит разрушение молекулярных связей исходных молекул и медленнее скорость реакции (рис. 4.1,6). Tax, энергия активации реакции C-f-02 = C02 Есо> =140 кДж/моль,
А реакции C-j-l /20г=С0 Есо=60 кДж/моль. Отсюда следует, что в реакциях окисления углерода кислородом скорость образования окиси углерода СО значительно выше, чем образование двуокиси С02, и количество СО у поверхности горящего углерода будет преобладать [52, 72].
В топочных устройствах горение происходит при постоянной подаче топлива и окислителя (воздуха) в зону горения и, следовательно, при практически постоянной концентрации реагирующих веществ во времени. В этих условиях максимальная скорость реакции может быть достигнута при соотношении концентраций исходных веществ, близком к сте - хиометрическому. При избытке горючего (богатая смесь) или при малой его концентрации (бедная смесь) скорость реакции снижается ввиду уменьшения тепловыделения на единицу объема.
Горение может происходить не при любой концентрации горючего в смеси, а лишь в определенном соотношении с воздухом (окислителем). Существует нижний предел концентраций горючего (НЦ), ниже которого горение становится невозможным, и верхний предел (ВП), когда дальнейшее увеличение концентрации горючего в смеси также прекращает горение (рис. 4.1,в). Во всем диапазоне концентраций между этими пределами горение возможно.
Если весь объем окажется заполненным готовой для горения газовоздуигной смесью, то при внесении источника зажигания реакция окисления распространяется с такой большой скоростью на весь объем, что происходит резкое увеличение температуры и давления. Такой характер процесса называют взрывным горением или просто взрывом. В этих случаях говорят о верхнем и нижнем пределах взры - ваемости смеси, имея в виду, что во всем диапазоне концентраций между верхним и нижним пределами готовая газовоздушная смесь способна к взрыву. Температура смеси, начиная с которой система способна к самоускоре-
|
|
|
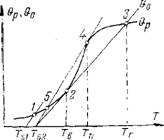
Рис. 4.2. Графическое определение температуры воспламенения (Тв), горения (Тт) и потухания (Тп) при заданной температуре поверхности теплоот - вода (Ts). |
Нию реакции, называется температурой воспламенения.
Соотношение тепловыделения и теплоотво - да при различных уровнях температуры горючей смеси можно изобразить графически (рис. 4.2). Выделение теплоты на начальном этапе химической реакции можно определить из уравнения
% = Ke-E'RrClVCNq. (4.7)
Количество теплоты, отводимой из зоны реакции, находят по уравнению
Qo—aS (Т—Ts). (4.8)
В формулах (4.7) и (4.8) Сгор — концентрация горючего вещества; кем объем готовой горючей смеси; q — тепловой эффект реакции на единицу массы горючего; а — коэффициент теплоотдачи; S — поверхность охлаждающих стен; Т, Ts — температура горючей смеси и охлаждающих стен.
Кривая тепловыделения на начальном этапе реакции представляет собой экспоненту со значительным ростом Qр. В области высоких температур рост QP тормозится возможностями подвода окислителя, т. е. условиями смешения. Линия теплоотвода, если принять а= —const, будет представлять собой прямую с углом наклона, определяемым коэффициентом а.
Если первоначально нагреть горючую смесь в камере и окружающие ее стенки до Tfi, то за счет тепловыделения при реакции с:иесь примет температуру Ti>Ts. В точке 1 Qp=Qo и дальнейший разогрев смеси невозможен. Состояние в точке 1 характеризуется незначительным тепловыделением и низкой температурой. Эта область медленного окисления, которое может продолжаться длительно.
|
3* |
Повысим температуру охлаждающих стен до TS2. Снова первоначально Qp>Qо, и температура смеси растет. Наконец, в точке 2 Qp= —Qo, однако, в отличие от точки 1 состояние здесь неустойчиво. Достаточно небольшого увеличения температуры, как снова Qp>Qo, и тепловыделение растет быстрее отвода теплоты. Температура в точке 2 и является температурой воспламенения Тв. Далее процесс реакции быстро нарастает до состояния ^ич - ка 3) устойчивого высокотемпературного процесса окисления — горения. Этот процесс будет устойчивым, пока обеспечивается подвод горючего и окислителя. Если в последующем начать усиленный отвод теплоты (более крутая линия Qo), то температура горения будет снижаться и затем в точке 4 высокотемпературный процесс оборвется, так как Qo станет больше Qp во всей области температур до точки 5. Температура горючей смеси в точке 4 называется температурой потухания. Потухание горения всегда происходит при более высокой температуре, чем воспламенение, так как концентрация исходных веществ в зоне активного горения ниже, чем начальная при воспламенении.