Механизм горения топлив
Экспериментально установлено, что скорости протекания реакций существенно превышают их расчетные значения, полученные с применением закона действующих масс и закона Аррениуса с учетом числа активных молекул исходных веществ, вступающих в реакцию. В действительности реакции протекают не непосредственно между исходными молекулами, а через ряд промежуточных стадий, в которых вместе с молекулами участвуют активные осколки молекул (радикалы и атомы Н, ОН, О и др.). В результате каждая из таких промежуточных реакций имеет невысокий уровень энергии активации Е, так как радикалы и отдельные атомы обладают свободной валентностью и создают затем частицы также со свободной валентностью. Такие реакции протекают с большой скоростью. Началу реакции между веществами предшествует период накопления активных центров реакции в виде заряженных частиц за счет разрушения части исходных молекул другими, обладающими энергией выше энергии связи атомов в молекулах. Этот период во времени называют периодом индукции.
Горение газовых топлив. Горение газовых топлив происходит по законам цепных разветвленных реакций (ЦРР), раскрытым акад. Н. Н. Семеновым и К. Хиншельвудом. Преобразование исходных веществ в конечные продукты совершаются через систему промежуточных звеньев реакции, последовательно связанных друг с другом и развивающихся в объеме горючей смеси наподобие ветвей, отходящих от ствола дерева. в итоге такой реакции наряду с конечными ее продуктами вновь образуется еще большее число активных центров, обеспечивающих дальнейшее развитие реакции в объеме.
Рассмотрим механизм цепной разветвленной реакции на примере горения водорода в воздухе. Согласно стехиометрическому уравнению
2Н2+02=2Н20
Скорость реакции между молекулами горючего вещества
»н, о =Ke-E>RTaHC0i (4.9)
Не может быть достаточно большой. Однако реально при температуре выше 500°С горение водорода представляет собой взрывную цепную реакцию, идущую с очень большой скоростью. На самом деле, по Н. Н. Семенову, началу активной реакции предшествует образование активных центров:
Нг—Ма—>-2H-j-M;
Н2-гОа2—>-20Н,
Где Ма, Оа2 — активные молекулы, имеющие высокие уровни энергии в объеме.
Образовавшиеся атомы и радикалы активно вступают в реакцию с окружающими их молекулами. Развиваются цепи последовательных реакций, итогами которых являются конечные продукты реакции н еще большее число активных центров.
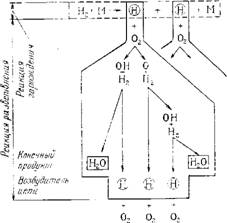
На рис. 4.3 схематично показан первый цикл этой реакции. Как видно, каждый из активных атомов водорода Н, послуживший началу цепной реакции, привел к образованию трех новых активных центров, благодаря чему реакция прогрессивно развивается в объеме газовой смеси. По мере накопления продуктов реакции и уменьшения концентрации исходных веществ усиливается обрыв цепей в объеме и на стенках реактора:
H-f-H—»-Нг;
ОН + Н—^Н20.
Действительная скорость реакции описывается уравнением
WH = �»yTCHCo/-E'lRT. (4.10)
Определяющими скорость реакции являются концентрация атомов водорода (центров реакции) и молекул кислорода, а энергия активации реакции между ними Е' значительно ниже, чем Е в уравнении (4.9). По аналогичным законам цепных реакций происходит горение окиси углерода СО, метана СН4 и других горючих газов.
|
/ / U /7?. Рис. 4.3. Цикл цепной реакции горения водорода. О — возбудитель цепней реакции; □—конечный продукт. |
Из вышесказанного следует, что до начала активной реакции проходит небольшое время — период индукции — в течение которого в объеме накапливается достаточное количество активных центров в виде атомов и радикалов. В этот период реакция почти незаметна, а тепловой эффект ее незначителен. Далее происходит увеличение скорости реакции за счет развития большого числа параллельных цепей реакции на весь объем до тех пор, пока не наступит равновесие в возникновении и исчезновении активных центров [43]. Реакция достигнет максимальной своей скорости и будет продолжаться на этом уровне, если постоянно будет идти доставка в зону горения свежих порций веществ.
Горение газового топлива в смеси с воздухом идет с очень большой скоростью (готовая смесь метана с воздухом объемом 10 м3 сгорает за 0,1 с). Поэтому интенсивность сжигания природного газа в топках паровых котлов определяется скоростью его смешения с воздухом в горелочном устройстве, т. е. физическими факторами. Трудность обеспечения полного смешения большого расхода газа с воздухом за короткий промежуток времени связан с большим различием объемных расходов газа и воздуха — на сжигание 1 м3 газа требуется 10 м3 воздуха. Для полноты перемешивания приходится вводить газ в поток воздуха внутри горелки большим количеством мелких струй малого диаметра и с большой скоростью. Воздушный поток также сильно турбулизируется в специальных завихриваю - щих устройствах.
Горение жидких топлив. При сжигании жидкого топлива (нефть, мазут) температура воспламенения, а тем более горения оказывается выше температуры кипения отдельных фракций, входящих в состав жидкого топлива. Поэтому вначале происходит испарение топлива с поверхности за счет подводимой теплоты, а затем пары топлива смешиваются с воздухом, подогреваются до температуры воспламенения и горят. Факел устанавливается на некотором удалении от поверхности жидкости (0,5—1 мм и более).
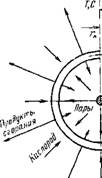
На рис. 4.4 показана схема горения капли жидкого топлива в неподвижной среде воздуха. Вокруг капли образуется облако паров, которое диффундирует в окружающую среду. Навстречу происходит диффузия кислорода воздуха. В результате на некотором удалении от капли гстех устанавливается стехиометриче - ское соотношение между горючими газами и кислородом. Здесь и находится фронт горения паров топлива, образующий сферу вокруг капли. Величина гСТех=4-^-10гк, где гк — радиус капли, и сильно зависит от размера капли и температуры зоны горения. В зоне г<С
|
|
|
Гсгеэг ^ ^ <х<7 I (х>7 |
|
{Капли 1 д Топлиба ІІрЗона реак- |
Рис. 4.4. Механизм и характеристики горения капли жидкого топлива.
Остех преобладают пары топлива, концентрация которых снижается по мере удаления ОТ поверхности. В зоне /">Гстех находятся продукты сгорания в смеси с диффундирующим к зоне горения кислородом. В зоне реакции устанавливается максимальная температура горения, которая затем снижается в обе стороны, но более интенсивно по мере приближения к капле ввиду затраты теплоты на нагрев паров топлива.
Таким образом, скорость горения капли жидкого топлива определяется скоростью испарения капли с поверхности, скоростью химической реакции в зоне горения и скоростью диффузии кислорода к зоне горения. Скорость реакции в газовой среде, как установлено ранее, очень велика и не может тормозить общую скорость горения. Количество кислорода, диффундирующего через шаровую поверхность, пропорционально квадрату ее диаметра и поэтому небольшое удаление зоны горения от поверхности капли (в случае недостатка кислорода) заметно увеличивает массовый подвод кислорода. Следовательно, скорость горения капли в основном определяется ее испарением. В целях повышения скорости горения жидкого топлива необходимо обеспечить его тонкое распыливание перед сжиганием для увеличения суммарной поверхности испарения. Кроме того, с уменьшением размера капли интенсивность ее испарения с единицы поверхности возрастает. Движение мелких капель жидкого топлива, взвешенных в потоке воздуха, характеризуется малыми числами Рейнольдса Re<^l. В этом случае поток теплоты через шаровую поверхность определяется только теплопроводностью К через пограничный слой, толщина которого значительно больше диаметра капли. Для этого условия коэффициент теплоотдачи а выражается формулой Сокольского
Nu=ad/a,=2, (4.11)
Откуда
A=2A,/d=A,/rs (4.12)
Где Nu — число Нуссельта.
Из формулы (4.12) следует, что теплообмен капли с окружающей средой усиливается с уменьшением ее размера. Одновременно уменьшается и ее масса. В итоге оказывается, что время испарения капли пропорционально квадрату ее начального диаметра.
Горение твердого топлива. Угольная пыль, поступающая вместе с воздухом в топочную камеру, вначале проходит стадию термической подготовки (рис. 4.5,/). Она заключается в испарении оставшейся влаги и выделении летучих веществ. Процесс нагрева частицы топлива до температуры интенсивного выхода летучих веществ (400—600°С) происходит за десятые доли секунды. Затем летучие вещества воспламеняются, отчего температура вокруг коксовой частицы быстро увеличивается, а ее прогрев ускоряется (///'). Интенсивное горение летучих веществ (II) занимает 0,2—0,5 с. При большом выходе летучих (бурые и молодые каменные угли, сланцы, торф) выделяющейся теплоты их горения достаточно для воспламенения коксовой частицы, а при малом выходе летучих возникает необходимость дополнительного прогрева коксовой частицы от внешнего источника (///")• Завершающим этапом является горение коксовой частицы при ее температуре выше 800—1000°С {IV). Это гетерогенный процесс, скорость которого определяется подводом кислорода к реагирующей поверхности. Горение коксовой частицы имеет наибольшую длительность во времени и составляет от '/г до 2/з всего времени, необходимого для сгорания частицы. В зависимости от начального размера частицы, вида сжигаемого топлива полное время сгорания может составлять от 1 до 2,5 с.
Механизм реагирования углерода с кислородом представляется следующим. Из газового объема кислород адсорбируется на поверхности частицы и вступает в химическое соединение с углеродом, образуя сложные углеродно-кислородные комплексы СхОу. Последние распадаются с образованием С02 и СО. Результирующую реакцию при температурах около 1200°С можно записать в следующем виде:
4C-f-302=2C0-f2C0?. (4.13)
Исследованиями (Л. Мейер, Л. Н. Хитрин) установлено, что с повышением температуры горящей частицы отношение первичных продуктов С0/С02 быстро возрастает. Так, при температуре около 1700°С результирующее уравнение реакции можно записать:
ЗС+202=2С0+С02. (4.14)
При этом отношение С0/С02=2.
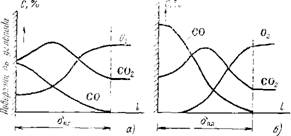
Образовавшиеся первичные продукты реакции постоянно уходят с поверхности частицы в окружающую среду, причем окись углерода, встречая диффундирующий навстречу кислород, реагирует с ним в пределах пограничной газовой пленки частицы и окисляется до С02, отчего концентрация кислорода на подходе к поверхности частицы быстро снижается, а С02 возрастает (рис. 4.6,а). При высокой температуре горения окись углерода может использовать весь поступающий кислород на свое доокисление, и тогда до поверхности он не доходит (рис. 4.6,6). В этих условиях на поверхности частицы протекает восстановительная реакция, идущая с поглощением теплоты, — образование СО за счет части С02.
Таким образом, процесс гетерогенного горения частицы углерода с поверхности можно представить протекающим по четырем результирующим реакциям (по А. С. Предводителе - ву), из которых две являются основными:
C--0z=C02--qi; 2С+02=2С0+2<72 и две вторичными:
|
Рис. 4.6. Изменение концентрации газообразных веществ у поверхности горящего углерода. |
|
|
|
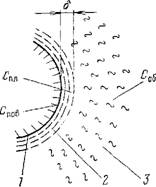
Рис. 4.7. Схема горения углеродной частицы. 1 — поверхность частицы; 2 — пограничная пленка; 3 — зона турбулентного потока. |
|
A — горение в области умеренных температур; б — горение при высокой температуре; впл — толщина пограничной пленки. |
2С0+02=2С02+2(7з;
С+СОг=2СО—Qif
Где q — тепловой эффект каждой из реакций, МДж/моль.
При этом тепловой эффект реакции q =<72+<7з, а ^4=0,57^3. Последнее означает, что за счет более высокого тепловыделения в объеме поддерживается высокий уровень температуры поверхности даже при наличии на ней эндотермической реакции.
Из рассмотрения реакций следует, что горение углерода с поверхности также происходит с частичной газификацией (образованием СО и его догоранием в объеме). Это ускоряет выгорание коксовых частиц.