МОДЕЛЬ АТОМА ВОДОРОДА
|
В |
1913 году датский физик Н. Бор попытался нарисовать наглядную картину того, как должен быть построен атом из положительного ядра и электронов и при каких условиях он излучает свет. Физики называют такую наглядную картину моделью атома.
|
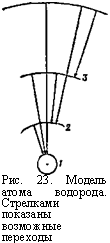
Рис. 23. Модель атома водорода. Стрелками показаны возможные переходы электрона при излучении. |
 Задача была сложная. Модель должна была учесть новый, необычайный характер внутриатомных законов, о которых нам говорят опыты с атомами. Модель должна была объяснить: 1) почему атомы устойчивы, несмотря на то, что и в невозбуждённом атоме электроны движутся, 2) закон разности частот, излучаемых атомами, 3) закон поглощения и излучения энергии только квантами (порциями).
Задача была сложная. Модель должна была учесть новый, необычайный характер внутриатомных законов, о которых нам говорят опыты с атомами. Модель должна была объяснить: 1) почему атомы устойчивы, несмотря на то, что и в невозбуждённом атоме электроны движутся, 2) закон разности частот, излучаемых атомами, 3) закон поглощения и излучения энергии только квантами (порциями).
Легче всего начать строить модель с атома водорода, как наиболее простого. У него имеется всего лишь один электрон (см. стр. 44). Бор предположил, что этот электрон в полном соответствии с законами механики обращается вокруг ядра, как планета вокруг Солнца, двигаясь по определённому пути, или, как говорят, по орбите. Но,— и тут учёный вводит первое ограничение законов классической физики,— орбита эта не произвольная, а вполне определённая. Её радиус может быть точно вычислен. Это—орбита, «дозволенная» законами, действующими внутри атома. У электрона могут быть и другие орбиты, орбиты с ббльшим радиусом, но тоже вполне определённые. На них электрон обращается, когда атомы водорода возбуждаются, захватывают энергию извне. Для удобства при дальнейших рассуждениях мы можем условно занумеровать эти орбиты, начиная с самой близкой к ядру: /, 2, 3 и т. д. (рис. 23).
Двигаясь по какой-либо «дозволенной» орбите, электрон вовсе не излучает. В этом отношении электрон не подчиняется законам классической физики. Это — новое ограничение, которое вводит Бор, чтобы объяснить наблюдающиеся закономер -
Ности. А если электрон не излучает, то и энергия его не убывает.
Однако есть разница в состоянии электрона, когда он находится на орбите 1 и когда он движется на более удалённых орбитах. В первом случае состояние электрона очень устойчивое. Он может как угодно долго двигаться по орбите /, с ним ничего не произойдёт. На более удалённых орбитах состояние электрона неустойчиво: он продержится на них в среднем около одной стомиллионной доли секунды, а затем перескочит на одну из орбит, более близких к ядру, и в конце концов на орбиту 1.
Бор утверждает: атом испускает свет только во время перескоков электронов с орбит, более удалённых, на орбиты, более близкие к ядру.
Подсчитав энергии электрона на возможных для него орбитах, физики нашли, что при перескоке 2—1 (так мы будем обозначать перескок электрона с орбиты 2 на орбиту 1) атом водорода должен испускать излучение с частотой 24,7 *1014, при перескоке 3—1 — с частотой 29,2-1014, при перескоке 4—1 —с частотой 30,9-1014, при перескоке 3—2 — с частотой 4,6*1014, при перескоке 4—2 — с частотой 6,2*1014, а при перескоке 4—3 — с частотой 1,6* 1014. Таким образом, оказалось, что частота света, излучаемого парами раскалённого водорода, определяется тем, с какой орбиты на какую перескакивают электроны в его атомах.
Перескоками электронов можно объяснить и тот факт, что разности между отдельными частотами тоже являются частотами излучения атомов. Когда электрон обращается, скажем, по четвёртой орбите, атом имеет один запас энергии. При перескоке электрона на вторую орбиту атом теряет часть энергии на излучение. Обозначим её так: Э4 2. Но ту же энергию атом может потерять при двух перескоках электрона: с четвёртой орбиты на третью и с третьей на вторую. Если обозначить энергии, потерянные при отдельных перескоках, через Э4 з и Эь 2> то сказанное можно записать: Э4 2 — 34 3 Эв 2. Отсюда следует, что энергия, потерянная при перескоке 4—*2, минус энергия, потерянная при перескоке 4—3, равна энергии, потерянной при перескоке 3—2. Но мы уже знаем, что энергии излучения тем больше, чем больше частоты излучения. Следовательно, если существует закон разности энергий излучений, то существует и закон разности частот излучений. Это мы и видим на примере частот, указанных в предыдущем абзаце. В самом деле: 6,2*1014—1,6*1014 = 4,6*1014.
Следует заметить, что при каждом отдельном перескоке электрона атом испускает излучение только одной частоты. Если же в спектре водорода мы наблюдаем излучения не одной, а нескольких частот, то это потому, что мы всегда наблюдаем результат действия не одного, а множества атомов. В одних атомах электроны перескакивают со второй орбиты на первую, в других — с третьей на вторую, с третьей на первую и т. д.
Такое же объяснение можно дать и частотам спектров других элементов.
Такова была модель атома, нарисованная Бором.
Модель Бора была только первым шагом в изучении строения атома. Она не объясняла, почему электроны ведут себя в атоме так странно, в противоречии с установленными ранее законами. Она только указывала (да и то лишь в простейших случаях), как они себя ведут в силу каких-то новых, ещё не открытых законов, верных для мира малых величин. Эти законы были открыты не сразу. Им посвящена теперь новая наука — квантовая механика.
Модель Бора отображает то, что происходит в простых атомах, лишь в грубом приближении. А для сложных атомов она вовсе не пригодна. Но в случаях, когда большая точность не требуется, физики пользуются этой моделью ввиду её простоты.