Смесимость и несмесимость
Газы при смешении образуют гомогенную смесь, растворяясь неограниченно друг в друге. Это же можно сказать о некоторых жидкостях и твердых телах, например, спирт и вода.
Смесь газов. Главный вопрос смешения - какую температуру и объем будет иметі, газовая смесь, если известны исходные компоненты, их количественный состав и параметры, а также внешние условия процесса смешения (адиабатный, т. е. без теплового контакта с окружающими телами, изобарный или изохорный).
Для определения параметров смеси используют уравнения материального баланса смешения и уравнения состояний компонентов. Эти уравнения широко представлены в специальной литературе.
Раствор жидкостей. Предположим, что в одном объеме v0, разделенные перегородкой до смешения, существуют раздельно (1-Х) кг жидкости «1» с объемом (1-X)vj и X кг жидкости «2», имеющей объем Xv2. После удаления перегородки происходит процесс смешения, в результате которого образуется 1 кг раствора жидкостей с концентрацией X и объемом v, причем
Для большинства жидких растворов v0>v, однако v0<v также имеет место. Общего правила не существует, чем и вызвана необходимость экспериментального изучения свойств каждого раствора жидкостей.
Тепло смешения. При смешении газов с одинаковой температурой, смесь имеет ту же температуру. При смешении жидкостей в большинстве случаев имеет место изменение температуры смеси. Температурный эффект при смешении (повышение или понижение температуры) зависит от качественного, количественного состава полученной смеси и температуры компонентов до смешения. Для объяснения этого явления существует понятие тепла смешения.
Если после смешения жидких компонентов смесь должна иметь ту же температуру (изотермический процесс смешения), что и исходные компоненты, то необходимо в объем смешения подводить или отводить тепло qh названное изотермическим теплом смешения.
Если при смешении (адиабатное смешение) температура смеси повышается, то qt<0, следовательно, тепло должно быть отведено. Если qt>0, то смесь охлаждается* и требуется подвод тепла.
Тепло смешения находится в определенной взаимосвязи с энтальпиями исходных компонентов Qirh и hRL), энтальпией смеси (hCM) и концентрацией смеси (X). Для изобарического смешения (наиболее распространенного в технике)
«r^-li-X^+X. Aj. (6.59)
Тепло смешения определяется экспериментально для каждой пары исходных компонентов, образующих смесь.
В процессе смешения между некоторыми жидкостями (твердыми телами) наблюдается ограниченное растворение. Даже при непрерывном перемешивании таких веществ образуются два насыщенных слоя жидкости, из которых один будет состоять преимущественно из одного компонента, а другой - преимущественно из другого компонента, при этом устранить грани между этими слоями невозможно, так как они отделяются друг от друга. Взаиморастворимость может быть изменена только при изменении температуры смеси. Классическим примером могут служить смеси масла и рабочих веществ HFC - и HCFC-типа.
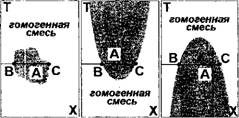
При смешении существуют такие состояния жидких рабочих веществ, при которых растворение не наблюдается. Такие смеси называются несмесимыми. В качестве примера на рис.6.14 приведены три случая зон несмесимости компонентов, т. е. зон (сочетания температур
|
|
А) б) в)
Рис.6.14. Зоны несмесимости: а) внутри интервала Г и Х\ б) ограниченная снизу; в) ограниченная сверху
Т и концентраций X) в которых не могут быть получены гомогенные смеси. Видно, что зона несмесимости может находиться как внутри какого-либо интервала концентраций и/или температур, так и быть ограниченной верхней либо нижней температурой.
Предположим, что точка А лежит внутри зоны несмесимости, тогда несмесимая смесь с концентрацией ХЛ при Theorist распадается на две равновесные насыщенные смеси (точки В и С) с концентрациями Хв и Хс.
Идея использования несмесимых смесей рабочих веществ в холодильных машинах и тепловых насосах была предложена в ОГАХ и развита в теорию создания машин на несмесимых смесях (п. 17.3).