КАК ПРОИСХОДИТ ИЗЛУЧЕНИЕ СВЕТА
Рассмотрим подробнее, как устроен атом — тяжёлое, положительно заряженное ядро, вокруг которого быстро вращаются лёгкие отрицательно заряженные электроны. Быстро вращающиеся электроны должны, казалось бы, создавать вокруг себя быстро меняющиеся электромагнитные силы, подобно тому как это делают в антенне колеблющиеся электрические заряды. Значит, электрон в атоме должен испускать электромагнитные излучения, только гораздо большей частоты, чем радиоволны.
Ну, что же! — подумает читатель, — это верно — ведь атомы действительно излучают свет!
Да, но ведь, излучая свет, электрон отдаёт ему свою энергию. И для того чтобы отдать, таким образом, всю свою энергию электрону, понадобились бы... миллионные доли секунды! А отдав свою энергию, электрон должен неминуемо упасть на ядро. Получается, что атом, обладающий таким строением, существовать не может.
В действительности же атом очень устойчив и излучает редко, хотя его ядерное строение, как показывают опыты» несомненно.
Что же происходит в атоме на самом деле? Ответ на эти вопросы даёт новая наука, возникшая в результате изучения атома, — «квантовая механика».
Вот как квантовая механика рисует движение электронов в атоме.
Вращаясь вокруг ядра по своей орбите, электрон ничего не излучает. При этом представлять себе электрон крошечной «твёрдой» частичкой неверно. Вещество электрона, его заряд, как бы распределяется вдоль всей орбиты, так что ядро оказывается окружённым «электронным облачком».
Электроны могут двигаться около ядра не по любым, но только по вполне определённым или, как их принято называть, «разрешённым» орбитам. Каждой разрешённой орбите соответствует вполне определённая энергия находящегося на этой орбите электрона. Поэтому электрон в атоме не может обладать любой энергией. Он может иметь только ряд вполне определённых энергий, соответствующих его движениям по разрешённым орбитам.
Орбиты находятся на разных расстояниях от ядра. Ближе всего к ядру расположены две орбиты. Они образуют первый слой электронных орбит вокруг ядра. У водородного атома радиус этих орбит чуть превышает половину стомиллионной доли сантиметра. Далее у водорода идут орбиты, радиус которых в 4 раза больше радиуса орбит первого слоя. Этих орбит насчитывается восемь.
Радиус орбит следующего третьего слоя — в 9 раз больше радиуса орбит первого слоя, четвёртого слоя — в 16 раз, пятого — в 25 раз больше и так далее.
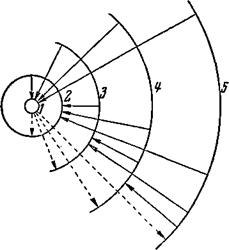
На рисунке 15 изображены радиусы первых пятислоёв разрешённых водородных орбит при увеличении в сорок миллионов раз. Номера слоёв отмечены цифрами. Ядро должно находиться в центре орбит, но оно не видно, так как при этом увеличении его размер оказывается равным одной стотысячной доле сантиметра.
Что касается других атомов, то число орбит в каждом слое будет точно таким же, как и в атоме водорода. Радиус же слоёв будет зависеть от заряда ядра. Радиус первого слоя какого-либо атома во столько же раз меньше радиуса первого слоя атома водорода, во сколько раз заряд атомного ядра превышает заряд ядра водорода. Так, радиус орбит первого слоя у гелия в два раза меньше водородного, натрия — в одиннадцать раз, и т. д. Для следующих орбит зависимость более сложная, и на ней мы останавливаться не будем.
Всё это, конечно, не значит, что на каждой орбите имеются электроны. «Разрешённые» орбиты — это просто
|
Рис. 15. Радиусы первых пяти водородных орбит при увеличении в 40 миллионов раз. Сплошные стрелки показывают прыжки электрона с удалённых орбит на более близкие. Стрелки, изображённые пунктиром, — прыжки на удалённые орбиты («подъём»). Эти стрелки начинаются только с орбит первого слоя, с которого практически всегда начинается подъём, так как электрон почти всё время находится в первом слое. |
Пути, по которым могут двигаться электроны в отличие от всех других путей, по которым движение электронов невозможно. Каждый из имеющихся в атоме электронов будет находиться на одной из ближайших к ядру «разрешённых» орбит. Остальные орбиты будут пустовать.
Они лишь на короткое время занимаются электронами, находящимися постоянно на ближайших к ядру орбитах.
Установлено, что энергия электрона в атоме тем больше, чем дальше от ядра находится его орбита. Точно так же энергия поднятого над землёй камня тем больше, чем выше он поднят над поверхностью земли.
Электрон устойчиво движется по разрешённой орбите, но это не значит, что он навсегда «прикован» к ней. Электрон может «перепрыгивать» с одной орбиты на другую. При этом энергия его, конечно, меняется. При «прыжке» с более удалённой орбиты на более близкую энергия электрона в атоме уменьшается. Излишек энергии в этом случае и отдаётся в виде одного излучаемого фотона. Частота этого фотона определяется его энергией по соотношению, о котором мы рассказали на стр. 27.
Значит, каждому скачку электрона в атоме с одной из удалённых орбит на более близкую соответствует своя определённая линия в спектре излучения. Измеряя частоту этой линии, мы сразу же находим и энергию фотона. Таким образом, мы узнаём, на сколько отличается энергия электрона, находившегося на какой-либо удалённой орбите, от его энергии на более близкой орбите, на которую он «перепрыгнул».
Поясним это тем же рисунком 15. На любую орбиту, принадлежащую, например, слою 3, может самопроизвольно «перепрыгнуть» электрон, находящийся на любой другой, более удалённой орбите, например, слоя 5. Этот скачок сопровождается излучением фотона. Энергия этого фотона равна различию в энергиях электрона на орбите пятого и третьего слоёв, а частота, как мы уже знаем, определяется энергией. Определяя частоту этой линии спектра, мы определяем энергию фотонов и узнаём, на какую величину отличается энергия электрона, когда он находится на орбите слоя <?, от энергии электрона, когда он находится на орбите слоя 5. Этот же переход с пятой на третью орбиту электрон может совершить и в два приёма. Он может перепрыгнуть раньше на орбиту слоя 4, излучив фотон, а затем отсюда перепрыгнуть на орбиту слоя 3, излучив ещё один фотон. По тому или иному пути, большим или меньшим числом прыжков, от одной разрешённой орбиты к другой, электрон в атоме водорода опустится на ближайшую разрешённую орбиту. Такой «спуск» к ядру происходит за ничтожные доли секунды, так что электрон почти всё время находится на ближайшей к ядру орбите.
В атомах более сложных, чем водород, электрон может опуститься и не на ближайшую орбиту, а задержаться на более удалённых. Дело в том, что, как было твёрдо установлено, на каждой орбите в атоме может находиться только один электрон. Значит, электрон, спускающийся на нижние орбиты, остановится на ближайшей свободной орбите. Так, например, в атоме лития три электрона. Два из них находятся на орбитах первого слоя, третий же может находиться постоянно только во втором слое. Такой атом можно возбудить, подняв электрон из второго слоя на один из более удалённых. Он вернётся во второй слой. Но атом можно возбудить, подняв во второй или более удалённый слой и один из электронов первого слоя. При этом появится свободная орбита в первом слое. На неё может опуститься либо электрон из второго слоя, либо поднятый электрон.
Так, изучая поочерёдно все линии атомного спектра, мы получаем самые точные и подробные сведения о возможных энергиях электрона в атоме, а значит, и о возможных скоростях электрона, о его расстояниях от ядра и так далее.
До сих пор мы говорили только о «скачках» электронов с более далёких орбит на более близкие, сопровождающихся излучением фотонов. Скачки электрона в обратном направлении самопроизвольно произойти не могут, — они должны сопровождаться не отдачей, а поглощением энергии. Так, лежащий на высоте камень может скатиться вниз «без посторонней помощи». При этом он отдаёт запас своей энергии, производя разрушения по пути или обращая её в тепло.
Но подняться обратно сам по себе камень не может. Ему надо сообщить необходимую для этого энергию: бросить или поднять его вверх.
Для того чтобы подъём электрона мог произойти, электрон в атоме должен либо поглотить извне фотон соответствующей энергии, либо получить эту энергию от столкновения с каким-либо атомом, электроном или ионом.
Теперь мы можем легко понять, почему, например, светятся раскалённые газы или газы, через которые пропускается сильный электрический ток. В результате столкновений атомов газа между собой (в первом случае) и с летящими электронами (во втором случае) электроны в атомах, получив необходимую энергию, «перескакивают» на одну из удалённых орбит. Как принято говорить, «атом возбуждается». Затем, через очень короткий промежуток времени, электроны возвращаются на более близкие ор-
3 Г. А. Зисман биты, излучая характерный для атомов данного рода спектр.
Атомы различных элементов отличаются друг от друга массой, зарядом ядра, энергией электронов на разрешённых орбитах, числом принадлежащих атому электронов. Ясно поэтому, что нет двух элементов, спектры которых совпадали бы. Изучив спектр какого-либо элемента, мы можем с помощью спектроскопа обнаружить затем его присутствие в самых различных смесях или химических соединениях.
Можно сказать, что спектр атома — это его «паспорт». Исследуя свечение раскалённых газов в спектроскопе, можно обнаружить ничтожнейшие примеси любого элемента, столь малые, что никакими другими способами обнаружить их нельзя. Кроме того, такой, как говорят, «спектральный анализ» позволяет делать заключение о наличии примесей элементов в очень короткие сроки, гораздо быстрее, чем это можно сделать любым другим путём.
Поэтому спектральный анализ имеет большое значение в науке и технике и в ряде случаев незаменим.
Ещё в прошлом веке были учёные, утверждавшие, что люди никогда не узнают, из чего состоят звёзды. Но вот был открыт спектральный анализ, позволяющий делать это так же уверенно, как если бы звёзды находились «в наших руках». Больше того, инертный газ гелий был впервые открыт на Солнце!
На этом примере мы ещё раз убеждаемся в том, что нет границ для нашего познания.
Возможность движения электрона только по разрешённым орбитам делает атом устойчивым, сообщает ему «твёрдость».
Вот атом получил удар от соседнего атома или электрона. Он начинает двигаться. Но если энергия, переданная ему при ударе, меньше энергии, необходимой для возбуждения атома, то-есть для подъёма одного из электронов на ближайшую свободную удалённую орбиту, то все электроны останутся на своих орбитах.
Совсем иначе вёл бы себя атом, если бы любые пути для электрона были возможны. Самый лёгкий толчок, хотя незначительно, но менял бы орбиты электронов. Атом был бы «мягким», то-есть легко менял бы своё строение от любого слабого толчка.
В действительности атом не меняет своего строения до тех пор, пока не получит достаточно сильного удара. Слабые удары «не оставляют на нём следов». Атом ведёт себя, как твёрдая частичка.
Таким образом, существование разграниченного ряда разрешённых орбит обеспечивает «твёрдость» атома.
Насколько «твёрд», казалось бы, очень хрупкий атом, можно видеть из того, что при обычных температурах атомы газа, сталкиваясь, не возбуждаются. А вы помните, как велики скорости движения частичек газа.
Представьте себе столкновение двух стальных ядер, несущихся навстречу друг другу со скоростью в несколько сотен метров в секунду. Что будет с ними после удара? Они разобьются вдребезги! Атомы с их тончайшей электронной оболочкой оказываются «крепче» стальных ядер! Поэтому представление о газе как о множестве твёрдых частичек, вплоть до значительных температур газа, правильно.
Однако при дальнейшем повышении температуры скорость частичек настолько увеличивается, что энергии, передаваемой ими друг другу при столкновении, становится достаточно для возбуждения. Возбудившиеся частички отдают приобретённый ими излишек энергии в виде фотонов — газ начинает светиться.
Так происходит в газе превращение тепловой энергии в световую. Точно так же происходит превращение электрической энергии в световую, когда через газ проходит электрический ток; только в этом случае возбуждение атомов производится ударами быстрых электронов.