ТЕХНОЛОГИЯ ПРОИЗВОДСТВА УРАНА
Сырьевые источники урана
Среднее содержание урана в земной коре 3-10_4% (по массе). Урановые минералы встречаются на всех стадиях эндогенного (первичного) минералообразования: магматической, пегматитовой и гидротермальной. Кроме того, уран встречается преимущественно в высшей степени окисления, в экзогенных и метаморфогенных месторождениях. Известно
Около 200 минералов урана. Они представлены соединениями четырехвалентного урана (преимущественно оксидами) и шестивалентного урана (соли уранила).
К важнейшим минералам группы оксидов относятся уранит U02 и настуран (или урановая смолка) U3Og. По современным воззрениям они представляют одну минеральную фазу переменного состава UOx, где х изменяется от 2 до 2,6.
Содержание урана в уранините колеблется от 46,5 до 88,2 %. Обычно присутствуют также 0,1 - 3 % и более Th02, 1 - 2 % и более лантаноидов, а также продукты радиоактивного распада урана.
К другим минералам группы оксидов относятся бранне - рит — титано-силикат (U, Ca, Fe2+, Th)3(Ti, Si)5016 и да - видит — минерал сложного состава (Fe2+, Се, U)(Tif+ Fe3+ Uj+Cr3+)3(0,0H)7.
К группе экзогенных минералов, образующихся на земной поверхности, оїносятся:
Карнотит - уранилванадат калия K2(U02)2(V04)2 • лН20; тюямунит - уранилванадат кальция Ca(U02)2(V04)2 • лН20; отенит - Ca(U02)2(P04)2 • (Р04)2 • лН20; торбернит - Cu(U02)2(P04)2 • лН20.
Среди эндогенных месторождений наибольшее значение имеют гидротермальные, в которых уран представлен в основном настураном и браннеритом.
Экзогенные месторождения также являются важным промышленным источником урана. Во многих из них уран тесно ассоциируется с органическими соединениями (битумы, угли), молибденом, ванадием, селеном. Кроме того, уран легко задерживается всеми фосфатными образованиями (фосфориты, костные остатки рыб и др.).
Наиболее крупные месторождения урана в капиталистических и развивающихся странах расположены в Канаде, США, ЮАР, Австралии, Намибии, Нигере, Франции, Испании, Португалии. Запасы урана в месторождениях оцениваются примерно в 5 - бмлн. т. Мировое производство (в пересчете на металл) в 1984 - 1985 г. г. находилось на уровне 35 - 39 тыс. т.
Извлечение урана из руд
Конечными продуктами переработки рудного сырья являются чистые химические соединения, из которых получает металлический уран. Технология производства химических соединений из рудного сырья, как правило, состоит из двух стадий: получения технического продукта — "химического концентрата" и очистки (аффинажа) с получением необходимых соединений высокой чистоты.
Продукты первой стадии — преимущественно октаоксид триурана (закись — окись) U3Og, диуранат натрия Na2U207 или аммония (NH4)2U207. Исходным соединением для производства урана большей частью служит тетрафторид урана UF4.
Урановые руды обычно бедные (0,005 — 0,5 % U3Og). Механические методы обогащения (радиометрическая сортировка, разделение в тяжелых суспензиях, гравитационные методы, флотация) имеют ограниченное применение и редко приводят к получению богатых концентратов.
Для извлечения урана большей частью применяют способ выщелачивания его из руды растворами минеральных кислот или соды. Выщелачиванию иногда предшествуют подготовительные операции обжига руды (с целью удаления органических составляющих, окисления сульфидов, удаления мышьяка, разложения карботанов, "пассивирования" оксидов железа). В результате выщелачивания получают бедные растворы, содержащие 0,5 — 2г/п урана. Для извлечения и концентрирования урана большей частью применяют сорбцию на ионообменных смолах или жидкостную экстракцию.
Выщелачивание кислотами. Выщелачивание кислотами наиболее широко используют в промышленной практике. Большей частью применяют серную кислоту, смеси серной и азотной кислот (меланж), а иногда одну азотную кислоту. Выщелачивание кислотами невыгодно применять из руд, содержащих большие количества карбонатов (кальция, доломита, магнезита, сидерита и др.) вседствие повышенного расхода кислоты. В этих случаях выгоднее выщелачивание растворами соды. При обработке руд, содержащих уранинит и урановую смолку, выщелачивание серной кислотой проводят в присутствии окислителя — пиролюзита (Мп02) или хлората натрия (NaCIOj). Окисление ускоряется в присутствии ионов железа; механизм их действия можно представить реакциями:
U02 + 2Fe3+ = UOf + 2Fe2+; (13.3)
2Fe2+ + Мп02 + 4Н+ = 2Fe3+ + Мп2+ + 2Н20. (13.4)
Выщелачивание проводят на холоду или при подогреве до 40 - 50 С. Повышение температуры увеличивает расход кислоты. Процесс обычно ведут в непрерывном режиме в каскаде выщелачивателей с механическим или воздушным перемешиванием (аппараты типа "Пачук"). К концу выщелачивания значение рН раствора поддерживают в интервале 1-2, что примерно соответствует концентрации свободной кислоты 3 - 7 г/л.
Выщелачивание растворами Na2C03. Выщелачивание растворами соды основано на образовании шестивалентнын ураном растворимых комплексных солей состава Na4[U02(C03)3].
Наиболее легко растворяются в растворах Na2C03 минералы, представляющие собой соли уранила. Труднорастворимы сложные силикатные минералы. Первичные минералы - уранинит, урановая смолка - растворяются в присутствии окислителя.
Выщелачивание растворами Na2C03 имеет ряд преимуществ перед выщелачиванием кислотами; растворы Na2C03 избирательно выщелачивают уран, поэтому растворы содержат мало примесей; выщелачивание можно проводить в аппаратуре из простой стали; его можно применять к рудам с высоким содержанием карбонатов, обработка которых кислотами не выгодна.
Недостатком выщелачивания растворами Na2C03 является, как правило, более низкое извлечение в растворы, чем при кислотном выщелачивании.
Основные реакции, протекающие при выщелачивании растворами Na2C03:
U03 + 3Na2C03 + Н20 *=*Na4[U02(C03)3] + 2NaOH; (13.5) U02 + 3Na2C03 + l/202 + H20 ї=± Na4[U02(C03)3] +
+ 2NaOH. (13.6)
Как видно из реакций (13.5) и (13.6), в процессе реагирования накапливается щелочь, что может привести к осаждению малорасхворимого диуранаха нахрия. Для нейтра - лизации щелочи выщелачивание ведух смесью карбонаха и би- карбонаха нахрия (5-10% Na2C03 и ох 1 до 7% NaHC03).
В качесхве окислихеля большей часхью использую! воздух или обогащенный кислородом воздух. Выщелачивание руд растворами соды проводят в аппаратах с механическим перемешиванием при атмосферном давлении при температурах 70 - 90 С или в автоклавах при 115 - 140 °С (для руд, содержащих первичные минералы).
Извлечение урана из растворов
Растворы выщелачивания обычно содержат 0,5 - 2 г/л урана. Растворы кислотного выщелачивания имеют рН = 1+2 и содержат ряд примесей (соли Fe, Al, Си, Ni, Mn и др.). Для извлечения урана из кислых растворов в настоящее время в основном используют сорбцию на ионообменных смолах. Применяют сильноосновные аниониты, у которых активными группами служат четвертичные аммониевые основания. В сернокислых растворах уран находится преимущественно в составе аниона [U02(S04)3]4-. При использовании смолы в нитратной форме сорбция описывается уравнением:
40?4N)NO3+[UO2(SO4)3]4" *=*0?4N)4[UO2(SO4)3]+4NO;. (13.7)
Полная обменная емкость смол различных марок по урану находится в пределах 150 - 300 мг урана на 1 г сухой смолы. Рабочая емкость зависит от рН, концентрации урана, примесей других элементов. Для растворов с концентрацией урана 1 г/л в интервале рН = 1+3 рабочая емкость колеблется от 40 до 100мг/1 г сухой смолы.
Десорбцию урана со смолы большей частью проводят 0,9 - 1м растворами нитрата аммония, содержащими 0,1 М HN03. Получают растворы, содержащие 20 - 60 г/ л урана (степень концентрирования в зависимости от концентрации урана в исходном растворе 50 - 200). Из растворов осаждают аммиаком малорастворимый диуранат аммония. Прокаливанием диураната при 650 - 850 °С получают U3Og - химический концентрат. Ионообменную сорбцию на анионитах используют также для извлечения урана из карбонатных щелоков, из которых сорбируются карбонатные комплексы:
4(fl4N)N03 + [U02(C03)3]5^(R4N)4[U02(C03)3] + 4N03.(13.8)
С увеличением избыточной концентрации соды от 1 до Юг/л обменная емкость смол понижается от 274 до 190мг U308 на 1 г смолы вследствие конкуренции ионов СО|". Десорбцию урана со смолы осуществляют в этом случае раствором нитрата натрия. Кислые элюирующие растворы не применяют вследствие выделения С02 и разрыхления смолы.
Для получения уранового концентрата элюаты подкисляют до рН = 3+4, что приводит к разрушению уранилкарбонатного комплекса. Затем из кислого раствора осаждают диуранат аммония.
С целью исключения операций отстаивания и фильтарации пульп ионообменную сорбцию осуществляют •непосредственно из пульп в каскаде аппаратов с пневматическим перемешиванием и аэролифтной транспортировкой смолы и пульпы (рис.
Воздух
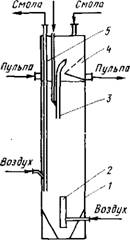
94). Сорбцию ведут из плотных пульп (Т:Ж = 1:1). Используют механически прочные пористые смолы с зернами размерами 0,5 - 1,5 мм, которые должны превосходить крупность частиц рудной пульпы.
Рис.94. Схема аппарата для непрерывного процесса ионнообменной сорбции из пульп: 1 - корпус; 2 - аэролифт для перемешивания; 3 - аэролифт для транспортировки пульпы; 4 - разделительный элемент; 5 — аэролифт для транспортировки смолы
Для осветленных растворов (после сгущения и фильтрации) вместо ионообменной сорбции для извлечения и концентрирования урана можно использовать жидкостную экстракцию. Эффективными экстрагентами для извлечения урана из сернокислых растворов являются Д2ЭГФК - HLR2P04 и соли аминов. Эти экстрагенты используют в виде растворов в керосине, причем Д2ЭГФК находится в растворе в форме диме - ра. Экстракция Д2ЭГФК протекает по механизму катионного обмена:
UOf + 2(НЯ2Р04)2 = и02(Я2Р04)2 • 2H^P04 + 2Н+. (13.9)
Экстракцию можно вести из растворов с рН = 0,5-5-4. Основной конкурент - ионы Fe3+, которые предварительно восстанавливают до Fe2+. Реэкстракцию урана проводят контактом органической фазы с 10 н. НС1 или растворами карбоната натрия или аммония.
Экстракция урана из сернокислых растворов солью амина может протекать в зависимости от кислотности и концентрации ионов SO2- по механизму присоединения или ионного обмена:
(*2NH)2S04 + U02S04 (*3NH)2U02(S04)2; (13.10)
(^nh)2SO4 + [U02(S04)2]2~
(*3NH)2U02(S04)2 + SO2'. (13.11)
Экстаракцию ведут из растворов с рН < 3. Реэкстракция легко осуществляется растворами нитратов, хлоридов или соды.
Преимущества аминов перед Д2ЭГФК состоят в большей избирательности в отношении урана. Главный недостаток солей аминов - неприменимость их для экстракции плохо осветленных растворов вследствие адсорбции ионов на твердых частицах. Между тем алкилфосфорные кислоты могут быть использованы даже для экстракции из пульп. Экстрацию проводят в каскаде смесителей-отстойников или пульсационных колоннах.
Очистка концентратов
В рассмотренных выше процессах извлечения урана из руд получают концентраты в виде U3Og или Na2U207. Они содержат 65 — 80% U3Og и ряд примесей. Для производства урана, используемого в ядерных реакторах, необходимы соединения высокой чистоты. Особенно вредными являются примеси бора, лития, кадмия, лантаноидов, имеющих высокие значения сечения захвата тепловых нейтронов.
На рис. 95 приведена распространенная схема очистки химических концентратов. Конечным продуктом является триоксид урана высокой чистоты, из которого получают тетра - фторид урана.
Исходные продукты
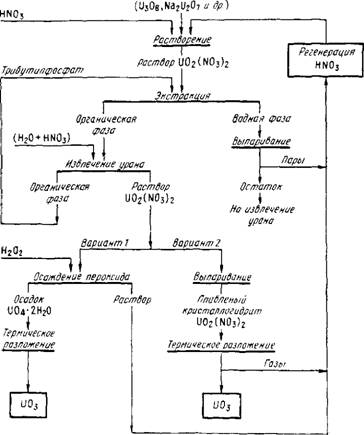
Ржс.95. Технологическая схема вариантов очистки химических урановых концентратов с получением чистого триоксида урана
Схема включает операции:
Растворение концентрата в азотной кислоте с получением растворов Шг(Ш3)2 (200 - 270 г/л);
Экстракционную очистку, в результате которой получают растворы нитрата уранила.
Дальнейшую переработку очищенных растворов проводят по двум вариантам:
А) из очищенных нитратных растворов путем выпарки кристаллизуют нитрат U02(N03)2 • 2Н20. Нитрат термически разлагают при 300 — 400 С, получая триоксид урана U03;
Б) из нитратного слабокислого раствора, с целью дополнительной очистки, осаждают пероксидом водорода пероксид урана U04 • 2Н20. Прокаливанием последнего при 400-500 °С получают чистый триоксид урана.
Для экстракционной очистки нитратных растворов широко используют ТБФ, образующий с уранилнитратом дисольват:
UOf + 2N07 + 2ТБФ U02(N03)2 • ТБФ. (13.12)
Коэффициент распределения урана Dy уменьшается с увеличением концентрации урана и возрастает пропорционально квадрату концентрации нитрат-ионов и ТБФ. Трибутилфосфат обладает высокой избирательной экстракционной способностью по отношению к уранил-нитрату: Коэффициенты распределения большинства примесей имеют малые значения. Экстракцию ведут из растворов с концентрацией урана 250 - 400 г/л и концентрацией HN03 3 - 5 м/л. Обычно используют 30 - 40 %-ный раствор ТБФ в керосине.
Уран реэкстрагируют из органической фазы слабыми растворами азотной кислоты. Экстракцию проводят в каскаде смесителей-отстойников или в колоннах экстракторах с наложением пульсаций.
Полученные реэкстракты, содержащие 70 - 100 г/л урана (в виде уранил-нитрата), далее, как указано выше, поступают либо на осаждение пероксида, либо на выпарку и кристаллизацию уранил-нитрата.
Получение тетрафгорида урана
В промышленной практике VF4 получают фторированием диоксида урана фтористым водородом. Исходным соединением служит чистый триоксид урана, который восстанавливают водородом до диоксида:
О
450-600 С
Иоз + Н2 U02 + Н20 + 98,3 кДж; (13.13)
О
450-500 С
U02 + 4HF > UF4 + 2Н20 + 192 кДж. (13.14)
Известны варианты проведения процессов, описываемых реакциями (13.13) и (13.14). Они могут проводиться в трубчатых печах со шнековьш перемещением материала или в печах кипящего слоя.
Трубы печей и шахту печи КС для стадии восстановления изготовляют из нержавеющей стали, а для стадии фторирования — из сплавов никеля с медью (монель, инконель). Ниже приведен примерный состав получаемого фторида урана, %: UF4 96,2; U02F2 2,0; U02 1,8. Содержание примесей в UF4 следующее, %: Fe 5,5 • Ю-3; Ni 3,5 • 10"3; Сг 9 • 10~4; Мп < 1 • Ю-3; Cd 1 • Ю-5; Mo < 1 • Ю-3.
Производство урана
Известны следующие методы получения урана:
Восстановление оксидов урана кальцием или гидридом кальция;
Восстановление тетрафторида или тетрахлорида урана Кальцием или магнием;
Электролиз галоидных солей в расплавленных средах.
В результате восстановления оксидов, а также при электролизе расплавленных сред получают порошкообразный металл, который отделяют от оксидов и солей обработкой водой и кислотами. Между тем в результате металлотермичес - кого восстановления галоидных солей уран получают в форме слитка, хорошо отделяющегося от шлака, что представляет существенные преимущества и объясняет более широкое применение металлотермии галогенидов.
Хлорид урана UCl4 в отличие от фторида весьма гигроскопичен, что затрудняет работу с ним. Кроме того, хлорид кипит при 800 °С, что требует проведения восстановления в герметичном аппарате. Ввиду этого производство урана базируется преимущественно на восстановлении тетрафторида урана.
Восстановление тетрафторида урана кальцием
При восстановлении тетрафторида урана кальцием по реакции:
UF4 + 2Са = U + 2CaF2 + 575 кДж (13.15)
Выделяется около 1465 кДж на 1кг смеси UF4 + 2Са. Тепла 404
Достаточно для самопроизвольного протекания реакции и поддержания температуры, при которой металл и шпак (CaF2) находятся в расплавленном состоянии. Для этого необходима температура 1450 °С (CaF2 плавится при 1418 °С). Восстановление можно проводить при атмосферном давлении, так как температура кипения кальция сравнительно высока (1420 °С). Восстановление проводят в тиглях из нержавеющей стали, футерованных чистым фторидом кальция. Для восстановления применяют кальций, очищенный дистилляцией в вакууме, в виде стружки толщиной 2 - Змм. Восстановитель вводят в шихту с избытком ~20 % от стехиометрического. Смесь либо непосредственно засыпают в тигель и слегка утрамбовывают, либо предварительно брикетируют.
Шихту зажигают с помощью электрической искры или зажигают запальную смесь (например, пероксид натрия с магниевым порошком), помещаемую в верхней части шихты. Реакция быстро распространяется по всей шихте. Металл стекает вниз, образуя слиток, хорошо отделяемый от шлака. Этим способом получают слитки урана массой 100 кг и больше.
Выход урана в слиток составляет 98 - 99%. Содержание примесей в слитках следующее, %: Fe 0,02 - 0,005; Si 0,01 - 0,05; Ca 0,002 - 0,005; Mn 0,001 - 0,0005; H 3 - 5см5 на 100 г металла.
Восстановление тетрафторида урана магнием
Условия восстановления UF4 магнием отличаются от описанных выше для кальциетермического процесса.
Тепловой эффект реакции
UF4 + 2Mg = U + 2MgF2 + 372 кДж (13.16)
Примерно на 205 кДж ниже, чем при восстановлении кальцием. На 1кг смеси UF4 + 2Mg выделяется 1028 кДж. Этого тепла недостаточно для расплавления продуктов реакции, поэтому необходимо нагревать весь реактор с шихтой до температуры зажигания.
Точка кипения магния (1105 °С) ниже температуры плавления шлака (MgF2 плавится при 1260 °С). Поэтому необходимо проводить восстановление в герметичном аппарате (типа бомбы) под давлением паров магния.
Вместе с тем, магний обладает некоторыми преимуществами. Магний более устойчив на воздухе. Выпускаемый промышленностью магний высокой чистоты содержит меньше вредных для урана примесей. Магний легче кальция и весовой расход его на 1 т урана в 1,6 раза ниже, чем кальция.
Восстановление проводят в стальных тиглях, изготовленных из цельнотянутых труб диаметром 325 - 390 мм. Высота тиглей 915 - 1145 мм. Тигли футеруют фтористым магнием, их герметично закрывают крышкой. Порошок магния с размером частиц ~2 мм смешивают с UF4 (избыток магния 4—5 %). Тигель, заполненный шихтой и герметично закрытый, устанавливают в газовой печи (снаружи оставляют только крышку). При нагревании шихты до 550 - 700 С инициируется реакция, которая заканчивается примерно за 1 мин.
Слиток легко отделяется от шлака. Выход металла достигает 98 %. В тиглях диаметром 325 мм за одну плавку получают слиток массой 100 кг.
Освоен процесс магниетермического восстановления UF4 с одновременной загрузкой 2 т фторида урана. Получают слитки массой 1225 кг (диаметр слитка ~ 445 мм, высота 432 мм). Большая величина загрузки обусловливает медленное охлаждение и хорошее отделение металла от шлака. Такие слитки не требуют вакуумной переплавки и могут непосредственно направлять на обработку давлением.
Плавка урана
В результате металлотермического восстанвления фторида урана кальцием или магнием получают слитки, которые плавят в вакуумных индукционных печах с использованием тиглей из чистого плотного графита. В процессе плавки удаляются примеси кальция, магния, фтора, водорода, отчасти азота и кислорода.
На рис. 96 приведена схема такой индукционной печи. После создания вакуума и расплавления металла (температура плавления урана ИЗО °С) его отливают в графитовую изложницу через клапан в дне тигля. Расплавленный уран медленно реагирует с плотным графитом в вакууме. Кроме того, небольшая смесь графита в металле безвредна, поскольку графит служит замедлителем в ядерном реакторе. Однако механические свойства урана в значительной мере зависят от содержания в нем примеси углерода. 406
Ріс.96. Схема вакуумной индукционной печи для плавки урана: 1 - основание изложницы; 2 - нижняя часть изложницы; і - перегородки в рубашке охлаждения; 4 - держатель изложницы; 5 - держатель огнеупорного экрана; 6 - кольцевое основание тигля; 7 - ползун для поднятия донной пробки; 8 - кольцо для поддержания муфты из оксида циркония; 9 - изоляционная муфта из диоксида циркония; 10 - опора тигля; 11 - индуктор; 12 - смотровое окно; 13 - верхняя иэоляциовная крышка; 14 - экран из оксида циркония; 15 - крышка тигля; 16 - графитовый тигель; 17 - пробка; 18 - изоляционное основание; 19 - верхняя часть изложницы; 20 - рычажное соединение; 21 - донная футеровка; 22 - рубашка изложницы
Ниже приведен типичный состав урана после вакуумной плавки, %:
С 4 ■ 10"2; Н 1 • Ю-4; С1 5 • 10"4; Si 5 • КГ3; N, Fe, Ni, Cr 5- Ю-3; Мп 1,3 • Ю-3; В, Cd, 2 • 10"5; Mg 5 • Ю-4; Ag < 1 • Ю-4.
Плавку урана и сплавов на его основе можно проводить в дуговых печах с расходуемым электродом, устройство которых рассмотрено в гл.1.