ТЕХНОЛОГИЯ ПРОИЗВОДСТВА СОЕДИНЕНИЙ БЕРИЛЛИЯ ИЗ БЕРИЛЛОВЫХ КОНЦЕНТРАТОВ
Берилловые концентраты перерабатывают обычно на оксид или гидроксид бериллия, из которых затем получают фторид или хлорид бериллия - исходные материалы для производства бериллия.
В промышленной практике применяют сульфатный и фторид - ный способы переработки концентратов.
Сульфатный способ
Этот способ основан на переводе бериллия вместе с алюминием и железом в сернокислый раствор с оставлением основной массы диоксида кремния в нерастворимом остатке. Поскольку берилл медленно реагирует с концентрированной серной кислотой даже при 200 - 250 °С, проводят подготовительные операции сплавления концентрата с известью или термическое активирование берилла.
Сплавление с известью. Концентрат плавят с известью в электродуговых печах при 1500 - 1600 °С. Ориентировочно протекающий процесс описывается реакциями:
Be3Al2(Si6018) + 7СаО) = 3CaBeSi04 + Са0-А1203 +
+ 3CaSi03; (9.1)
CaBeSi04 = ВеО + CaSi03. (9.2)
Расплав гранулируют в воде и гранулы измельчают. Образующиеся в результате плавки соединения хорошо разлагаются серной кислотой.
Термическое активирование берилла. Способ заключается в плавке концентрата при 1700 °С в дуговой печи с последующим быстрым охлаждением плава (закалкой) грануляцией в холодной проточной воде. При этом берилл претерпевает структурные превращения, активирующие его взаимодействие с серной кислотой. Для более полного перехода бериллия в сернокислый раствор (90 - 95 %) гранулы отжигают при 900 °С в барабанной печи с целью распада твердого раствора ВеО в Si02.
Преимущества термического активирования перед плавкой с известью заключаются в меньшем расходе серной кислоты, которую в этом случае не приходится использовать на взаимодействие с соединениями кальция.
Сульфатизация и выщелачивание. Для перевода бериллия и других компонентов в сульфаты измельченный гранулированный материал обрабатывают концентрированной серной кислотой при 150 - 200 °С в стальных реакторах. Затем полусухую массу выщелачивают водой при нагревании. В раствор
переходят сульфаты бериллия, алюминия, железа, магния. Примерный состав растворов, г/л: ВеО 32; А1203 35; Fe203 2-3.
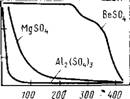
Очистка растворов и выделение гидроксида бериллия. Из сульфатных растворов первоначально выделяют большую часть алюминия *в виде алюмоаммонийных квасцов (NH4)2S04- • Al2(S04)3 • 24Н20, образующихся при добавлении избытка сульфата аммония в горячий сульфатный раствор. После охлаждения из раствора выделяется в кристаллы квасцов 70 - 75 % алюминия (рис. 78), а также вместе с ним большая
M I 200
£
100
Є
(о
Ржс.78. Зависимость растворимости сульфатов g алюминия, бериллия и магния от концентрации сульфата аммония
Часть CaS04. Оставшийся в растворе алюминий, а также железо [после окисления Fe(ll) до Fe(lll)] выделяются в виде гидроксидов при рН = 3,8 + 4,2.
Из очищенного раствора выделяют Ве(ОН)2 двумя способами:
Прямым осаждением Ве(ОН)2, добавлением щелочи или пропусканием аммиака. При рН = 7,5 и нагревании раствора до 95 - 98 °С выделяются хорошо фильтруемые осадки Ве(ОН)2 (/З-форма);
Гидролитическим разложением бериллата натрия, полученного при добавлении в раствор сульфата избытка гидроксида натрия:
BeS04 + 4NaOH = Na2Be02 + Na2S04 + 2H20; (9.3)
Na2Be02 + 2Н20 = Be(OH)2 + 2NaOH. (9.4)
При кипячении раствора в результате гидролиза бериллата натрия выделяется зернистый осадок гидроксида бериллия. При поддержании рН = 11,5 выход гидроксида бериллия в осадок максимальный.
(NHJ, SO,, г/л
Для удержания в растворе примесей железа и алюминия добавляют в холодный раствор комплексующий реагент, например соль этилендиаминтетрауксусной кислоты (ЭДТА), связывающую железо и алюминий в прочные внутрикомплексные соединения.
Полученный технический гидроксид бериллия служит исходным материалом для получения чистого оксида бериллия и солей бериллия. Из него также получают прокаливанием при 700 - 800 °С технический оксид бериллия.
Фторидный способ
Этот способ основан на вскрытии берилла с помощью комплексных фторидов: Na2SiF6 и Na3FeF6. В результате взаимодействия берилла при температурах 750 - 800 °С с комплексными фторидами образуется растворимый в воде фто - робериллат натрия Na2BeF4. Соединения других элементов, содержащиеся в продукте спекания, малорастворимы в воде.
При использовании Na2SiF6 в шихту вводят соду, чтобы предотвратить термическое разложение части фторосиликата натрия и потерю SiF4. В этом случае взаимодействие при спекании описывается реакцией:
Be3Al2(Si60lg) + 2Na2SiF6 + Na2C03 = = 3Na2BeF6 + Al203 + 8Si02 + C02. (9.5)
В последующем процесс был усовершенствован заменой части кремнефторида натрия железным криолитом Na3FeF6, избирательно взаимодействующим с оксидом бериллия:
Be3Al2(Si60lg) + 2Na3FeF6 = = 3Na2BeF4 + Al203 + Fe203 + 6Si02. (9.6)
Важное преимущество процесса состоит в том, что железный криолит осаждают из маточного раствора от выделения гидроксида бериллия, содержащего NaF, добавлением сульфата железа
12NaF + Fe2(S04)3 = 2Na3FeF6 + 3Na2S04. (9.7)
В производственных технологических схемах шихту для спекания составляют в расчете на реакцию (9.5) либо, кроме Na2SiF6 и Na2C03, в нее вводят Na3FeF6, заменяя этим реагентом около 80 % фторосиликата натрия.
318
Спекание ведут в барабанных или туннельных печах при 750 - 800 °С. Измельченные спеки выщелачивают водой на холоду (при нагревании часть Si02 растворяется). Растворы содержат лишь небольшое количество примесей железа и алюминия, поэтому из них выделяют гидроксид бериллия без предварительной очистки.
Для получения зернистого гидроксида бериллия ((З-форма) в раствор фторобериллата вводят избыток щелочи для обра - вания Na2Be02:
Na2BeF4 + 4NaOH = Na2Be02 + 4NaF + 2H20. (9.8)
Затем раствор разбавляют и кипятят, при этом в результате гидролиза выделяется Ве(ОН)2. Преимущества фторидного способа перед сульфатным заключаются в более короткой схеме, проведении вскрытия при относительно низкой температуре и получении чистых растворов, из которых без предварительной очистки выделяют гидроксид бериллия. Недостаток способа - более высокие затраты на реагенты.
Получение чистого оксида бериллия
Для получения оксида бериллия высокой чистоты, применяемого в ядерной энергетике и производстве огнеупорных изделий, технический гидроксид очищают, используя различные способы.
Карбонатно-аммонийный способ очистки основан на растворении гидроксида бериллия в насыщенном растворе карбоната аммония, тогда как гидроксиды алюминия и железа нерастворимы в них.
Дополнительная очистка от следов тяжелых металлов достигается осаждением сульфидов. При кипячении раствора комплексный карбонат (NH4)2[Be(C03)2] разлагается с выделением основного карбоната бериллия. Прокаливанием последнего получают оксид бериллия.
Эффективен ацетатный способ очистки, который заключается в возгонке оксиацетата бериллия Ве40(СН3С00)6 при 360 - 400 °С. В некоторых схемах чистый оксид получают через кристаллогидрат сульфата бериллия BeS04-4H20, который кристаллизуют выпариванием из сульфатного раствора. Кристаллы BeS04 • 4Н20 очищают перекристаллизацией. Затем термическим разложением сульфата бериллия при 1100 °С получают чистый оксид бериллия.
Получение фторида и хлорида бериллия
Исходными соединениями для производства бериллия преимущественно служат фторид и хлорид бериллия.
Фторид бериллия. Соль получают термическим разложением фторобериллата аммония (NH4)2BeF4. Гидроксид бериллия растворяют в растворе бифторида аммония при нагревании. Прочность фторобериллатного комплекса столь велика, что можно изменять рН раствора в широких пределах (до рН = = 11) без осаждения Ве(ОН)2. Это позволяет выделить из раствора примеси железа и алюминия при рН = 8,3.
Из раствора со стехиометрическим соотношением NH4F : BeF2 = 2 : 1 в процессе вакуумной выпарки кристаллизуется фторобериллат.
Кристаллы (NH4)2BeF4 разлагают при температурах 900 - 1100 °С (выше точки плавления BeF2) в графитовых тиглях, помещаемых в индукционную печь. В результате разложения получают стекловидный фторид бериллия. Разработаны непрерывные варианты проведения процесса.
Высокая токсичность соединений бериллия требует проведения операции в герметизированной аппаратуре. Газообразный фторид аммония улавливают в скруббере и электрофильтре. Растворы, содержащие фторид аммония, используют для растворения гидроксида бериллия. Получаемый фторид бериллия содержит 0,02 % АІ, 0,02 % Fe и 0,01 %Si.
Хлорид бериллия. Хлорид бирилЛия получают хлорированием оксида бериллия хлором в присутствии углерода или взаимодействием ВеО с тетрахлоридом углерода:
О
900-1000 С
ВеО + С + С12 > ВеС12 + СО,
AGJoook = - 53,5 кДж; (9.9)
О
650-700 С
ВеО + 1/2 СС14 ВеС12 + 1/2 С02,
AGW = "64,7 кДж. (9.10)
Хлорируют брикетированную шихту ВеО + С (при хлорировании хлором ) или брикеты ВеО (при хлорировании СС14) в хлораторах шахтного типа.
Образующийся при хлорировании газообразный хлорид бериллия улавливается в конденсационной системе. Поддерживая различную температуру в последовательно установленных конденсаторах, можно осуществить фракционную конденсацию ВеС12 и летучих хлоридов примесей в соответствии с их температурами кипения, °С: ВеС12 492, FeCl3 319, Al2Cl6 183, SiCl4 58.
Однако при этом происходит неполное отделение примесей. Поэтому хлорид бериллия очищают повторной дистилляцией при 500 - 550 °С в атмосфере водорода. Последний восстанавливает FeCl3 до нелетучего FeCl2.
3. ТЕХНОЛОГИЯ ПРОИЗВОДСТВА БЕРИЛЛИЯ
Оксид бериллия не используют в качестве исходного соединения для получения металлического бериллия вследствие высокой его термодинамической прочности (AG29gK = -586 кДж). При восстановлении ВеО кальцием получается металл, загрязненный кальцием из-за образования бериллида СаВе13. Получать металл из ВеО восстановлением углеродом также невозможно, так как образуется карбид бериллия.
В настоящее время бериллий получают двумя способами: восстановлением фторида бериллия магнием и электролизом из хлоридного электролита.
Магниетермическое восстановление фторида бериллия
Для металлотермического восстановления из галогенидов бериллия предпочитают фторид, который обладает высокими температурами плавления (803 °С) и кипения (1327 °С). Это позволяет проводить восстановление при атмосферном давлении с подъемом температуры выше температуры плавления бериллия (1283 °С) и обеспечивает легкое отделение металла от шлака. В качестве восстановителя используют магний, не образующий с бериллием соединений и твердых растворов:
BeF2 + Mg = Be + MgF2; &G°IOOOK = -118 кДж. (9.11)
Восстановление ведут в графитовых тиглях, нагреваемых в индукционных печах. В качестве флюса для защиты от окисления, не вносящего дополнительных примесей, используют смесь MgF2 и BeF2. С этой целью в шихту вводят магний в количестве 75 % от стехиометрического. Оставшийся
Избыточный BeF2 входит в состав флюса. Под флюсом можно проводить процесс в негерметизированной печи, однако для получения более чистого металла целесообразно заполнять печь инертным, газом.
Восстановление проводят при 900 - 1000 °С. Затем температуру повышают до 1300 °С (выше точки плавления бериллия). При этом корольки бериллия всплывают на поверхность флюса и собираются в единый слиток ("линзу"). При охлаждении тигля бериллий затвердевает раньше шлака, что позволяет извлечь слиток бериллия из расплавленного шлака щипцами. После этого шлак сливают в графитовую изложницу через летку у дна тигля. Шлак с поверхности слитков бериллия удаляют, обрабатывая слитки в воде во вращающихся барабанах.
Из измельченного шлака BeF2 извлекают выщелачиванием раствором фторида аммония, раствор поступает в цикл производства BeF2.
Нерастворимый остаток содержит фторид магния, используемый в последующих операциях восстановления. Полученные слитки бериллия содержат до 1,5 % Mg, около 0,1 % ВеО, ~0,1 % Fe, А1 и другие примеси. Его подвергают рафинированной вакуумной переплавке при 1500 - 1500 °С. Плавку ведут в тиглях из оксида бериллия в индукционных печах с отливкой в графитовые изложницы. Переплавленный бириллий характеризуется следующим содержанием примесей, %: Fe 0,05 - 0,1; А1 0,02 - 0,03; Si 0,01 - 0,03; Mn 0,01 - 0,02; Mg 0,03 - 0,05; Си 0,003 - 0,005; Ni 0,003 - 0,005.
Дополнительно очистить бериллий от дисперсных включений карбида и оксида бериллия, шлака можно вакуумной переплавкой, совмещенной с центробежным литьем.
Получение бериллия электролизом
Промышленный способ электролитического получения бериллия основан на использовании хлоридного электролита, содержащего ВеС12 и NaCl в соотношении 1:1 (по массе). Это соотношение близко к составу эвтектики (58,7% ВеС12+ + 41,3 % NaCl), плавящейся при 215 °С, что позволяет проводить электролиз при низкой температуре (около 350 °С).
Напряжение разложения ВеС12 в расплаве эвтектического состава при 420 °С равно 2,08 В. Электролиз ведут в электролизерах из никеля. Анодом служит графитовый стержень, катодом - никелевые сменные перфорированные тигли, вставляемые в ванну (рис. 79).
При использовании сменного катода первоначально проводят рафинирование электролита от примесей более электроположительных, чем бериллий (Си, Fe, Ni и др.), примерно при напряжении 1,5 В (т. е. ниже напряжения разложения ВеС12). Затем заменяют катод и повышают напряжение до необходимого для выделения бериллия на стенках тигля - катода в форме чешуек. Выделяющийся на аноде хлор удаляется
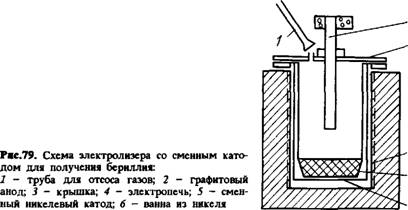
Через патрубок в крышке электролизера. Электролиз ведут при начальной катодной плотности тока ~0,1 А/см2 и анодной около 0,4 А/см2. Выход по току составляет 60 - 65%.
Катод с осадком бериллия извлекают из ванны в горячем состоянии. После охлаждения снятый с катода металл для отделения электролита промывают водой, раствором щелочи, разбавленной азотной кислотой, снова водой, центрифугируют и сушат.
' Чешуйчатый бериллий прессуют в брикеты на гидравлическом прессе, брикеты переплавляют в вакуумной печи в тиглях из оксида бериллия. Ниже приведено примерное содержание примесей в электролитическом бериллии после вакуумной переплавки, %: Fe 0,007; Al 0,003; Si 0,02 - 0,003: Ni 0,003; CI 0,002; Cu 0,002; Ca 0,003.