КОТЕЛЬНЫЕ УСТАНОВКИ И ПАРОГЕНЕРАТОРЫ
Химические потенциалы в растворах электролитов
Растворенные в воде примеси частично или полностью диссоциируют. Часть компонентов обладают электрическим зарядом е*:
, ЄІ — ,
Где Zi — зарядность (число, равное валентности); F — число Фарадея.
В электрическом поле с потенциалом <р ионы вещества подвергаются дополнительному воздействию, и это необходимо учитывать. Электрохимический потенциал pf'x объединяет воздействие химических и электростатических сил:
|
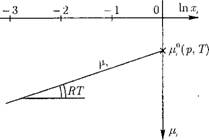
Рис. 12.10. Зависимость химического потенциала г-го вещества в идеальном водном растворе от мольной доли Хі. |
РГ + (12.28)
В общем случае диссоциация вещества может происходить не полностью. Рассмотрим процесс диссоциации вещества АтВп:
АтВп = тА^ + пВ~.
Константа диссоциации
Лш /~т
^д — гі
^Am В„
Степень диссоциации а показывает долю молекул вещества, подвергшихся диссоциации (Са,„Вп)дисс> к общему количеству Сл, пВп'
(Са7„в„) дисс Слгп в„
Концентрация катионов и анионов в воде
СА+ = таСАтв,,; С в - — п&Са^в,, •
С учетом степени диссоциации а электрохимический потенциал следует записывать в следующем виде:
/С* =/*»-(<* w). (12.29)
Знак «минус» перед вторым слагаемым поставлен потому, что при увеличении степени диссоциации (а > 0) возрастает хаотичность движения частиц, свободная энергия Гиббса и электрохимический потенциал становятся более отрицательными.