КОТЕЛЬНЫЕ УСТАНОВКИ И ПАРОГЕНЕРАТОРЫ
Химические потенциалы идеальных газов
Для идеального газа химический потенциал запишем в мольных единицах
H = h-Ts. (12.18)
Возьмем начальную точку р0, Т0, в которой энтропия имеет значение s(To). Стандартное значение химического потенциала в этой точке равно /і°(рсь То).
Для идеального газа энтропию при других значениях р и Т можно рассчитать по формуле
З(Т) = 5(То) + <pln( - ЙІііЦ). (12.19)
Где Ср — среднее значение изобарной теплоемкости, кДж/(моль-К); R — универсальная газовая постоянная, кДж/(моль-К).
Подставляем (12.19) в (12.18):
P = h-Ts(T0)--cpTn^)+RTn^) =/ЛГ) + ДГ1п(^), (12.20) где обозначено
Р°(Т) = ft - Тя(Т0) - cpT ln( J). (12.21)
Для идеального газа энтальпия является функцией только температуры, поэтому величина р?(Т) зависит только от температуры. Преобразуем (12.20):
/і = р°(Т) - RT lnpo + RTlnp = д*(ро, Т) + ДПпр. (12.22)
В стандартную величину р*(ро, Т) включено слагаемое, учитывающее начальное значение давления ро-
Рассмотрим смесь идеальных газов. Число компонент г = 1 — N, общее число молей п = ]Г пг» мольная доля г-го газа Х{ = щ/п. Введем обозначения: ро — давление смеси газов; pi — парциальное давление г-го газа; N
Ро = Y^Pi - Для идеальных газов парциальное давление можно выразить і
Через их мольные доли
= Pi — %iPo> (12.23)
В смеси идеальных газов каждый из них остается идеальным и для него справедливо выражение (12.20)
/іі=/і?(Г) + ДГ1П(^)1 (12.24)
Где в качестве начального давления ро принято давление, соответствующее давлению смеси ро-
Парциальное давление выразим через мольную долю газа
Pi = p°i{T) - f RTn(x?). (12.25)
Стандартное значение химического потенциала равно химиче
Скому потенциалу чистого идеального газа (хі = 1; р1 — р0).
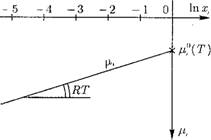
Выразим (рис. 12.9), зависимость (12.25) графически в координатах pi — f(n(xi)). При Хі — 1 1па? г = 0и рі = р°і{Т).
При снижении мольной доли г-ro газа величина lnx* уменьшается, пропорционально снижается и значение химического потенциала fii. Угол наклона прямой pi соответствует величине RT, т. е. зависит от температуры.
Таким образом, определив стандартное значение химического потенциала чистого идеального газа Рі(Т) по таблицам теплофизиче - ских свойств и проводя прямую линию под углом RT, получим изменение химического потенциала данного газа рі в необходимом диапазоне изменения парциального давления газа в смеси газов в диапазоне изменения мольной доли Хі.
12.2.5. Химические потенциалы веществ в водных растворах
Водные растворы веществ можно условно разделить на две группы: идеальные растворы и реальные (неидеальные) растворы.
Для идеальных растворов зависимость химического потенциала от мольной доли вещества аналогична зависимости для идеального газа:
Pi = p°i(p, T) + RT ln(a?0. (12.26)
Различие заключается в том, что стандартное значение химического потенциала /і? зависит не только от температуры, но и от давления. Это обусловлено тем, что энтальпия воды зависит от давления и температуры, а для идеального газа — только от температуры.
Графически химический потенциал идеального раствора представлен на рис. 12.10.
Для реальных растворов зависимость химического потенциала от In Хі становится нелинейной (рис. 12.11).
|
Рис. 12.9. Зависимость химического потенциала г-го газа в смеси идеальных газов ОТ МОЛЬНОЙ ДОЛИ Хі. |
В этом случае химический пртенциал растворенного вещества выражается через активность его сц
//г = /і?(р, Т) + RTln(c4). (12.27)
'5 Котельные установки
Активность вещества а^ и его мольная доля связаны коэффициентом активности jf.
Q>i :=: 'У%Х% •
Для сильно разбавленных растворов Хі и « 1, а^ w
Физический смысл понятия активности растворенного вещества можно проследить по рис. 12.11. Допустим, что мольная доля вещества хі.
Этой величине отвечает значение химического потенциала в точке а(ра) на кривой для реального раствора. Если бы раствор был идеальным, то этой величине р, а соответствовала бы точка б с мольной долей х"а = (ц. Следовательно, активность растворенного вещества о, і в реальном растворе равна той мольной доле этого вещества, которая должна была бы быть в идеальном растворе х -1Д, чтобы получить тоже значение химического потенциала.