КОТЕЛЬНЫЕ УСТАНОВКИ И ПАРОГЕНЕРАТОРЫ
Переход примесей из воды в насыщенный пар
С питательной водой в паровой котел поступают различного рода примеси. В барабанных и прямоточных котлах до критического давления происходит испарение воды, пар перегревается и направляется в турбину. Какое количество примеси переходит в пар? Аналогично — в деаэраторе происходит кипение воды, имеются области жидкой и паровой фаз.
|
Рис. 12.29. Схема системы «вода — пар» на линии насыщения. |
Рассмотрим систему (рис. 12.29), включающую жидкую (вода) и паровую фазы, находящиеся в тепловом равновесии: температура Т и давление р
фаз одинаковы; подвода и отвода теплоты нет. Соотношение Тир отвечает линии кипения для воды.
Обозначения: верхний штрих показывает, что данная величина относится к жидкой фазе; два верхних штриха — к паровой фазе.
В жидкой и паровой фазах присутствуют примеси (г — 1 - N), мольная доля их Хі. Принимаем, что растворы идеальные, наличие других примесей не оказывает влияние на поведение г-ой примеси.
Электрохимический потенциал г-ой примеси в жидкой фазе
О/ ,
/4 = T) + RTnx, l~(ae^,i1
|
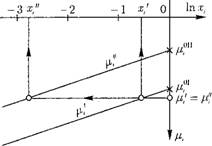
Рис. 12.30. Изменение химических потенциалов примеси в'жидкой /4 и паровой р" фазах в зависимости от мольной ДОЛИ Хі. |
(12.47)
Где pf (р, Т) — стандартное значение химического потенциала г-ой
Примеси в жидкой фазе.
|
(12.48) |
Электрохимический потенциал в паровой фазе
/х5' = /х?"(р, Т) - f RTlnx" - (aetp)".
При равновесии системы р[ — р'(.
|
Т) + RT 1п.< Отсюда |
|
К1 |
На рис. 12.30 показано изменение химических потенциалов примеси в жидкой и паровой фазах. Из рис. 12.30 видно, что при их равенстве мольные доли г-ro вещества в жидкой и паровой фазах х и х" различаются. Приравняем (12.47) и (12.48):
(а е ф)Ч = (р, Т) + RT In х - (а е
ВТInQ) = -0uf'ip, Г) - ,І°'(Р, Г)) - ((аеірУї - (ае. ір)"). (12.49) Введем обозначение
(12.50)
Величина Кр показывает отношение концентрации примеси в паровой фазе к концентрации в жидкой фазе. Называется она коэффициентом распределения примеси между жидкой и паровой фазами.
Коэффициент распределения может рассчитываться не только через мольные доли вещества, но и через концентрации, выраженные в других единицах (г/кг, мкг/кг, см3/г и т. д.). В общем виде
К - —
Р~ С.'
Где Сп, Св — концентрация примеси в паровой и жидкой фазах.
Из соотношения (12.49) получим зависимость для расчета коэффициента распределения
КР = ехр(--------- ш---------- ) .ехр(------------------------------------- ш ). (12.51)
Коэффициент распределения является функцией температуры (давления), свойств растворенного вещества, степени его диссоциации, состава раствора.
Рассмотрим случай, когда растворенное вещество находится в молекулярной форме (степень диссоциации а = 0) в жидкой и паровой фазах. Коэффициент распределения обозначим KpJ. Он будет определяться из выражения
< = (12.52)
Обозначим
Ад°сп(Г) = СР. Т) - (Р, П (12.53)
Где Дд{}сп(Т) — изменение стандартных химических потенциалов при испарении или конденсации вещества. Тогда
А/4п
Или 0
= (1254)
Изменение стандартных химических потенциалов выразим через разность энтальпии h" и энтропии б*-; s":
АЛ^ = Л<'- Л{; As'cri = s" - s[ Д^сп = ДЛ'СП - TAslllcn. (12.55)
Обратите внимание, что величины /г", 1г[, Ahlucп, s", sДз?1СП, Д/^сп относятся к растворенному веществу при данной температуре системы Т, а не к водному теплоносителю.
|
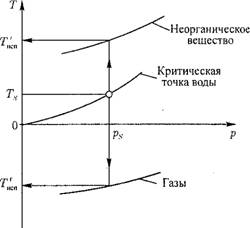
Рис. 12.31. Зависимости Т = д(р) на линии кипения (испарения) для разных веществ. |
Давлению рассматриваемой системы р отвечает температура кипения растворенного г-го вещества Т*сп, отличающаяся от температуры системы Т, которая принимается, как было указано выше, по кривой испарения для воды (рис. 12.31).
При Т*сп Д/4п = о и Д4СП = AhijT^ Тогда
Исп
Молекулярный коэффициент распределения
Проведем анализ полученной зависимости (12.56).
Процесс испарения жидкости всегда происходит с подводом теплоты, т. е. д/4„>о.
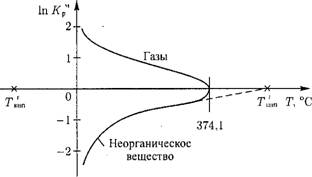
Для неорганических веществ при данном давлении системы р температура кипения Ткг||П больше температуры кипения воды Т, при этом, как видно из (12.56), In К^1 < 0. Для газов, наоборот, ТК|П < Т, а 1 пК*1 > 0.
Уравнение (12.5о) получено для идеальных растворов в воде и паровой фазе без учета влияния свойств растворителя. Однако с повышением
|
Таблица 12.1. Параметры воды на линии насыщения
|
Давления (температуры) двухфазной системы плотность воды снижается, а пара — увеличивается, паровая и жидкая фазы воды по своим характеристикам сближаются, в критической точке различие между ними исчезает (табл. 12.1).
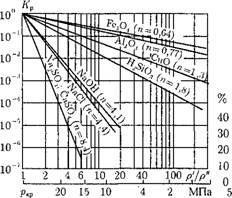
Следовательно, коэффициент распределения в критической точке системы для всех веществ равен 1 (In К^ = 0). С учетом этого на рис. 12.32 показан ход зависимости коэффициента распределения для неорганических и газообразных веществ.
|
Рис. 12.32. Зависимость коэффициента распределения Кр от температуры для неорганических веществ и газов. |
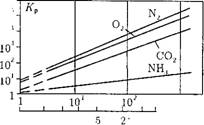
Факт, что коэффициент распределения для газообразных веществ больше 1, используется в деаэраторе для удаления из воды значительной части растворенных газов.
Влияние степени диссоциации вещества на коэффициент распределения примеси между водой и паром видно из формулы (12.51):
— ((а е фУі — (а е ■
Т' Г/л/ ( - - У*ЄЧ>)і Кр = Л/ ехр^---------- ^ ) =
= Крех р( RT (12.57)
При увеличении степени диссоциации вещества в жидкой фазе а • коэффициент распределения уменьшается, а в паровой фазе а" — увеличивается. При а[ — 1 и а" = 1 из (12.57) получим значение для ионного коэффициента распределения Поскольку в паровой фазе степень диссоциации существенно меньше, чем в жидкой, ионный коэффициент распределения меньше молекулярного.
Таким образом, использование физико-химического метода анализа двухфазных систем дает возможность выявить основные закономерности процесса перехода примесей из воды в насыщенный пар.
|
|
|
|
Для практических целей в теплоэнергетике используют зависимость коэффициента распределения не от температуры насыщения, а от отношения плотностей воды р' и р" на линии насыщения:
(12.58)
Это соотношение впервые предложил академик Стырикович М. А. Использование формулы (12.58) удобно тем, что в определенном диапазоне параметров показатель степени можно принимать постоянным. Тогда в логарифмических координатах эта зависимость будет линейной:
(12.59)
Где коэффициент п соответствует углу наклона прямой линии.
Физически коэффициент п можно трактовать как координационное число растворенного в воде вещества, показывающее, сколько молекул воды находится в ближайшем окружении молекулы или иона растворенного вещества. Это число зависит от индивидуальных свойств вещества: чем сильнее электрически заряжена молекула (ион), тем больше координационное число.
Из (12.59) видно, что все прямые (лучи) сходятся в критической точке,
Где р'/р" = 1, Щ = 1.
На рис. 12.33 показана лучевая диаграмма для ряда веществ.
Неорганические соединения по способности растворяться в насыщенном паре можно условно разделить на три группы:
1 - весьма слабые электролиты (п < 1); они в водных растворах почти недиссоциированы; коэффициент распределения при р — 11 МПа и выше составляет десятки процентов (типа гидратированных оксидов железа, алюминия и т. д.);
2 — слабые электролиты (n = 1 - 3), коэффициент распределения при тех же параметрах — проценты (типа кремнекислоты);
3 — сильные электролиты (п > 3); практически полностью диссоциированы; коэффициент распределения — десятые, сотые и меньше доли процента (силикаты, сульфаты, фосфаты натрия, кальция).
|
Рис. 12.33. Зависимость коэффициен - Рис. 12.34. Видимые коэффициенты рас - та распределения веществ от отноше - пределения гидратированных оксидов же - ния р'Iр" водного теплоносителя. леза, алюминия, меди и кремния при р = — 18 МПа в зависимости от рНо. |
|
Кр |
Fe30, |
||||
|
ЧА1(ОН)< |
|||||
|
/ |
CuO |
||||
|
У |
SiO, |
||||
|
Г----- |
|
10 рН0 |
|
6 |
Ионные формы растворенных веществ более гидратированы, координационное число у них больше, а коэффициент распределения — меньше, чем у молекулярной формы. Видимый (интегральный) коэффициент распределения Кр зависит от К™, и доли диссоциированных молекул.
Для слабых электролитов доля молекулярной формы в общей концентрации растворенного вещества обозначается через /3, а 1 — /3 — доля ионной формы. Видимый коэффициент распределения будет равен
Величина /3 зависит не только от давления, но и от величины рН. Поэтому при одном и том же давлении величина Кр будет различной в зависимости от значения рН (рис. 12.34). Видно, что Кр для РезО, Si02, CuO в широком диапазоне рН (в рабочем диапазоне для паровых котлов) постоянен, не зависит от рН. Объясняется это тем, что для весьма слабых электролитов (3 « 1,1 - (3 « 0, т. е. Кр — К™.
Для сильных электролитов (соли сильных оснований и кислот) определяется степень диссоциации о (доля ионной формы вещества), которая
|
Рис. 12.35. Зависимость видимого ко - Рис. 12.36. Зависимость коэффициента эффициента распределения NaCl от распределения NaCl от степени диссоци- концентрации. ации в воде: 1 — ав = 1; 2 — ав — 0. |
Зависит от концентрации электролита и давления (плотности), но не зависит от величины рН. Коэффициент распределения (видимый) выражается через степень диссоциации в воде ав и средние коэффициенты активности в воде /в и паре /п:
Яр - 1 - ав) 4 М^0'5. (12.61)
Из (12.61) видно, что Кр изменяется от значения при ав = 1
До Кр при ав = 0 (рис. 12.35). Соответствующие лучи для (А^1)0,5 и Кр представлены на рис. 12.36. При 0 < ав < 1 зависимости для Кр ложатся между этими лучами. Значения (А„)0,5 и Кр при pf jр" = 10 (р = 12 Мпа) отличаются на 2 порядка (в 100 раз).
Коэффициент распределения летучих веществ между водой и паром больше 1 (рис. 12.37), т. е. при кипении воды летучие вещества переходят в пар. С одной стороны, на этом процессе основывается деаэрация воды, но, с другой стороны, это затрудняет поддержание в воде на необходимом уровне величины рН, т. к. аммиак и летучие амины переходят в пар.
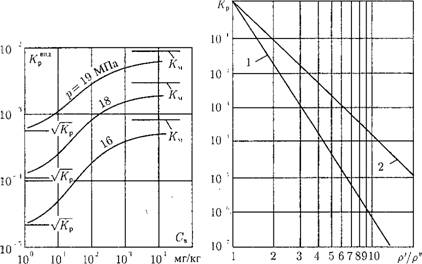
Для правильного выбора вод- но-химического режима парово - Ю го котла и внутрибарабанных устройство надо знать соотношение между коэффициентом распределения и влажностью насыщенного пара и. На рис. 12.38 показаны значения Кр для разных давлений в зависимости от «силы» электролита — показателя координационного числа п. Там же приведены обычные для барабанных котлов значения влажности пара и = 0,02-0,05% (в долях и = - 0,0002-0,0005).
При низком давлении в барабане (р = 4 МПа) коэффициент распределения выше влажности при п < 2 (рис. 12.38), т. е. для весьма слабых и некоторых слабых электролитов. К ним относятся РезС>4, АІ2О3, CuO, В2О3, Si02. Продукты коррозии (Рез04, А120з и др.) имеют малую растворимость в воде, поэтому даже при высоком значении Кр концентрация их в паре мала. Особое значение имеет крем - некислота H2Si03 — в воде ее заметное количество и в паре она хорошо растворяется. Сильные электролиты имеют Кр <С о;, и их концентрация в воде особого влияния на качество пара не оказывает, если предусмотреть достаточно эффективную сепарацию пара в барабане. По содержанию Si02 в воде устанавливается предельно допустимое значение.
При среднем давлении (р = 11 Мпа) весьма слабые и слабые электролиты (п < 3) имеют Кр > со, причем для Рез04, АІ2О3 это превышение составляет примерно три порядка, для Si02 — два порядка. Сильные электролиты имеют еще Кр < из. При этом давлении становится актуальным для получения чистого пара снижение концентрации слабых электролитов в воде, улучшение сепарации и промывки пара (от кремнекислоты, продуктов коррозии).
|
10 р'/р" |
|
22.4 20 15 10 |
|
1 0.5 0,2 |
|
Р. МПа |
|
Рис. 12.37. Лучевая диаграмма для газов. |
При высоком давлении в барабане (р = 15,5 МПа) только очень сильные электролиты (77, > 5) имеют коэффициент распределения Кр ниже, чем влажность пара, т. е. в насыщенный пар основное количество примесей поступает не с влажностью пара, а путем их растворения. Отсюда возникает задача обязательной промывки пара водой более чистой, чем котловая. Но при этом не следует принижать роль сепарации — в котловой воде часто содержатся не только растворенные примеси, но и взвеси, шлам с концентацией С™. Эта часть примеси уносится вместе с каплями воды, и суммарное количество примеси в насыщенном па-
|
0 1 Весьма |
|
2 Слабые |
|
3 An Сильные |
Из полученного выражения видно, что при наличии в котловой воде взвешенных примесей роль сепарации влаги от пара возрастает.