КОТЕЛЬНЫЕ УСТАНОВКИ И ПАРОГЕНЕРАТОРЫ
Электрохимическая коррозия. Двойной электрический слой
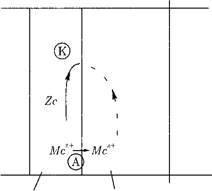
Рассмотрим систему «твердая поверхность — электролит» (рис. 12.39). В какой-либо точке поверхностного слоя металла молекула металла Me теряет электроны
Me - ze~ = Mez+ + ze~)
Т. е. происходит его окисление.
Часть ионов металла Ме*+ переходит в раствор. Этот участок поверхности металла называют анодом.
Электроны по поверхности металла перемещаются в зону, называемую катодом. На катоде имеется избыток электронов, которые могут передаваться (ассимилироваться) ионам металла в растворе, — происходит восстановление металла:
Mez+ + = Me.
Таким образом, на границе раздела электрод-раствор происходит переход электронов от молекул металла к электроду (на аноде) и, наоборот, от электрода к ионам металла в растворе (на катоде).
На аноде происходит переход металла в раствор, т. е. его коррозия.
Анод и катод могут быть расположены в разных точках поверхности металла или в одной точке — поочередно.
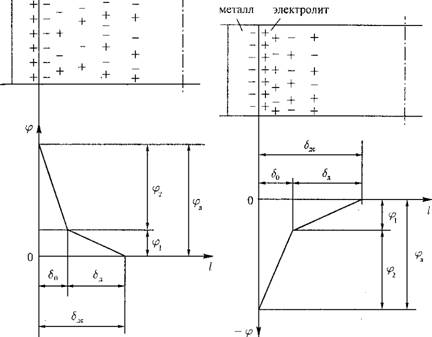
Поверхность металла (электрода) на участке анода имеет избыточный положительный заряд, а на катоде — отрицательный заряд. За - ряженность поверхности электрода приводит к определенной структуре ионов в пристенном слое раствора (электролита) — образуется двойной электрический слой.
Возьмем участок анода (рис. 12.40). На поверхности металла расположены положительно заряженные ионы, потенциал поверхности ip. Вследствие электростатического притяжения в растворе около поверхности металла сосредотачиваются отрицательно заряженные ионы, они образуют мономолекулярный слой. Толщина слоя характеризуется как плотная часть двойного электрического слоя. В пределах этого слоя происходит резкое снижение электрического потенциала (рис. 12.40). Силы воздействия этого потенциала на следующий слой ионов в растворе значительно ослаблены, и чем дальше от поверхности электрода, тем больше встречается положительно заряженных ионов, тем более размытой становится структура ионов. Толщина 5R показывает диффузную часть двойного электрического слоя. За пределами диффузной части влияние электрического потенциала поверхности металла не сказывается на поведении ионов и молекул раствора.
Толщина двойного электрического слоя 5ЛС
£дс — <5о +
Разность потенциалов поверхности и электролита за двойным электрическим слоем ifа называется абсолютным скачком потенциала. Он представляет сумму скачков потенциала на плотной и диффузной tpi части двойного электрического слоя (рис. 12.40).
|
|
|
Металл |
|
Электролит |
|
Рис. 12.39. Анодный и катодный участки на границе «металл — электролит». |
На катоде поверхность металла имеет избыток электронов, она обладает отрицательным электрическим потенциалом ( - у?) -- рис. 12.41. Около катода в поверхностном слое электролита так же формируется двойной
|
Металл электролит _л I *
Риє. 12.40. Двойной электрический слой Рис. 12.41. Двойной электрический слой около положительно заряженной поверх - около отрицательно заряженной поверхности металла. ности металла. |
Электрический слой (рис. 12.41). Его характеристики аналогичны рассматриваемым выше.
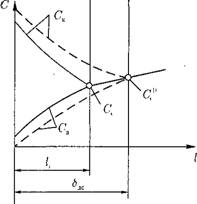
Рассмотрим изменение концентрации примеси в пристенном диффузионном слое раствора (рис. 12.42). Толщина диффузионного слоя <5»ДНф (напомним, что в диффузионном слое перенос примеси происходит только за счет диффузионных процессов, турбулентного переноса нет).
На рис.' 12.42 введены обозначения: Сп — концентрация примеси в ядре потока; Сс — концентрация примеси в диффузионном слое за пределами двойного электрического слоя; Ск, Са — концентрация катионов и анионов в пределах двойного электрического слоя; т - т — граница поверхности твердой фазы (электрода).
Очевидно, что концентрация катионов (положительно заряженных ионов) увеличивается по мере приближения к отрицательно заряженной поверхности, а концентрация анионов, наоборот, снижается.
Вблизи поверхности анода (положительно заряженная поверхность) изменение концентрации Ск и Са будет противоположным изменению около катода.
В результате взаимодействия электростатических сил, сил межмолекулярного притяжения поверхности твердой фазы и примеси, растворенной в водном теплоносителе, на границе двойного электрического слоя устанавливается равновесная концентрация (рис. 12.42).
|
(12.65) |
Зависимость абсолютного скачка потенциала на границе электрод - раствор (ра и активности вещества в растворе на границе двойного электрического слоя avc характеризуется уравнением Нернста:
V 0 +
ZF
Где (ро — стандартный потенциал реакции, протекающей на электроде:
(12.66)
ZF = е — электрический заряд.
В равновесных условиях происходит переход ионов металла в раствор на аноде, ионы металла перемещаются в зону катода, на катоде электроны поступают к ионам и восстанавливают их. Как известно, движение ионов в растворе представляет собой электрический ток. Таким образом, движение катионов и электронов можно представлять как электрический ток на аноде га, катоде? к, ток обмена го между анодом и катодом.
В реальных условиях при движении потока равновесие в системе нарушается. Турбулентные моли проникают в диффузную часть двойного электрического слоя, толщина которого 1[ (рис. 12.43) становится меньше равновесного значения <5ЛС. При этом скачок потенциала меньше абсолютного (ра, активность вещества на новой границе двойного электрического слоя принимает новое значение ас, а концентрация — Сс.
Изменение потенциала
A(p = (pi-(pa (12.67)
Называется поляризацией электрода.
Уравнение Тафеля связывает величину поляризации электрода с силой тока і
+ -Д<р = а + ЬЫ, (12.68)
Где знак + для анода, знак — для катода, a, b — постоянные уравнения Тафеля.
В равновесии А<рлн = —Асрк = = 0, га = Ч = к-
В реальных условиях поляризации электрода А<р соответствует максимальная сила тока гмаКс> которая определяется электрическим сопротивлением раствора Rc:
|
ДГ |
Аф = <ран ~ <Рк = г'максЯс (12.69)
^ макс —
Таким образом, коррозионный ток зависит от поляризации электрода А ср и электрического сопротивления раствора Rc.
|
|
|
(12.70) |
|
Рис. 12.43. Поляризация электрода. |
При JRC —> оо гмакс —> 0 на границе «металл-раствор» электрический ток отсутствует, электрохимическая коррозия переходит в химическую.