Токсичность сточных вод
К параграфу 2.1
2.1.1. Привести последовательность операций при стандартном анализе токсичности сточных вод методом биологического тестирования.
Решение. В качестве тест-объектов следует выбрать дафнии (Crustaceae, Cladocera). Определяемый с помощью этих ракообразных параметр характеризует продолжительность ингибирования их подвижности в загрязненной воде. Результаты определений выражают в единицах равной токсичности (эквитокс). Сточную воду оценивают значением 1 эквитокс/м3, если в условиях теста 50% популяций лишаются подвижности на 24 ч.
Для теста выбирают дафнии определенного размера (от 560 до 800 мкм). На пробе, содержащей группу таких дафний, проводят предварительный тест с использованием бихромата калия в качестве стандарта токсичности (50% дафний, находящихся в воде, содержащей С0 =1,2 мг/дм3 К2Сг207, лишаются подвижности на 24 ч).
Затем готовят серию разведений анализируемой сточной воды и устанавливают концентрацию С,, при которой 50% дафний становятся неподвижными. Сначала проводят предварительный тест для ориентировочного определения концентрации С,, а затем — окончательный тест, на основании которого находят действительный результат. Количество эквитокс/м3 сточной воды эквивалентно концентрации С,, откорректированной в соответствии со значением С0.
К параграфу 2.2
2.2.1. Оценить класс загрязнения речной воды при помощи биологического критерия. Определяющие этот индекс показатели состава речной воды имеют следующие концентрации, мг/дм3: взвешенные вещества — 27; БПК — 6,8; 02 — 8,9 и аммонийный азот — 1,3. Процент насыщения воды кислородом — 78.
Решение. Поскольку фоновые концентрации некоторых ингредиентов качества в приемниках сточных вод в настоящее время часто превышают их нормативные ПДК, то для расчетов общего резерва самоочищающей способности водоприемников приходится использовать интегральные критерии. Один из них — универсальный биологический критерий. В соответствии с результатами натурных наблюдений значения входящих в этот индекс показателей разбиты на определенные интервалы, каждому из которых определен балл в пределах от 0 до 30. В табл. 2.23 приведены эти интервалы и соответствующие им баллы.
Как видно из табл. 2.23, общая сумма максимальных значений баллов по 5 параметрам равна 100.
Расчет величины критерия ведется по формуле
Биологический = Сумма баллов критерии Ю
Поскольку предельное значение суммы баллов равно 100, величина биологического критерия при расчете по формуле (2.7) может колебаться от 0 до 10, причем большее значение индекса соответствует более чистой воде.
|
Таблица 2.23 Балльная оценка степени загрязнения воды
|
Установлена следующая классификация загрязненности воды в зависимости от значений биологического критерия: 10 — чистая вода; 8 — небольшое загрязнение; 6 — вода загрязнена; 3 — сильное загрязнение и 0 — сточная вода.
Соответствующие баллы для рассматриваемого в данном примере состава речной воды по табл. 2.23 составят:
|
Параметр |
Концентрация |
Балл |
|
Взвешенные вещества |
27 мг/дм3 |
14 |
|
БПК |
6,8 мг/дм3 |
18 |
|
02 |
8,9 мг/дм3 |
8 |
|
02 |
78% насыщение |
6 |
|
Аммонийный азот |
1,3 мг/дм3 |
12 |
|
Всего |
58 |
Подставляя значение суммы баллов в формулу (2.7), получим, что величина биологического критерия составляет около 6 условных единиц.
Таким образом, речная вода, судя по величине биологического критерия, относится к классу загрязненных.
Решение. Сначала определим потребность реакции в кислороде на основе стехиометрического уравнения:
C8H1203N2 + 802 = 8 С02 + 2NH3 + ЗН20
Казеин Кислород Диоксидуглерода Аммиак Вода Молекулярная масса 184 256 352 34 54
Для полного окисления казеина требуется (20мг/дм3 казеина) х (256мгкислорода)
27,8 мг/дм кислорода.
184 мг казеина
Полученная величина означает, что при полном окислении необходимо израсходовать 27,8 мг/дм3 кислорода в воде, что и определит величину ее ХПК. Поскольку вода в насыщенном состоянии при температуре 20°С содержит всего 9,2 мг/дм3 растворенного кислорода, следует принять меры для обеспечения требуемого его количества. Отметим, что с помощью одного ХПК нельзя определить, как быстро расходуется кислород, идет или не идет реакция до конца и с какой скоростью кислород может поступать в поток воды.
К параграфу 2.3
2.3.1. Рассчитать концентрацию песка в сточной воде, поступающей на очистную станцию, и эффективность работы песколовок, если в них задерживается песка 15 дм3 на 1000 м. Содержание песка в осадке первичных отстойников 6% (по массе), количество этого осадка составляет 0,25% по объему от расхода обрабатываемой воды, влажность осадка 93%.
Решение. Общее количество песка определяют как сумму песка, задерживаемого песколовками и первичными отстойниками.
Рассчитаем часть песка, улавливаемого песколовками. При этом все расчеты приведем к 1 дм3 сточной воды, как и принято для выражения концентрации по любому виду загрязнений.
Из условия задачи следует, что в песколовках на 1 дм3 сточной воды задерживается 0,015 см3 песка по объему. Объемную массу песка при расчетах принимаем равной 1,5 т/м3, или 1,5 г/см3.
Следовательно, в песколовках улавливается песка (по массе)
0,015 х 1,5 = 0,0225 г/дм3 = 22,5 мг/дм3.
Далее определим часть песка, удаляемого с осадком первичных отстойников. По условию с 1 дм3 обрабатываемой воды образуется осадка 0,25%, или 2,5 см3/дм3. По массе при влажности осадка 93% (и объемной массе 1 г/см3) сухого вещества осадка на 1 дм3 воды будет
2,5 х 1 х 0,07 = 0,175 г/дм3, или 175 мг/дм3.
Так как количество песка составляет 6% по массе по отношению к сухому веществу осадка, то масса песка в осадке будет
175x0,06= 10,5 мг/дм3.
Таким образом, в исходной сточной воде общее содержание песка составит
22,5+ 10,5 = 33 мг/дм3.
Из этого количества песколовками задержано 22,5 мг/дм3, или 68,2% песка.
2.3.2. Как изменится объем откачиваемого из первичных отстойников осадка, если обеспечить снижение его влажности с 94 до 92,5%?
Решение. Концентрация сухого вещества в осадке влажностью 94% составляет 60 г/дм3, а в осадке влажностью 92,5% — 75 г/дм3. Чтобы получить 1 дм3 осадка с концентрацией сухого вещества 75 г, нужно взять жидкого осадка с 94%-ной влажностью 75 : 60 = 1,25 дм3. Следовательно, объем осадка уменьшится с 1,25 до 1 дм3, или в 1,25 раза. (Объемная масса осадка принимается равной 1 кг/дм3.)
К параграфу 2.4
2.4.1. Сколько ила образуется при биологической очистке сточных вод и какое количество воздуха необходимо подать в аэротенки для выполнения требований норматива?
Эксплуатационные условия процесса подготовки активного ила для обработки городских сточных вод следующие. Расход сточных вод 40 тыс. мУсут, исходное содержание взвешенных веществ 90 г/м3, БПК^ (La) в исходных сточных водах 300 г/м3, БПК,,^ в сбрасываемых сточных водах 15 г/м3 (норматив).
Решение. По формуле (2.2) прирост ила составит
Пр = 0,8 х 90 + 0,3 х 300 = 162 г/м3 или с учетом производительности станции
40 000 м3/сут х 162 г/м3: 106 = 6,48 т/сут.
Расход воздуха при пневматической системе аэрации подсчитаем по отношению к 1 кг снятой БПКполн. Удаление БПКполн составляет
40 000 м3/сут х (300 - 15) г/м3 х 10"3 = 11 400 кг/сут.
Для городских сточных вод при мелкопузырчатой системе аэрации расходуется 50 кг воздуха на 1 кг снятой БПК, ЮЛН. Плотность воздуха при стандартных температуре и давлении равна 1,203 кг/м3.
Тогда общая потребность в воздухе для станции биохимической очистки будет равна
11 400 x50: 1,203 = 473 815,5 м3/сут.
К параграфу 2.5
2.5.1. Определить необходимые параметры хлораторной установки, проектируемой для дезинфекции сточной воды на станции биохимической очистки производительностью Qcp C„ = 20 000 м3/сут при общем коэффициенте неравномерности К^ = 1,39.
Решение [18]. Средний секундный расход воды на очистную станцию составит
<7ср = Осрхуг / (24 х 3600) = 20 000 / (24 х 3600) = 0,23 м3/с.
При КО6ш =1,39 максимальный часовой расход
|
Qcv. |
|
2000 24 |
|
_ "^ср. сут |
|
^иа; |
|
Х^обш - |
|
24 |
Xl,39 = 1158 м3/ч.
При дозе хлора для дезинфекции сточных вод Д^ = 3 г/м3 расход хлора за 1 ч при максимальном расходе составляет
Е -Дхл^акс., ,3x1158 ,
Расход хлора в сутки
, _Дхлхар. сУг_ 3x20000 _ gm~ 1000 " 1000 - ьикг/ч-
В хлораторной предусматривается установка двух хлораторов ЛОНИИ-ЮО с ротаметром РС-5. Один хлоратор рабочий, а другой — резервный.
Для обеспечения требуемой производительности в 1 ч необходимо иметь баллонов-испарителей
где S6iU1 = 0,5-0,7 кг/ч — съем хлора с одного баллона вместимостью 20 л, содержащего 25 кг жидкого хлора.
Баллоны-испарители хранятся в расходном складе хлора. Для контроля за расходованием хлора на складе устанавливают двое циферблатных весов марки РП-500-Г, на которых размещаются по семь баллонов. Каждые весы с баллонами являются частью двух самостоятельных установок, работающих периодически.
Хлораторная обеспечивается подводом воды питьевого качества с давлением не менее 300 кПа и расходом
Q = = 3,47 X 0,6 = 2,08 М3/ч,
Где Qm = 0,6 м3/кг — норма водопотребления в м3 на 1 кг хлора.
Подача хлорной воды для дезинфекции сточной воды производится перед смесителем типа «лоток Паршала» с горловиной шириной 500 мм, потеря напора в котором равна Ah = 2 кПа.
Для обеспечения контакта хлора со сточной водой запроектированы контактные резервуары по типу горизонтальных отстойников. Их объем
К., = Омакс. ч х Т= 1158 X 30 / 60 = 579 м3,
Где Т= 30 мин — продолжительность контакта хлора со сточной водой.
При скорости движения сточных вод в контактных резервуарах v = 10 мм/с их длина равна
Z=vx Т= 10 x 30x60 / 1000= 18 м.
Площадь поперечного сечения
|
= 7 шт., |
|
«ба |
|
Sm _ 3,47 |
W=VKpJL = 579 / 18 = 32,2 м2.
При глубине Н= 2,8 м и ширине каждой секции B = 6 м количество секций
N = w/(b*H) = 32,2 / (6 х 2,8) = 2 шт.
К параграфу 2.6
2.6.1. Определить максимальный выход биогаза из распавшегося органического вещества осадка.
Решение. Эту задачу можно решить, если считать количество метана, образовавшегося при распаде органики, как эквивалент ХПК распавшегося осадка:
СН4 + 202 = С02 + 2Н20. (2.8)
Из уравнения (2.8) следует, что один моль СН4 (22,4 л при стандартных условиях) вступает в реакцию с двумя молями 02 (64 г по ХПК). Тогда 1 г ХПК распавшегося осадка образует:
22,4 : 64 = 0,35 л СН4.
Однако даже при бесконечно длительном пребывании осадка в метантенке не происходит полного распада всего органического вещества осадка и превращения его в биогаз. Некоторая доля органического вещества синтезируется в биомассу микроорганизмов, участвующих в процессе ее распада, часть переходит в растворенное состояние, создавая щелочность среды, а часть вообще не сбраживается (лигнин). Поэтому найденное в данной задаче значение выхода биогаза следует считать ориентировочным.
2.6.2. Оценить работу метантенков, если анализ иловой жидкости дал в первом метантенке результаты по содержанию жирных кислот 33 мг-экв/дм3 и щелочности 42 мг-экв/дм3, а во втором — соответственно 8 и 92 мг-экв/дм3. Газы брожения в первом метантенке имеют состав: 25% СН4, 29% Н2, 45% С02, 1% N2, а во втором - 65% СН4, 1% Н2, 33% С02 и 1% N2.
Решение. В составе газов первого метантенка мало процентное содержание метана и в больших количествах присутствуют компоненты первой (кислой) фазы брожения — углекислота и водород. В составе иловой воды этого метантенка жирных кислот значительно больше предела для нормально работающего сооружения при одновременно невысоком запасе щелочности. Все эти показатели однозначно свидетельствуют о подавлении щелочной фазы процесса брожения и наличии явных признаков «закисания» метантенка.
Для второго метантенка показатели по составу иловой воды и газа находятся в пределах норм стабильно работающего сооружения.
К параграфу 2.7
2.7.1. 1'ассчитать, какая часть ила но объему удаляется п виде фугата, и определить качество фугата, если на центрифугирование подается ил влажностью 96,8%. Влажность обезвоженного ила 80%, эффективность задержания взвеси 28%.
Решение. В 1 м3 исходного ила было 32 кг сухого вещества. В виде обезвоженного ила получено сухого вещества
32 х 0,28 = 8,96 кг/м3.
Объем этого ила при его влажности 80%, т. е. содержании сухого вещества 200 кг/м3, составляет
8,96 : 200 = 0,0448 м3/м3.
Если с 1 м3 обрабатываемого ила получается 0,0448 м3 обезвоженного продукта, то фугата получится 0,9552 м3/м3, что составляет 95,5% первоначального объема ила.
В полученном фугате имеется сухого вещества
32 - 8,96 = 23,04 кг/м3.
Концентрация фугата по взвешенным веществам составит
23,04 : 0,9552 = 24,1 кг/м3, или 24,1 г/дм3.
При концентрации сухого вещества в фугате 24,1 г/дм3 его влажность составляет 97,6%.
В результате центрифугирования получилось более 95% фугата по объему от объема отработанного ила с качеством, практически близким к исходному илу. Влажность фугата всего на 0,8% выше влажности ила, поданного на центрифугирование.
В схеме сооружений должна быть предусмотрена система обработки или использования фугата.
2.7.2. Определить влажность осадка после удаления иловой воды, если на иловые площадки с поверхностным отводом воды подан осадок влажностью 97,4%. После отстаивания удалена иловая вода в объеме 50% первоначального объема осадков с концентрацией взвеси в ней 1 г/дм3.
Решение. Расчет следует выполнить применительно к 1 дм3 осадка. При влажности 97,4% содержание сухого вещества составляет 26 г/дм3. После удаления отстоявшейся воды объем осадка уменьшился в 2 раза, т. е. стал равным 0,5 дм3. Удалено иловой воды также 0,5 дм3 с содержанием в ней сухого вещества 0,5 г. Следовательно, в 0,5 дм3 осадка осталось сухого вещества 25,5 г, а в пересчете на 1 дм3 — 51 г/дм3. При концентрации сухого вещества 51 г/дм3 влажность осадка составит 94,9%.
К параграфу 2.8
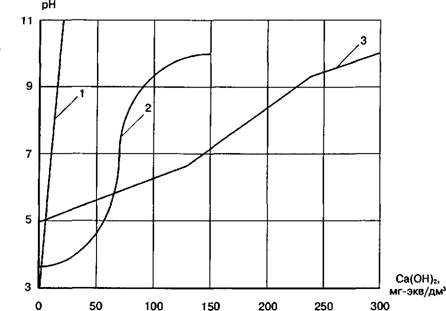
2.8.1. Требуется количественно оценить влияние буферное™ сточных вод завода биохимических реактивов на контроль процесса их нейтрализации. Они загрязнены смесью минеральных и органических кислот, содержащихся в постоянно изменяющемся соотношении и обладающих отчетливо выраженными буферными свойствами. На рис. 2.9 приведены кривые титрования этих сточных вод 5%-ной известковой суспензией.
|
Рис. 2.9. Кривые титрования сточных вод завода химических реактивов: 1 — проба воды со слабо выраженными буферными свойствами; 2 — то же со средней буферностью; 3 — то же с сильной буферностью |
Решение. Расчет по формуле (2.6) Р в мг-экв/(дм3 х ед. рН) для кривых рис. 2.9 в диапазоне изменения рН от 5 до 9 дает следующие результаты:
Кривая 1 —> 8:4 = 2;
2^-34:4 = 8,5;
3 -> 210 : 4 = 52,
Где делимое — расход известковой суспензии на титрование соответствующих сточных вод в мг-экв/дм3, а делитель — диапазон изменения рН.
Из результатов расчета следует, что коэффициент р в заводских сточных водах изменяется в 52 : 2 = 26 раз.
Другие факторы, влияющие на контроль качества сточных вод в процессе их нейтрализации — колебания расхода этих вод и концентрация извести в воде, не подвергаются более чем 3—5-кратному изменению. Следовательно, коэффициент буфер - ности является главной характеристикой контролируемого процесса.
2.8.2. Рассчитать рН буферного раствора СН3СООН + CH3COONa, в котором Ссолн = Скнслоты = 0,1 моль.
Решение [20]. В этом случае целесообразно использовать уравнение для расчета рН буферного раствора:
РН = р (2.8)
Кислоты
Где рА'д — отрицательный логарифм константы диссоциации слабой кислоты, для уксусной кислоты рА'д = 4,75; Скислоты и Ссоли — концентрации слабой кислоты и ее соли, моль.
Подставив исходные значения в уравнение (2.8), получим: рН = рЛГд = 4,75.
Если в этот раствор добавить НС1 концентрацией Ю-2 моль, то по реакции
Н+ + СГ + СН3СОО - = СНзСООН + сг
Концентрация слабой кислоты СН3СООН в растворе увеличится на 10 2 моль. Согласно уравнению (2.8) рН раствора равен
|
|
Следовательно, рН изменяется незначительно (на 0,08 единицы). Если это количество НС1 добавить в дистиллированную воду, то ее рН изменится от 7 до 2 (на пять единиц). Значит, раствор СН3СООН + CH3COONa проявляет буферные свойства.
Поэтому многие токсичные соединения в буферных растворах переходят в осадок только при строго определенном значении рН.
2.8.3.Необходимо осадить из раствора РЬ2+. Определить, какой реагент (Na2C03 или Na3P04) следует использовать, чтобы достигнуть более полного осаждения свинца без избытка осади - теля. Произведение растворимости ПРр,,С0 = 3,3 х 1014; ПРр,, (Р04)2 = = 7,9 х Ю-43.
|
Сравнивая остаточные концентрации ионов РЬ2+ в растворах, можно сделать вывод, что осаждение РЬ2+ фосфатом натрия идет |
Решение [20]. Осаждение свинца карбонатом натрия идет по реакции
РЬ2+ + СО^" = РЬС03, ПР = [РЬ2+] х [С032 ] = 3,3 х 1014. Остаточная концентрация ионов РЬ2+ в растворе равна
[РЬ2+] = 7(3,3 х Ю-14) = 1,8 х Ю-7 моль.
Осаждение свинца фосфатом натрия идет по реакции
ЗРЬ2+ + 2Р04~ = РЬ3(Р04)2, ПР = [РЬ2+]3 х [Р04 ] = (2/3) х [РЬ2+], ПР = [РЬ2+]3 х {(2/3) х [РЬ2+]}2 = (4/9) х [РЬ2+]5 = 7,9 х Ю 43.
Остаточная концентрация ионов РЬ2+ в растворе
|
|
Более эффективно. Остаточная концентрация РЬ2+ в случае применения Na3P04 почти в 37 раз меньше, чем при Na2C03.
К параграфу 2.9
2.9.1. Необходимо нейтрализовать 100 кг серной кислоты и удалить 6 кг никеля, содержащихся в производственных сточных водах. Требуется установить, какое количество негашеной извести СаО для этого следует применить.
Решение. Потребуется следующее количество СаО:
Где 49,04 и 29,35 — соответственно эквивалентные массы серной кислоты и никеля.
С учетом примесей, содержащихся в товарной извести, общее потребное количество ее должно быть увеличено на 50% и составит
#= 1,5 x 62,8 = 94,2 кг.
2.9.2. На примере оборотной системы охлаждающего водоснабжения Нижнекамского завода по производству синтетического каучука разработать технологический регламент очистки продувочных вод от токсичных ингибиторов коррозии стали. В оборотной системе этого завода, эксплуатирующейся с повышенным коэффициентом упаривания воды, для снижения коррозионной активности циркуляционной воды успешно применяют тройной цинк-бихроматфосфат - ный ингибитор в дозе, мг/дм3: Zn2+ = 2; СЮ4 = 3 и Р04 = 3.
Решение. Предложена и с положительным эффектом внедрена технология очистки продувочных вод по двухступенчатой схеме. На первой продувочная вода подкисляется до рН = 3—4 и пропускается через фильтр с загрузкой из железных стружек. При этом шестивалентный хром переводится в трехвалентный и снижается содержание фосфатов за счет образования нерастворимой соли Fe3(P04)2. На второй ступени продувочные воды обрабатываются кальцинированной содой и отстаиваются с выделением в осадок нерастворимых соединений ZnC03, Сг(ОН)3, Fe(OH)2 и Fe3(P04)2.
Эта технология очистки продувочных вод позволяет уменьшить концентрацию токсичных хрома и цинка, а также фосфатов до требуемого водоохранными органами уровня.
2.9.3. Определить удельные (на единицу снимаемого загрязнения) дозы реагентов при очистке сточных вод от цианидов. Высокотоксичные цианиды превращаются в нетоксичные цианаты под действием сильных окислителей, таких, как гипохлорит натрия, газообразный хлор, мононадсерная кислота (кислота Каро), в щелочной среде.
Решение. Ниже даны суммарные уравнения реакций при введении реагентов в циансодержащую воду.
Реакция с гипохлоритом натрия:
NaCN + NaCIO = NaOCN + NaCl, с газообразным хлором:
NaCN + CI2 + 2NaOH = NaOCN + 2NaCl + H20, с кислотой Каро:
NaCN + H2S05 = NaOCN + H2S04.
Первые две реакции протекают практически мгновенно при значении рН > 12, но скорость их быстро падает при снижении рН (критическое значение рН = 10,5). При любом значении рН сначала образуется хлористый циан CNC1, который так же опасен, как цианистоводородная кислота:
NaCN + NaCIO + Н20 = CNC1 + 2NaOH.
Начиная со значения рН = 10,5, хлористый циан быстро гид - ролизуется по реакции
CNC1 + 2NaOH = NaCl + NaCNO + Н20.
С кислотой Каро скорость реакции оказывается приемлемой, если значение рН превышает 9,5.
Замечено, что во всех случаях переход от цианата к азоту по реакции
2NaCNO + 3CI2 + 6NaOH = 2NaHC03 + N2 + 6NaCl + 2H20
Идет при том же самом значении рН, как и превращение цианида в цианат, но расход реагента повышается в три раза, а время реакции изменяется с 5 до 90 мин. Такой расход реагента не оправдан, так как цианаты обладают незначительной токсичностью.
В табл. 2.24 приведены расходы реагентов на окисление 1 г ци - аната CN", присутствующего в сточной воде, значение рН которой предварительно доведено до оптимальной величины.
|
Таблица 2.24
|
Примечания:
* Выпускается с концентрацией активного хлора 150 мг/дм3. ** Концентрация 200 г/дм3.
|
Удельные (на единицу снимаемого загрязнения) дозы реагентов при очистке сточных вод от цианидов |
*** Избыток допускается при концентрации цианидов < 100 мг/дм3.