Второй закон термодинамики
Содержание главы 2 Элементы классической и прикладной термодинамики
для анализа холодильных машин и тепловых насосов
2.1.2. Второй закон термодинамики Формулировки:
• тепло самопроизвольно переходит только от тела с высокой температурой к телу с низкой температурой, но не наоборот;
• некомпенсированный переход тепла возможен только от тела с высокой температурой к телу с низкой температурой;
• тепло самопроизвольно не может переходить от холодного тела к горячему.
Рассмотрим терминологию, применяемую при анализе термодинамических процессов.
Процесс называется обратимым, если вызванное им изменение состояния рассматриваемой системы может произойти в обратной последовательности без остаточных изменений.
Процесс называется необратимым, если изменения состояния системы невозможны без остаточных изменений, т.е. в обратном процессе в изолированной системе протекают такие явления, которых не было в прямом процессе.
Равновесные процессы протекают бесконечно медленно (квазистатически). Для равновесных процессов

Функция S была названа энтропией*. Эта функция характеризует ту часть тепла, которое способно превратиться в полезную работу. Второй закон термодинамики для равновесных процессов может быть записан в виде равенства Лингвистические и термодинамические исследования дали один результат. Понятие энтропия в термодинамике и перевод с греческого языка (evrpoma) наиболее соответствуют техническому смыслу значения этого слова как «неопределенность». Термин энтропия (англ. - entropy) был сформирован Клаузиусом как английская производная от двух греческих слов «EN» - вход (in) и «TROPY» - трансформация (transformation), т.е. внутренние изменения.
TdS=SQ, а для неравновесных процессов в виде неравенства TdS>SQ.
Произведение TdS имеет размерность энергии. Первый закон термодинамики не запрещает переход тепла от холодного тела к горячему, поскольку тепло при низкой температуре составляет то же количество энергии, что и при высокой температуре, при этом исчезновения или возникновения энергии не происходит. Второй закон термодинамики формулирует дополнительные ограничения на тепловые процессы и определяет направление самопроизвольных процессов:
• все естественно протекающие процессы могут происходить самопроизвольно (без компенсации);
• процессы, которые являются обратными природным (естественно протекающим) процессам, могут происходить только при условии, что одновременно с ними происходят компенсирующие превращения.
Из записи Второго закона термодинамики в виде следует, что для анализа появляются две новые величины - абсолютная температура Т и энтропия S. Произведение TdS, служащее для выражения элементарного количества тепла, подводимого к системе в любом обратимом процессе, сходно по форме записи с произведением pdV, служащим для выражения элементарной механической работы. Ввиду этого сходства абсолютная температура Т может характеризоваться как «термодинамическая сила», а энтропия S как «термодинамическая координата». Механическая работа связана с изменением механической координаты V, аналогично, подвод или отвод тепла связан с изменением термодинамической координаты - S. Таким образом, термодинамическое состояние тела определяется внутренней энергией (Первый закон термодинамики) и энтропией (Второй закон термодинамики).
Общая запись Второго закона термодинамики на основании вышесказанного имеет вид:
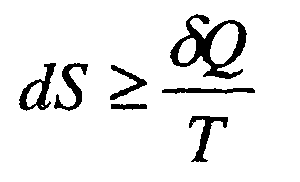

В ур.2.20) величина SQ представляет реальное тепло, переданное (или полученное) системой в неравновесном процессе, а SQ'- тепло, которое было бы получено (или отдано) системой при неравновесном процессе дополнительно к теплу SQ с тем, чтобы компенсировать рост энтропии в реальном неравновесном процессе и восстановить равенство в ур.B.18). Для равновесных процессов SQ'=0, для неравновесных процессов всегда SQ больше O. Следовательно, если какой-либо круговой процесс совершается обратимым путем, то сумма всех превращений в нем равна нулю. Для необратимых процессов появляется слагаемое, описывающее превращение, которое возникает вследствие неравновесности процесса внутри самой системы. Критерием отличия обратимого процесса от необратимого служит изменение энтропии всех тел, принимавших участие в данном процессе в совокупности. Энтропия замкнутой системы никогда не уменьшается. В ходе необратимого процесса суммарная энтропия возрастает самопроизвольно.
Энтропия - это мера неполноценности тепловой энергии, она характеризует степень «дезорганизации» системы. Необратимые процессы увеличивают «дезорганизованность» и тем самым способствуют росту энтропии*. Обратимые процессы только лишь передают энтропию от одного тела к другому.
* Теория минимизации роста энтропии (англ. - theory of generation entropy minimization) была сформулирована А.Бежаном (США) как новый вид комплексного анализа (термодинамика, тепломассообмен, гидрогазодлинамика) на основе Второго закона термодинамики, дающий возможность исследовать необратимые потери в действительных элементах энфгопреобразующих систем и определять пути их минимизации.
Стоимость тепловых насосов
Источником необратимости является отклонение системы от состояния равновесия. Однако, если процесс возврата, выведенной из состояния равновесия системы, протекает бесконечно медленно (квазистатически), то можно считать, что в каждый данный момент имеет место равновесие внутри системы и такой процесс можно считать обратимым. Таким образом, все реальные процессы необратимы, так как протекают за конечное время, что приводит к отклонению системы от состояния равновесия. Понятие «необратимость» в термодинамике эквивалентно понятию «трение» в механике.
Трение - процесс диссипации (рассеяния) энергии, т.е. переход процесса из упорядоченной формы в неупорядоченную.
Наличие трения проявляется в том, что в действительной машине должно быть затрачено работы больше (или получено меньше) для выработки положительного эффекта, чем это было бы необходимо, если бы эта машина была идеальной. Любой реальный
процесс преобразования тепла в работу и наоборот сопровождается увеличением работы на величину, эквивалентную обобщенному трению, которое для системы описывается теоремой Гюи-Стодолы
