ХИМИЧЕСКАЯ ОЧИСТКА ПРОИЗВОДСТВЕННЫХ СТОЧНЫХ ВОД
Для химической очистки производственных сточных вод в настоящее время используются различные реагенты. Наибольшее применение имеют: окислители — хлор, перманганат калия, озон; подщелачивающие вещества — известь, гидроксид натрия, сода; подкисляющие вещества — серная и соляная кислоты.
|
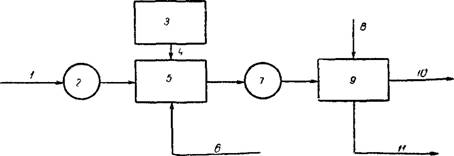
Рис. 5.30. Схема реагентной очистки производственных сточных вод 1 ~ сточные воды обработки цветных металлов, 2 — усреднитель; 3—реагентное хозяйство; 4 — подача реагентов, 5 — смеситель; 6 — нейтрализованные хромистые и щелочные сточные воды; 7—контактный резервуар, 8 — полиакриламид, 9 — отстойники; 10— очищенная вода, 11 — шлам на обезвоживание |
В ряде случаев химическая обработка требуется в качестве предварительной перед последующей биологической очисткой этих сточных вод.
Принципиальная схема реагентной очистки производственных сточных вод показана на рис. 5.30.
Окисление загрязняющих сточные воды веществ применяется в тех случаях, когда эти вещества нецелесообразно или нельзя извлечь или разрушить другими способами, в том числе путем биохимического окисления. К таким веществам относятся цианистые соединения, загрязняющие сточные воды многих производств, например сточные воды фабрик обогащения свинцово-цинковых и медных руд, цехов гальванических покрытий машиностроительных заводов и т. д.
Для очистки сточных вод от цианистых соединений применяют окисление циан-иона CN - до безвредного цианата CNO - или переводят токсичные соединения в нетоксичный комплекс или осадок (в виде нерастворимых цианидов), удаляемый из сточных вод отстаиванием или фильтрованием.
Окисление цианидов до малотоксичных цианатов может быть произведено относительно недорогим окислителем— гипохлоритм в щелоч -
Ной среде при значении рН = 10...11. В качестве реагента, содержащего гипохлорит — ион ОСІ-, служат хлорная известь, гипохлорит кальция или гипохлорит натрия. Между гипохлоритом и цианидами протекают следующие реакции:
В случае простых ядовитых растворимых цианидов
CN—+OCr~->CNO—-fCl~,
Для комплексных ядовитых растворимых цианидов (меди и цинка):
2Cu(CN)3~+70C1~+20H-+H20->6CN0-+7C1-+2CU(0H)2
Ї
ZnfCN)2-+40С1~+20Н—^4CNO~~+4С1-+Zn(OH)2.
-
Образующиеся цианаты легко гидролизуются в воде до совершенно безвредных и нетоксичных карбонатов и аммиака.
CN0-+2H20-»C0!-+NHf.
Как видно из первой реакции, на 1 циан-ион требуется 1 гипохлорит - ион. Так как молекулярная масса хлора равна 71, а циана — 26, то на 26 ч. циана требуется 71 ч. активного хлора, соответственно на 1 ч. циана требуется 2,73 ч. активного хлора (это число показывает необходимое по реакции количество активного хлора для окисления растворимого ядовитого циан-иона до цианат-иона). Следовательно, если в сточной воде концентрация цианидов равна В мг/л, то требуемое теоретически по реакции количество активного хлора равно:
ХС1 = 5-2,73. (5.20)
Из второй реакции видно, что на 6 комплексных циан-ионов меди требуется 7 гипохлорит-ионов, откуда искомый коэффициент равен 71 - 7 : 26-6=3,18. Следовательно, если в сточной воде содержится С мг/л комплексных цианидов меди в пересчете на циан, то требуемое теоретически по реакции количество активного хлора Ха равно:
*с,=С-3,18. (5.21)
Для комплексных цианидов цинка из третьей реакции следует, что для окисления 4 циан-ионов необходимо 4 гипохлорит-иона, т. е. коэффициент пропорциональности, так же как и для простых ядовитых растворимых цианидов, равен 2,73.
При наличии в сточной воде простых цианидов в концентрации В мг/л, комплексных цианидов меди в концентрации С мг/л теоретически необходимое на 1 циан количество активного хлора для окисления их до цианатов равно сумме:
Хс1 = 5-2,73 + С-3,18. (5.22)
Товарная хлорная известь содержит около 20—25% активного хлора, а гипохлорит кальция — до 60%. Требуемое количество реагента X, кг/сутки, определяют по формуле
Х_ *ciQn_ Хс Qn-100
А-10 а-1000 ' 1 ' '
Где Ха — количество активного хлора, необходимое для окисления цианидов и подсчитанное по ранее приведенным формулам, мг/л или г/м3;
Q— количество цианосодержащих сточных вод, м3/сутки; п — коэффициент избытка реагента, принимаемый обычно равным 1,2-1,3;
А — содержание активного хлора в товарной хлорной извести или гипохлорите кальция, %.
Однако при проведении реакции окисления цианидов гипохлорит-ио - ном окислитель может расходоваться не только на цианиды, но и на окисление других веществ, присутствующих в сточной воде. Поэтому значение коэффициента п должно быть найдено для конкретной сточной воды путем пробного ее хлорирования.
Рабочий раствор реагента обычно приготовляют в виде 5%-ной концентрации по активному хлору.
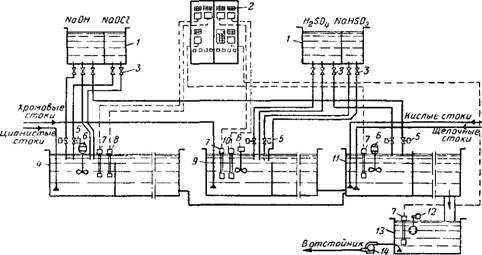
Технологическая схема автоматически работающей установки для обезвреживания сточных вод цеха гальванических покрытий на одном из заводов приведена на рис. 5.31.
|
Рис 5 31. Технологическая схема автоматизированной установки для обезвреживания сточных вод цеха гальванических покрытий / — баки для реагентов; 2 — щит управления и автоматики; 3 — вентили ручного дозирования реагентов; 4 — резервуар для цианистых стоков; 5 — регулирующие вентили; 6 — лопастные мешалки; 7 — датчик рН-метра, 8 — датчик концентрации цианидов; 9 — резервуар для хромовых стоков; 10 — датчик концентрации хрома; 11 — резервуар-нейтрализатор; 12 — поплавковый регулятор; /3—резервуар для обезвреженных сточных вод; 14 — насос для перекачки обезвреженных сточных Вод |
Сточные воды цеха разделены на три группы: первая — содержащие 5—50 мг/л цианидов, вторая—17—105 мг/л шестивалентного хрома Сг6+, третья — кислоты и щелочи.
Каждая группа стоков поступает в отдельный резервуар, рассчитанный на 30—40-минутное пребывание в нем стоков. Часть его полезной емкости (10—15%) является камерой смешения, куда автоматически подаются реагенты, в том числе щелочи и кислоты для поддержания постоянной величины рН. В резервуаре для цианистых стоков рН=10,5, для хромовых стоков рН = 2,5.
Обезвреженные и нейтрализованные стоки направляются в отстойник. Стоки, содержащие простые и комплексные соединения циана, обезвреживаются гипохлоритом натрия.
Обезвреживание хрома в основном происходит в той же технологической последовательности, что и обезвреживание циана.
В качестве реагента для восстановления Сг6+ до Сг3+ используется гидросульфит натрия. Реакция идет сначала в кислой среде. В последующем в щелочной среде Сг3+ выпадает в осадок в виде Сг(ОН)3.
Осаждение гидроксида хрома происходит в отстойнике.
Остаточные концентрации цианидов и хрома в очищенной воде не превышают допустимых санитарными нормами.
Электрохимическое окисление. Электрохимическая обработка производственных сточных вод применяется либо в целях разрушения содержащихся в них вредных веществ путем их электрохимического окисления на аноде, либо в целях извлечения металлов, кислот и других веществ, содержащихся в отработанных растворах.
Так, например, при обработке сточных вод цехов гальванических покрытий и полиметаллических рудообогатительных фабрик, содержащих комплексные цианиды меди, на катодах выделяется 60—70% металлической меди.
Электролиз отработанных травильных растворов, содержащих FeSO* и свободную H2SO4, с применением анионитовых мембран дает возможность регенерировать 80—90% H2S04 и получить порошкообразное металлическое железо (25—50 кг из 1 м3 растворов).
Очищенные в результате электролиза растворы можно полностью использовать при приготовлении свежих травильных растворов и растворов H2S04, загружаемых в анодные камеры электролитической ванны перед следующим циклом очистки.
При обработке концентрированных сточных вод (содержание CN более 1 г/л) электрохимический способ значительно дешевле реагент - ного.
Озонирование. Применение озона для обработки производственных сточных вод обусловлено необходимостью разработки методов глубокой очистки сточных вод с целью их повторного использования.
Высокая реакционная способность озона вступать во взаимодействие со многими минеральными и органическими соединениями, сильное окислительное действие, возможность получения его прямо на станции из кислорода воздуха обусловливают перспективность применения озона В качестве реагента.
Кроме того, озонирование не приводит к увеличению солевого состава очищенной воды, не загрязняет воду продуктами реакции и другими примесями. Это важно при повторном использовании воды для технологических нужд.
Окислительное действие озона объясняется легкостью отдачи им атома кислорода. Под действием озона почти все металлы переходят в окислы.
В процессе обработки сточной воды озон, подаваемый в реактор в виде озоно-воздушной смеси, диспергированной на мельчайшие пузырьки, вступает в химические реакции. Озонирование представляет собой процесс абсорбции, осложненный химической реакцией в жидкой фазе.
Основным промышленным способом получения озона является его синтез из кислорода воздуха под действием электрического разряда в генераторе озона.
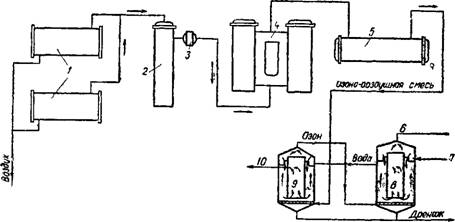
На рис. 5.32 представлена принципиальная технологическая схема озонаторной установки для глубокой очистки производственных сточных вод. Установка состоит из двух самостоятельных узлов: узла получения озона и узла очистки сточных вод.
Узел получения озона состоит из блока подготовки воздуха — очистки и осушки и блока получения озона.
Блок подготовки воздуха включает следующие аппараты: фильтры, теплообменники трубчатого типа, влагоотделитель, осушительную установку.
Кислород или воздух охлаждается в теплообменниках до 6° С и, попадая во влагоотделитель, частично освобождается от капельной влаги. На выходе из влагоотделителя установлен войлочный фильтр.
Для устойчивой работы озонатора предусматривается осушительная установка типа УОВ, которая обеспечивает осушку газа перед озонаторами до содержания влаги 0,05—0,1 г/м3.
Охлажденный, обеспыленный и освобожденный от влаги воздух
Поступает в генератор озона, где под действием тихого электрического разряда образуется озон. При пуске озонаторов первые 15—20 мин они работают «на свечу» до установления нормального режима, а затем переключаются на подачу озоно-воздушной смеси в реакторы.
Сточная вода, прошедшая предварительную очистку на биохимических сооружениях, самотеком или с помощью насосов поступает в контактные резервуары, в которые подается озонированный воздух. Для более полного использования озона и предотвращения попадания его в окружующую среду рекомендуется применение двух последовательно работающих реакторов. При этом обедненная озоно-воздушная смесь
|
Воздух
Рис 5 32. Технологическая схема озонаторной установки —теплообменники, 2 — впагоотделитель, 3 ~ войлочный фильтр, 4 — осушительная установка; 5—генератор озона, 6—отвод отработанного газа, 7—впуск сточной воды, 8 — предварительный реактор, 9 — основной реактор, 10 — выпуск очищенной воды |
Из основного реактора подается в предварительный реактор, где вступает в контакт со свежими порциями воды. Благодаря этому обеспечивается почти полная абсорбция озона водой. В предварительном реакторе протекают преимущественно процессы окисления органических веществ, содержащихся в сточной воде. В основном же реакторе, наряду с процессом окисления, начинается интенсивное стерилизующее действие озона. В верхней части этого реактора при противоточном движении превалируют окислительные процессы, а в нижней части, над филь - тросными пластинами, вода максимально очищается.
Для диспергирования озонированного воздуха в сточной воде используют перфорированные трубы или фильтросные пластины.
В качестве запорной арматуры применяются вентили из нержавеющей стали диафрагменного типа, футерованные фторопластом.
При конструировании озонаторной установки важно правильно подобрать объем реакторов.
Общий объем реакторов определяется по формуле
W^^Qt, (5.24)
Где Q— количество СТОЧНОЙ ВОДЫ, М3/ч;
T — продолжительность пребывания сточной воды в реакторах, ч, определяемая скоростью химической реакции или скоростью массообмена;
Г)—коэффициент увеличения объема воды при - продувке, принимаемый равным 1,1.
Рабочую высоту одного реактора (высоту слоя жидкости в реакторе) рекомендуется принимать при двух последовательно работающих реакторах в пределах 2,5—2,8 м.
Необходимое количество озона, кг/сутки, определяется по формуле
QC
D03 = ——, (5.25)
03 1000 . V )
Где Q—расход воды, обрабатываемой озоном, м3/сутки;
С — необходимая доза озона, г/м3.
Количество озонаторов определяется исходя из производительности серийно выпускаемых озонаторов
« = (5.26)
<7оз
Где D03 — необходимое количество озона для обработки сточной воды, кг/ч;
9оз — производительность одного озонатора, кг/ч; г| — коэффициент запаса, принимаемый равным 1,05—1,1.
Расход электроэнергии на синтез озона, без учета затрат на вспомогательные процессы, при условии использования в качестве сырья атмосферного воздуха, составляет в среднем 18 кВт-ч на 1 кг озона. В случае применения кислорода в качестве сырья для синтеза озона затраты электроэнергии снижаются вдвое.
Рассмотренная технологическая схема предусматривает использование очищенной воды для производственного водоснабжения или спуск озонированных сточных вод в водоем с гарантией сохранения его чистоты, так как полностью обеспечиваются санитарные требования по всем показателям.
Озонирование пока не получило широкого применения из-за его сравнительно высокой стоимости, что обусловлено в основном низким выходом озона на современных генераторах. Усовершенствование техники получения озона и более полное его использование снизят энергетические затраты на производство озона и повысят экономическую эффективность процесса в целом.
Нейтрализация. Производственные сточные воды многих отраслей промышленности содержат кислоты и щелочи. Интенсивность кислотной или щелочной реакции воды определяется показателем концентрации водородных ионов — значением рН. Для предупреждения коррозии материалов канализационных сооружений и нарушения биохимических процессов, происходящих в очистных сооружениях и в водоемах, такие воды подвергаются нейтрализации. Нейтрализация нередко производится также в целях осаждения из сточных вод солей тяжелых металлов.
Во всех случаях учитывают возможность взаимной нейтрализации кислот и щелочей, сбрасываемых со сточными водами, а также щелочной резерв бытовых сточных вод и нейтрализующую способность воды водоемов. Практически нейтральной принято считать смесь с величиной рН в пределах 6,5—8,5, поэтому сточные воды, рН которых ниже 6,5 или выше 8,5, перед отведением в городскую канализацию или в водоем подлежат нейтрализации.
Процесс нейтрализации осуществляется в нейтрализаторах проточного или контактного типа, которые могут конструктивно объединяться с отстойниками.
При благоприятных местных условиях осветление нейтрализованной сточной воды может производиться в накопителях, рассчитываемых на хранение в них осадка в течение 10—15 лет.
Выбор способа осветления (в отстойниках, осветлителях или накопителях) производится на основе технико-экономических расчетов.
Объем выпадающего осадка зависит от концентрации в нейтрализуемой сточной воде кислоты и ионов тяжелых металлов, а также от вида и дозы реагента, от полноты осветления и т. д. Наибольшее количество осадка выпадает при нейтрализации сточной воды известковым молоком, приготовленным из товарной извести, которая содержит 50% активной окиси кальция.
Количество осадка, образующегося при нейтрализации 1 м3 сточной воды, содержащей свободную серную кислоту и соли тяжелых металлов, ориентировочно можно определить по формуле
М = 100 ~а- (Xl + Хг) + + (У І + *V - 2), (5.27)
Где М—количество сухого вещества, кг/м3;
Хг — количество активной СаО, необходимой для осаждения металлов, кг/м3;
Х2—количество активной СаО, необходимой для нейтрализации свободной серной кислоты, кг/м3;
Х3 — количество образующихся гидроксидов металлов, кг/м3;
Yx — количество сульфата кальция, образующегося при осаждении металлов, кг/м3;
У2 — количество сульфата кальция, образующегося при нейтрализации свободной серной кислоты, кг/м3; а — содержание активной СаО в используемой извести, % (третий член в формуле не учитывается, если значение его отрицательно) .
Объем осадка, образующегося при нейтрализации 1 м3 сточной воды, определяется по формуле
т
(5.28)
100- Рвл'
Где Рос — объем осадка, выделившегося из 1 м3 нейтрализуемой воды, %;
РБЛ —влажность осадка, %. При нейтрализации солянокислых сточных вод травильных отделений протекают следующие реакции:
Известковым молоком, тестом и сухой молотой известью:
4НС1+Са(0Н)8+СаС0з->2СаС0з+С0г+ЗН20;
2FeCl2+Ca(0H)3+CaC03->Fe(0H)3+FeC03-f2CaCl2;
Содопоташной смесью:
4HCl+Na2C03+K2C03->2NaCl+2KC14-2C024-2H30;
2FeCl2+NaaC03 - f-K2C03 ->2FeC03+2NaCl+2KCl;
Кальцинированной содой:
2HCl+Na2C03->2NaCl+C02+H20;
FeCl2-fNa2C03^FeC03-f2NaCl;
Гидроксидом натра:
НС 1-f NaOH->NaC 1 - f НаО; FeCla+2NaOH->Fe(OH)a+2NaCl.
В результате нейтрализации в осадок выпадает только железо в виде гидрата закиси или в виде карбоната.
Гидрат закиси железа имеет зеленую окраску, растворимость его составляет 4,5-Ю-4 г/л. Карбонат железа выпадает в виде серого осадка. Во влажном состоянии он быстро зеленеет, а затем буреет вследствие
гидролиза и окисления с образованием гидроксида железа. Растворимость карбоната железа 5,79-10-4 г/л. Остальные продукты нейтрализации, а также избыток вводимых реагентов остаются в растворе, повышая солесодержание нейтрализованных стоков.
На основании стехиометрических соотношений реакций нейтрализации необходимые дозы реагентов могут быть определены по формулам, г/л:
|
Л |
ЮО/Сі ____ - . _ .
(1,67HCl-fO,96FeCl2);
Na2C0a+K2C03 — ^
|
^Na2C03 ^NaOH |
|
ЮО/Сз |
|
(5.29) |
ЮО/С2
(l,45HCl+0,84FeCl2); (l, lHCl+0,63FeCla);
|
Д |
|
Са(ОН) 2 - f СаС03 |
ЮО/С4
(0,77HCl+0,44FeCl3),
Где Ki, КІ — коэффициент запаса расхода реагента по сравнению с теоретическим;
Аъ..., А4—активность товарных реагентов, определяется анализом, %;
НС1 и FeCl2 — концентрация соляной кислоты и хлорида железа в стоках, определяемая анализом, г/л.
Расчетные данные по расходу кислоты для нейтрализации щелочи приведены в табл. 5.9.
Таблица 5.9 Количество кислот, требуемое для нейтрализации 1 г щелочи
|
Щелочь |
Количество 100%-ной кислоты, г |
||||
|
H2so4 |
Неї |
Hno3 |
|||
|
Гидроксид натрия . . |
1,22 |
0,91 |
1,57 |
||
|
Гидроксид калия . , . |
0,88 |
0,65 |
1,13 |
||
|
Известь гашеная . . . |
1,32 |
0,99 |
1,7 |
Нейтрализация производственных сточных вод реагентами затруднена тем, что состав и приток сточной воды на установку резко колеблются в течение суток. Вместо устройства усреднителей большой вместимости в этих условиях следует применять автоматическое регулирование подачи реагентов. За регулируемый параметр во многих случаях может быть взята величина рН сточной воды. Для измерения рН поступающих сточных вод следует применять погружные датчики, которые в меньшей степени подвержены засорению. Для измерения рН очищенных стоков могут применяться проточные датчики.
Нейтрализация путем смешения кислых стоков со щелочными. Режимы сброса сточных вод, содержащих кислоту и отработавшую щелочь, на заводах, как правило, различны. Кислые воды обычно сбрасываются в канализацию равномерно в течение суток и имеют постоянную концентрацию; щелочные воды сбрасываются периодически один или два раза за смену по мере того, как срабатывается щелочной раствор. В связи с этим для щелочных вод часто необходимо устраивать регулирующий резервуар, объем которого должен быть достаточным, чтобы принять суточное количество щелочных вод. Из резервуара щелочные воды должны равномерно выпускаться в камеру, где в результате смешения их с кислыми водами происходит нейтрализация.
Баланс кислых и щелочных сточных вод составляется на период, в течение которого производится выпуск сточных вод от всех цехов и агрегатов, в том числе таких, от которых стоки спускаются периодически.
Нейтрализация стоков путем добавления реагента. Если сточные воды содержат больше кислоты или щелочи, чем может быть нейтрализовано при взаимодействии стоков, то добавляют соответствующие реагенты.
Этим методом наиболее часто пользуются для нейтрализации кислот. Обычно реагентом служат отходы местного производства, в частности шлам химводоочистки ТЭЦ (мел в шламовой воде) и другие отработавшие щелочи.
Для обезвреживания сточных вод, содержащих серную кислоту, и образующихся при травлении металлических изделий используются отходы металлургической промышленности: шлаки сталеплавильного, фер - рохромового и доменного производства. Основными компонентами этих шлаков являются соединения кальция — 30—59% (в пересчете на СаО), до 17% оксида магния и до 39% соединений кремния (в пересчете на БЮг). Высокая дисперсность шлаков позволяет использовать их в естественном состоянии, минуя измельчение. Значительно меньшая стоимость шлаков по сравнению с известью обусловливает экономическую целесообразность их использования. Для нейтрализации применяют и другие реагенты. Выбор реагента производится в зависимости от характера нейтрализуемых сточных вод и их концентрации с учетом того, будут ли образующиеся при нейтрализации соли выпадать в виде осадка или оставаться в растворе.
Для нейтрализации минеральных кислот применяют любой щелочной реагент, дающий в растворе гидроксил-ионы ОН-; чаще всего применяют едкие, углекислые и двууглекислые щелочи. Наиболее дешевыми реагентами являются Са(ОН)2 (в виде пушонки или известкового молока), а также карбонаты кальция и магния (в виде дробленого мела, известняка и доломита). Гидроксид натрия и соду применяют только в тех случаях, когда эти реагенты являются отходами местного производства.
В качестве реагентов для нейтрализации органических жирных кислот применяют известь, содержащую не менее 25—30% активного оксида кальция, или смесь извести с 25%-ной технической аммиачной водой (NH4OH). Добавление аммиака способствует последующей биологической очистке этих вод и снижает содержание известкового шлама. Различают три вида кислотосодержащих сточных вод: воды, содержащие сильные кислоты (НС1, HN03), кальциевые соли которых хорошо растворимы в воде; для нейтрализации этих кислот может быть использован любой из указанных выше реагентов;
Воды, содержащие сильные кислоты (H2S04, H2S03), кальциевые соли которых трудно растворимы в воде;
Воды, содержащие слабые кислоты (Н2СО3, СН3СООН). При нейтрализации сильных кислот, кальциевые соли которых трудно растворимы в воде, эти соли не только выпадают в осадок, но при больших концентрациях могут отлагаться на поверхности нейтрализующего материала, что тормозит ход реакции.
Наиболее часто приходится иметь дело с нейтрализацией серной кислоты; реакция нейтрализации в этом случае в зависимости от применяемого реагента протекает по уравнениям:
H2S04-fCa(0H)2=CaS04+2Ha0
И
H2S04+CaC03=CaS04+H20+C02.
Растворимость сульфата кальция (гипса) CaS04-2H20 при 18°С составляет 2,02 г/л (в пересчете на CaS04 1,6 г/л). При более высокой концентрации сульфат кальция выпадает в осадок.
При нейтрализации сильных кислот углекислыми солями образующаяся в результате реакции углекислота в свою очередь может вступить в реакцию с избытком СаСОз и привести к образованию гидрокарбоната кальция:
C02-F На0+СаС0з=Са(НС08)я.
Однако эта реакция протекает медленно, поэтому в течение того времени, в которое практически заканчивается нейтрализация сильных кислот, успевает прореагировать только незначительная часть углекислоты. Так же медленно, как и углекислота, реагируют с карбонатами и другие слабые кислоты.
Теоретическое количество оснований и солей, требуемых для нейтрализации кислоты, приведено в табл. 5.10.
Таблица 5.10
|
Количество оснований и солей, г, требуемых для нейтрализации 1 г кислоты
|
Доза реагента определяется из условия полной нейтрализации свободной кислоты и принимается несколько больше расчетной. Так, например, при нейтрализации сернокислотных сточных вод известковым молоком доза активного оксида кальция берется на 10%, а при сухом дозировании — на 50% больше расчетной. Практически принимают: 1 мае. ч. извести на 1,5 мае. ч. серной кислоты и 1 мас. ч. на 1 мае. ч. соляной и азотной кислоты.
Для нейтрализации небольших количеств кислых вод (до 200 м/сутки) могут быть применены также растворы гидроксида натрия, соды и др.
В качестве реагента известь вводится в виде известкового молока (способ мокрого дозирования) или в виде сухого порошка (способ сухого дозирования); реже применяются мелкодробленый известняк, мел или доломит крупностью зерен не более 0,5 мм (способы сухого дозирования).
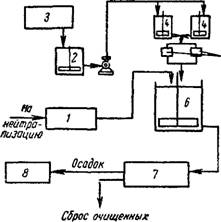
При производительности установки более 5 т/сутки нейтрализуемой кислоты при сухом дозировании выгоднее применять в качестве реагента известь-пушонку. Для установок с небольшим суточным количеством поступающей в сток серной кислоты (примерно до 5—7 т/сутки) более рациональной является нейтрализация известкозым молоком (рис. 5.33).
В число основных сооружений установки входят: резервуары-усреднители кислых и щелочных стоков 1 камеры реакции-нейтрализаторы 2; отстойники для нейтрализованных сточных вод или накопители 3, являющиеся одновременно отстойниками и емкостью для осадка; сооружения для обезвоживания осадков 4; реагентное хозяйство (дозаторы 5, растворные баки 6, аппараты для гашения извести 7, склад негашеной извести 8).
На складах известь хранится в виде теста или в сухом виде в закрытых бункерах. Хранение сухой извести навалом не допускается.
Подача известкового теста из склада к месту приготовления известкового молока может производиться грейферным краном; подачу сухой извести следует производить закрытыми транспортерами и элеваторами для обеспечения минимального пыления.
Применение гашеной извести для нейтрализации предусматривается
в виде известкового молока 5%-ной концентрации по активной окиси кальция.
Для гашения извести и приготовления известкового молока используются безотходные известегасильные установки — шаровые мельницы с классификаторами или известегасильные машины.
|
Сточных вод |
|
WTSfw |
|
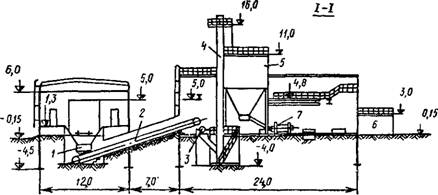
Рис 5.34. Механизированная установка для приготовления растворов извести производительностью 20 т/ч при сухом способе ее хранения |
|
JT |
І |
, м |
|
W |
О) |
^ Г |
|
F ^ |
||
|
-: |
|
А*Д |
|
/ — пластинчатый питатель ППН-6, 2 — ленточный транспортер; 3 — дробилка молотковая; 4—элеватор ковшовый, 5—бункер дробленой извести, 6—резервуар для хранения 5%-иого известкового молока; 7 —шаровая мельница; 8 — классификатор; 9 — насосы 6НФ; 10 — насосы 2НП |
Наиболее часто применяемая схема известкового хозяйства при сухом способе хранения извести приведена на рис. 5.34.
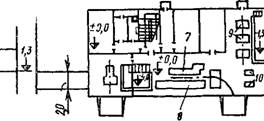
Рис. 5.33. Принципиальная схема ней - трализационной установки
1 — резервуары-усреднители; 2 — аппараты для гашения извести, 3 — склад негашеной иззести; 4—растворные баки, 5 — дозаторы; 6 — нейтрализаторы, 7— отстойники, 8 — сооружения для обезвоживания осадКов
|
План |
Поступающая комовая известь разгружается в приемный бункер. Отсюда с помощью пластинчатого питателя ППН-6 известь подается на транспортер и далее в дробилку.
Известковое молоко поступает в резервуар концентрированного молока и перекачивается насосами 2НП в расходные резервуары, где насосами типа НФ поддерживается во взвешенном состоянии. Эти же насосы подают известковое молоко на дозирование.
Дозирование извести осуществляется автоматическим дозатором в зависимости от расхода или величины рН очищаемой сточной воды.
При мокром способе хранения поступившая комовая известь загружается непосредственно в емкости для приготовления и хранения известкового теста; предварительно они наполняются до половины водой.
При определении полезного объема склада принимают, что из 1 объема извести получается 4 объема известкового теста плотностью 1,4 т/м3.
Помещение склада извести не отапливается, так как сильно нагревшаяся при гашении известь остывает медленно.
По мере надобности известковое тесто грейферным краном подается в бункер; сюда же подается вода под давлением 0,2—0,3 МПа. Приготовленное в бункере концентрированное молоко поступает на грохот, где из него выделяются частицы крупностью более 25 мм. Мелкие частицы поступают в шаровую мельницу, работающую в замкнутом цикле с классификатором. Дальнейшие операции такие же, как при сухом способе хранения извести.
Крупные отходы с грохота попадают в бункер перед дробилкой, которая измельчает их до крупности 25 мм; измельченная масса вновь подается на грохот.
Состав сооружений и оборудования станции нейтрализации выбирается в зависимости от расхода, концентрации кислоты и наличия в сточной воде тяжелых механических примесей. Для удаления последних могут предусматриваться песколовки, устанавливаемые перед усреднителями.
Приготовление рабочего раствора известкового молока концентрацией 5—10% активного оксида кальция производится в растворных баках. Баки оборудуются мешалками на вертикальной оси с частотой вращения не менее 40 мин-1; применяется также перемешивание рабочего раствора воздухом с интенсивностью аэрации 0,8 м3/(м2-мин) или насосами.
Подача рабочего раствора в нейтрализуемую воду производится при помощи насосов или различных дозаторов (черпаковых, поплавковых, тарированных насадок с постоянным напором и т. п.). Дозаторы блокируются с автоматическими рН-метрами, обеспечивающими надежность и непрерывность процесса нейтрализации. Для транспортирования рабочих растворов применяются полиэтиленовые трубы и кислотостойкие насосы.
Скорость движения раствора по трубам должна быть не менее 1,5 м/с.
Все оборудование установок нейтрализации размещается в реагент - ном здании, в котором находятся установки для гашения извести, приготовления известкового молока и его дозирования.
Для перемешивания реагента со сточной водой применяются смесители любого типа.
Продолжительность контакта сточных вод и реагента в камерах реакции обычно не превышает 5 мин; при наличии в кислых водах ионов тяжелых металлов она увеличивается до 30 мин.
При небольшом количестве нейтрализуемых сточных вод применяются контактные нейтрализаторы, при значительном расходе сточных вод — проточные.
Для выделения из нейтрализованной сточной воды нерастворенных примесей (сульфата кальция, гидроксидов тяжелых металлов и т. п.) применимы отстойники любого типа, рассчитываемые на пребывание в них сточной воды в течение 2 ч. Продолжительность отстаивания может быть уменьшена путем введения в воду флокулянтов (например, полиакриламида) при соблюдении оптимальных условий их действия (дозы, величины рН воды и пр.).
Осветленная вода используется в оборотных циклах водоснабжения или сбрасывается в канализацию.
Осадки, выделенные в отстойниках, обезвоживаются на шламовых площадках, барабанных вакуум-фильтрах или фильтр - прессах. Шламовые площадки с дренажем устраиваются на открытом воздухе, а при необходимости — в закрытых утепленных помещениях. Размеры площадок в закрытых помещениях определяются из расчета 10—15 м3 осадка на 1 м2вгод. При расположении шламовых площадок на открытом воздухе расчет необходимой площади следует вести из условий намораживания.
Обезвоживание осадка на вакуум-фильтрах предусматривается при количестве сухого вещества в осадке не менее 25 кг/м3 и соотношении гипса и гидроксида не менее 3:1. При расчете вакуум-фильтров следует принимать нагрузку на фильтр 15— 20 кг/(м2-ч), считая по сухому веществу, частота вращения барабана 0,4 мин-1, поддерживаемый вакуум 53,32—79,98 кПа, в качестве фильтрующей ткани применяют капрон и бельтинг.
С целью сокращения объемов образующихся осадков применяется способ многократного их использования в процессе нейтрализации (рис. 5,35).