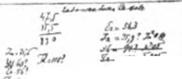ИЗ ЧЕГО СОСТОИТ ВСЕЛЕННАЯ (ЗАКОН МЕНДЕЛЕЕВА)
КАК БЫЛ ОТКРЫТ ВЕЛИКИЙ ЗАКОН
Концу 60-х годов прошлого века было известно уже ^ 63 химических элемента.
Открытия новых элементов совершались случайно. Изучая те или иные вещества, химик обычно не подозревал, где и когда он может натолкнуться на новый вид атомов.
Так, химик Балар исследовал рассолы соляных промыслов Средиземного моря. Пропуская однажды через рассол газ хлор, он заметил, что цвет рассола изменился, стал бурым. Учёный заинтересовался этим явлением, и ему удалось установить, что эту окраску сообщала рассолу неизвестная жидкость бурого цвета с резким неприятным запахом. Оказалось, что им был открыт новый химический элемент. Он назван был бромом.
Столь же случайно открыты были иод, кадмий и другие химические элементы.
Никто не знал, сколько имеется ещё в природе неоткрытых «кирпичей мироздания». Возможно, что число их достигает многих сотен. Вместе с тем, как уже говорилось, открытые элементы изучались главным образом сами по себе, вне какой-либо взаимосвязи.
Так обстояло дело до 1869 года.
В этом году в марте месяце на заседании Русского химического общества в Петербурге было зачитано сообщение молодого русского химика Дмитрия Ивановича Менделеева об открытой им зависимости свойств химических элементов от их атомного веса. Менделеев был в это время болен; его сообщение прочёл за него известный русский химик Н. А. Меншуткин.
В своём сообщении Д. И. Менделеев писал, что он создал естественную систему всех химических элементов, в которой элементы располагались в порядке возрастания их атомных весов. Оказывается, что в такой системе наблюдается замечательная закономерность: свойства расположенных в таком порядке химических элементов повторяются через определённые правильные промежутки, повторяются периодически. Д. И. Менделеев так и назвал свою систему — периодической системой элементов.
«Элементы, расположенные по величине их атомного веса, представляют явственную периодичность свойств.
Сходственные по химическим отправлениям элементы представляют или близкие атомные веса или последовательно и однообразно увеличивающиеся...
Величина атомного веса определяет характер элемента...», — писал Д. И. Менделеев в заключении своего доклада Химическому обществу.
Это было открытие того общего, что объединяло химические элементы в единое целое.
Периодическая система элементов Д. И. Менделеева устанавливала связь между основными веществами мироздания, показывала закономерность в изменении их
|
Великий русский химик Дмитрий Иванович Менделеев. |
Свойств; она говорила о единстве основных веществ природы, о единстве материи.
Это было открытие великого закона природы. Конечно, открытие Д. И. Менделеева не было «счастливым случаем».
Вот как рассказывает об этом Д. И. Менделеев (по воспоминаниям его сына):
«Я был с самого начала убеждён в том, что самое основное свойство атомов, атомный вес или масса атома, должно определять основные свойства каждого элемента. В этом убеждении и были предприняты ещё со студенческой скамьи две мои первые более серьёзные работы: „Изоморфизм" и „Удельные объёмы". Этот путь неизбежно должен был привести меня к периодической системе — достаточно было итги им до конца. Ведь изоморфизм, т. е. способность различных веществ давать одинаковые кристаллические формы, есть одно из типичных свойств элементов одной и той же химической группы... Точно так же и удельные объёмы, т. е. величины, обратные плотностям, дают, как я впоследствии наблюдал, один из наиболее ярких примеров периодичности, повторяемости свойств простых тел при возрастании их атомного веса...
...Я уже тогда, в первые годы самостоятельного труда, чувствовал, что должно существовать обширное обобщение, связывающее атомный вес со свойствами элементов. Это вполне естественная мысль, но на неё не обращали тогда достаточного внимания. Я искал это обобщение с помощью усидчивого труда — во всех возможных направлениях. Только весь этот труд дал мне необходимые точки опоры и вселил уверенность, позволившую мне преодолевать препятствия, казавшиеся тогда непреодолимыми...».
Великий русский учёный Д. И. Менделеев оставил труды по самым разнообразным отраслям науки. Долгое время он был управляющим «Главной палаты мер и весов», которая под его руководством превратилась в передовой научно-исследовательский институт измерений. «Достигнутая Главной палатой точность взвешивания превосходит точность, достигнутую... в Англии и Франции», — писал Д. И. Менделеев. Быстрое введение метрической системы мер и весов в Советской России после Великой Октябрьской социалистической революции было подготовлено работами Менделеева.
Д. И. Менделеев был одним из первых энтузиастов воздухоплавания; он оказывал горячую поддержку русским изобретателям в этой области. Он совершил полёт на воздушном шаре с научными целями во время полного затмения Солнца.
Д. И. Менделеев был изобретателем нового способа изготовления бездымного (пироколлодийного) пороха.
Великий патриот родины, Д. И. Менделеев уделял много внимания развитию отечественной промышленности. Он выдвинул много очень ценных идей, писал о необходимости полной, комплексной переработки нефти, об использовании энергии наших рек и о постройке Волго- Донского канала, осушения Полесских болот и т. д.
Менделеев первым указал на возможность подземной газификации углей.
Однако основной работой Д. И. Менделеева, принесшей ему славу великого учёного, является открытый им периодический закон, периодическая система химических элементов.
Д. И. Менделеев не был первым учёным, который искал единства в разнообразии химических элементов. Мысль о закономерной связи между свойствами химических элементов возникла ещё в XVIII веке.
До великого русского химика некоторые иностранные учёные безуспешно пытались найти закономерность среди химических элементов.
Так, в 1862 году француз Шанкуртуа, располагая элементы по спиральной линии, нанесённой на цилиндр, пытался установить между ними связь. Ничего хорошего из этого у него не получилось.
Немецкий химик Л. Мейер, сопоставляя группы сходных по своим свойствам элементов, заметил, что изменение свойств элементов находится в зависимости от их атомных весов. Однако он не только не сумел сделать из этого тех замечательных выводов, какие сделал Д. И. Менделеев, он просто не понял значения этой зависимости. По словам Д. И. Менделеева, Мейер воспринял только «внешнюю сторону идей, соответствующих периодическому закону», не поняв сущности этого закона. Более того, Мейер совсем не был уверен в справедливости своих наблюдений. «Вообще в настоящее время на подобного рода аргументы не следует ни слишком много полагаться, ни ожидать от них... решения вопроса...», — писал он по этому поводу. Это не помешало ему, однако, после открытия Менделеева утверждать, что именно он, а не русский химик открыл периодический закон.
Недобросовестность Мейера разоблачил сам Менделеев. Он доказал, что Мейер напечатал свою статью о системе элементов лишь после того, как прочитал сообщение Д. И. Менделеева об открытии периодического закона.
Далёк был от открытия периодического закона и англичанин Ньюландс, также претендовавший на первенство. Ныоландс пытался создать систему химических элементов, объединяя их в так называемые «октавы». При этом он совершенно произвольно и бездоказательно взял за основу якобы существующее сходство между повторяемостью свойств химических элементов и повторяемостью звуков в музыкальной гамме. Исходя из этого, он и разместил все известные ему элементы по «октавам» — строчкам — по семь элементов в каждой. Понятно, что такая искусственная классификация не могла дать и не дала ничего хорошего. В одних случаях Ньюландс вынужден был ставить на одно место два элемента, в других — произвольно переставлять элементы, не считаясь с их атомными весами. «Закон октав» Нью-- ландса заключал в себе больше исключений, чем подтверждений зависимости свойств химических элементов от их атомных весов.
В этом году Комиссией по истории химии при Академии Наук СССР опубликованы новые очень интересные документы по истории открытия периодического закона. Особый интерес представляет недавно найденный первоначальный набросок периодической системы химических элементов, написанный рукой Д. И. Менделеева (рис. 6). Из этого наброска видно, каким путём шёл великий русский химик к открытию периодического закона, как он последовательно создавал таблицу химических элементов.
Первоначальный черновой набросок периодической системы показывает, что Д. И. Менделеев сделал своё открытие в результате большой, совершенно самостоятельной творческой работы. Ещё не так давно в некоторых книгах, посвящённых периодическому закону, можно было встретить рассказ о том, что Менделеев открыл свой закон во сне. Найденный набросок периодической
|
|
«Л Ыь 4$Ш
-ччл> &>* *--ч Щ1>ь
К.» Г. у ^<С' Л./З^ Я. ы &.& Л.+ 7»ф
/*А 4«*' Я-ж
А*КЪ4 Ь* 4‘Пй Л-*»
|
| //<•Л^, ^ ^ £*«|Г.4^ /Ы 4-4у М&р^ я « «Г» Ч г* ;****. »**• чцг 5!--.ж ^*»л |Л/Г‘ * * - ?• V 4*й 5£ л.« А 1- Ас^С..п,1 ЛС'Ял Ы •»%* **‘14 |
А***щ ^
’уГ'/у
|
V* ел* мг л** 6 $ 1& * |
«I
Рис. 6. Фотокопия одного из первых набросков периодической системы, написанных Д. И. Менделеевым.
Системы полностью опровергает эту наивную и вредную сказку. Первоначальный черновик таблицы показывает, что Д. И. Менделеев открыл великий закон не благодаря «счастливому случаю», как любят нередко утверждать буржуазные историки науки, а в результате сознательной деятельности, в результате большого творческого труда, на основании своих огромных знаний.
В отличие от иностранных учёных, пытавшихся создать чисто искусственные системы элементов, Менделеев в своих работах руководствовался совсем иным. Русский учёный был глубоко уверен в том, что масса атома определяет его свойства, и, исходя из этого, искал тот общий закон природы, который устанавливает, определяет эту связь. Задача эта, однако, значительно осложнялась тем, что в то время атомные веса многих элементов были определены неточно.
«Меня неоднократно спрашивали: на основании чего, исходя из какой мысли, — найден был мною и упорно защищаем периодический закон? — писал Д. И. Менделеев.—Приведу... свой посильный ответ... Посвятив свои силы изучению вещества, я вижу в нём два таких признака или свойства: массу, занимающую пространство и проявляющуюся в притяжении, а яснее или реальнее всего в весе, и индивидуальность, выраженную в химических превращениях, а яснее всего формулированную в представлении о химических элементах... невольно зарождается мысль о том, что между массою и химическими элементами необходимо должна быть связь, а так как масса вещества, хотя и не абсолютная, а лишь относительная выражается окончательно в виде атомов, то надо искать... соответствия между индивидуальными свойствами элементов и их атомными весами».
В поисках этой зависимости Менделеев старался сблизить, сопоставить не только сходные, но и несходные элементы: «В сопоставлении несходных элементов заключается, по-моему, основной признак, отличающий мою систему от систем моих предшественников», — писал Д. И. Менделеев в 1871 году. В этом заключается основная идея, из которой исходил Д. И. Менделеев в своём открытии.
Как известно, своё изучение зависимости у химических элементов он начал с сопоставления двух наиболее несходных групп элементов — щелочных металлов и галоидов. Менделеев писал, что он «...поставил целью изучить закономерности во взаимоотношении гр у п п».
Для сопоставления групп элементов друг с другом великий учёный пользовался небольшими картонными карточками. На каждой из них он писал название одного из элементов, его атомный вес и основные свойства.
Располагая такие карточки в различных сочетаниях, Д. И. Менделеев получил возможность наглядно изучать всё многообразие свойств различных химических элементов. Первоначальный набросок системы, о котором мы говорили выше, показывает, что Д. И. Менделеев пришёл к открытию периодического закона, располагая элементы по их сходству и по их атомным весам.
Представьте себе ряд химических элементов, расположенных в порядке возрастания их атомных весов.
При первом взгляде на такой ряд не видно никакой последовательности в изменении свойств химических элементов. Ни один элемент не походит на своих соседей. Сходство, однако, имеется, но не у элементов, стоящих рядом, а у элементов, отстоящих один от другого, разделённых другими, несходными химическими элементами.
На рисунке 7 приведена периодическая система элементов в том виде, как она была впервые опубликована Д. И. Менделеевым. Вторым по порядку в этой таблице стоит элемент литий (1л). Это—лёгкий, так называемый щелочной металл (соединяясь с водой, он образует щёлочь). За ним следуют шесть элементов, свойства которых иные, чем у лития. Но седьмой элемент, натрий (Ка) снова повторяет свойства лития; это—тоже щелочной металл. Ещё через шесть элементов, через период элементов, мы видим новый щелочной металл — калий (К).
Но, может быть, такое повторение свойств случайно?
Нет, оно не случайно.
Проследим, например, как повторяются свойства соседа лития — лёгкого металла бериллия (Ве)—третьего по счёту химического элемента в таблице Менделеева (см. рис. 7). И здесь, оказывается, его свойства повторяются через определённый период, именно, через шесть элементов находится химический элемент магний (М^), тоже лёгкий металл, повторяющий в основных чертах свойства своего «родственника». Пропустите ещё шесть
|
ОСНОВАННОЙ НА ИХЬ АТОМНОМЪ вгсъ И ЛИМИЧЕСКОИЪ сходств«
|
|
Д. МендвдЪевъ |
Рис. 7. Периодическая система химических элементов в том виде, в каком она была зпервые опубликована в 1869 году.
Элементов, и вы увидите кальций (Са), напоминающий по своим свойствам бериллий и магний.
Таким же образом повторяются свойства бора (В) у элемента алюминия (А1), стоящего на седьмом после него месте, свойства фтора (Б) — у хлора (С1) и т. д.
«По мере возрастания атомного веса, — пишет великий русский химик, — элементы сперва имеют все новые изменчивые свойства, а потом эти свойства вновь повторяются в новом периоде, в новой строке и в ряде элементов, и в той же последовательности, как в предшествовавшем ряде. А потому закон периодичности можно формулировать следующим образом: свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости (то-есть правильно повторяются) от их атомного веса».
В современной периодической таблице Менделеева свойства химических элементов повторяются уже не через шесть, а через семь элементов, так как позднее были открыты ещё так называемые инертные газы, занявшие в периодической системе особую, нулевую группу.
Такая закономерность наблюдается в менделеевской таблице, однако лишь до четвёртого периода (см. таблицу на стр. 40). С четвёртого периода периодическая зависимость наблюдается уже не через семь, а через семнадцать элементов. Так, следующий за калием (№ 19) щелочной металл рубидий располагается уже под № 37. Ещё через 17 элементов идёт щелочной металл цезий. За галоидом хлором идёт через семнадцать элементов галоид бром и т. д.
Определённые свойства химических элементов повторяются в таблице Менделеева через определённое число элементов, через период элементов.
Свойства несходных химических элементов в одном периоде изменяются также не случайно. И здесь имеется вполне определённая закономерность. Первым в периоде стоит химически активный, легко вступающий в соединения металл (см., например, период, начинающийся с лития), за ним идёт металл, менее химически активный (бериллий); далее стоит элемент ещё менее активный, его металлические свойства выражены ещё слабее (бор). Затем мы видим уже переход от металлов к неметаллам (углерод, азот). Здесь химическая активность элементов идёт по восходящей линии: первый из элементов (азот) — наиболее неактивный, следующий (кислород) — уже значительно более активный металлоид (металлоид значит
Неметалл) и последним стоит очень активный металлоид (фтор).
Таким образом, в одном периоде охватывается группа несходных элементов, отражающая многообразие всех химических элементов вообще.
«Между элементами, расположенными по величине атомных весов, — пишет Д. И. Менделеев, — представляется ясное соотношение не только по формам соединений, но и по другим химическим и физическим признакам. В начале строк стоят наиболее резкие металлы, на конце — самые ясные представители металлоидов...».
Периодическая система элементов Д. И. Менделеева, объединив в одно целое разрозненные до этого химические элементы, показала их естественную последовательность. Она является естественной классификацией химических элементов.
Вместе с тем периодическая система элементов явилась основой для исправления их атомных весов, а также позволила научно предсказывать существование в природе новых, ещё неизвестных химических элементов и их свойств!