ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Примеси, выщелачиваемые с помощью воды и пара. Практически все из проведенных ранее исследований коэффициентов распределения проводились с использованием простых систем, т. е. систем, состоящих из растворенного в чистой воде одного соединения. Кажущийся коэффициент распределения K'd определялся по полным концентрациям элемента в конденсате пара (Cs) и воде (Cw), т. е. в грубом приближении он зависит от отношения Cs /Cw. Описание метода определения коэффициента K'd можно найти в работе [4, стр. 13 - 28].
Определение химического состава смешанной окись-гидроокис - ной системы, полученной при этих условиях, оказывается весьма сложной задачей, поскольку ионное состояние любого элемента в растворе зависит от ионных состояний и растворимостей всех других соединений в растворе.
На основе этого предположения с учетом того, что SiO 2 является основным компонентом гранита и оказывается относительно растворимым соединением, вполне целесообразно предположить, что коэффициент K'j кремнезема будет менее всего зависеть от изменений ионного состояния или растворимостей всех других компонентов, как это следует из эксперимента.
|
Температура насыщенного пара, "С |
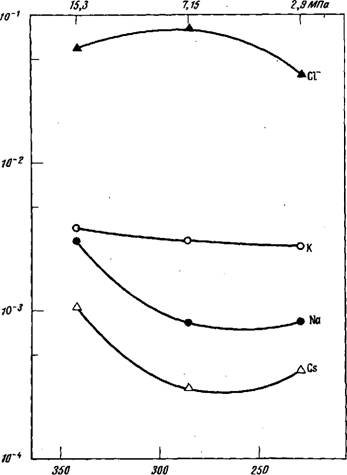
-Фиг. 4.6. Кажущиеся коэффициенты распределения для ионов хлора и щелочных металлов [ 4].
На фиг. 4.6 и 4.7 приведены коэффициенты распределения в зависимости от температуры насыщенного пара. Предварительные исследования процесса выщелачивания образцов породы при температуре 343°С показали, что наиболее важные радиоактивные изотопы, такие, как Eu, Ru, Се и Со, не выщелачиваются из образцов в доста - 350 300 аи
Температура насыщенного пара, °С
Фиг. 4.7. Кажущиеся коэффициенты распределения для АІ, В, Sb и Si02 [4].
Точных количествах для непосредственного обнаружения методом гамма-спектроскопии. Более того, даже выщелачиваемые радиоактивные элементы, такие, как Sb и Cs, присутствуют в воде в таких незначительных количествах, что эти величины чуть выше порога чувствительности при обнаружении вещества в пробах воды. Остается невыясненным вопрос, обусловлена ли низкая концентрация этих радиоактивных изотопов 1) радиоактивным распадом вследствие возраста образцов (~6 лет), 2) низкой скоростью процесса выщелачивания или 3) нерастворимостью соединений, содержащих радиоактивные изотопы. Если низкие концентрации радиоактивных элементов обУсловлены процессами (1) или (2), то изотопное разбавление, вызываемое активацией нейтронами, сделает возможным определение коэффициентов распределения для интересующих нас радиоактивных элементов. Поэтому в воду были добавлены такие элементы, как Cs, Sb, Ru, Со и Се в количестве по 50 мг/л в виде соединений типа окислов или нитратов. В отдельных сериях опытов в виде окисла был введен также элемент Ей в количестве 50 мг/л. При этом потребовалось отделение Ей от других - изотопов, с тем чтобы исключить возможные помехи в счете, обусловленные сложным характером спектра гамма- излучения Ей.
Полученные на основании активационного анализа результаты показывают, что практически одни и те же элементы доминируют в растворе, т. е. малые количества Sb (максимум ~2 мг/л) и Cs (максимум ОД мг/л). В пробах водной или паровой фаз обнаружены также незначительные количества Со, однако уровень концентрации Со таков, что его можно отнести к продуктам коррозии таких материалов, как инконель или нержавеющая сталь. Другие вводимые элементы, такие, как Ru, Се и Ей, не присутствовали в заметных количествах. Отсюда сделан вывод, что низкие концентрации этих элементов в паре и воде объясняются низкой растворимостью химических соединений, в которых они присутствуют.
Расчетные значения коэффициентов распределения приведены в табл. 4.4 и на фиг. 4.6 и 4.7. Ожидалось, что в простой системе коэффициенты распределения не будут зависеть от концентрации и температуры вблизи значения критической температуры. Вследствие сложной химической природы исследуемой системы такое простое соотношение не выполняется. Для некоторых анализируемых компонентов, например, натрия, обнаружена инверсия растворимости в воде.
Данный результат не является неожиданным, поскольку известно, что силикат натрия характеризуется инверсией растворимости.
|
Таблица 4.4
|
|
Концентрация в жидкой фазе и кажущиеся коэффициенты распределения Для системы пар — еодв [4 |
1,При проведении эксперимента в воду добавляли 50 мг/л указанного элемента в виде окисла или нитрата.
Анализ отложений в автоклаве. По окончании исследований процесса выщелачивания образцов пород было обнаружено, что стенки автоклава покрыты плотными хлопьевидными отложениями, выходящими за пределы наблюдаемого уровня воды. Вещество этих отложений было устойчивым по отношению к концентрированной соляной кислоте, азотной кислоте, царской водке и 50%-ному раствору каустика даже при нагревании до ~90°С. Единственным эффективным методом растворения отложений оказалось погружение их на 3 - 5 ч в 48%-ный раствор плавиковой кислоты. Для идентификации отложений на стенках автоклава был проведен химический и радиохимический анализ. Результаты этого анализа приведены в табл.. 4.5 и 4.6.
Согласно результатам, представленным в табл. 4.5, образование хлопьев происходило в основном за счет испарения и, возможно, разбрызгивания непосредственно над уровнем воды. Это, очевидно, вытекает из того факта, что обнаруженные радиоактивные компоненты имеют приблизительно такое же соотношение элементов, что и компоненты, присутствующие в пробе воды.
Таблица 4.5
|
Сравнение результатов радиохимического анализа отложений на стенках автоклава, образцов породы и воды[4]
|
|
Таблица 4.6 Состав хлопьевидных отложений по сравнению с другими образцами. Спёктры излучения [4]
|
Продолжение табл. 4.6
|
0,008 20 1,7 1000 |
|
0,02 1.3 |
|
0,005 |
|
Mg Na Sb |
|
0,42 0.2 90 |
|
65 |
|
Si (в виде |
0,004 0,1 0,009 15
|
Si02) |
|
0,08 <0,02 |
|
0,02 7 |
|
0,05 Следы |
|
V Ru |
|
<0,02 |