Модель Бора атома водорода
В качестве исходной посылки Бор взял планетарную модель атома Резерфорда и, пытаясь объяснить наблюдаемые в спектре водорода закономерности, нашел правило квантования. Так он предположил, что возможны лишь такие орбита движения электрона вокруг ядра, для которых момент импульса электрона
L = m v r (6)
где m - масса электрона, V - его скорость, г - радиус орбиты, удовлетворяет условию:
mvr = nћ (n = 1.2.3...) (7)
где n называется главным квантовым числом.
ћ = h / 2π - постоянная Планка перечёркнутая (постоянная Дирака).
Далее Бор применил законы классической физики. Используя второй закон Ньютона, для электрона, вращающегося под действием кулоновской силы вокруг ядра: 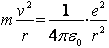 (8)
(8)
и, исключая скорость из уравнений (7) и (8), было получено выражение для радиусов допустимых орбит
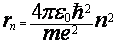 (n=1,2,3…) (9)
(n=1,2,3…) (9)
Радиус первой орбиты водородного атома называется Боровским радиусом и равен
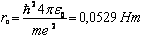 (10)
(10)
Внутренняя энергия атома равна кинетической энергий электрона и энергии взаимодействия электрона с ядром.
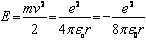 (11)
(11)
так как 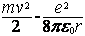 (смотри формулу 8) (12)
(смотри формулу 8) (12)
Подставив в (11) выражение ![]() из (9), найдём разрешённые значения внутренней энергии атома:
из (9), найдём разрешённые значения внутренней энергии атома: 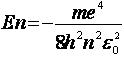 ( n= 1.2, 3...) (13)
( n= 1.2, 3...) (13)
При переходе атома водорода из состояния ![]() в состояние
в состояние ![]() излучается фотон.
излучается фотон. 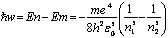 (14)
(14)
Длина волны испускаемого света будет: ![]()
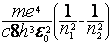 (15)
(15) ![]()
Мы, следуя Бору, пришли к обобщённой формуле Бальмера (3).