СТРУКТУРА МЫШЦЫ И МЫШЕЧНЫХ БЕЛКОВ
Позвоночные животные имеют три вида мышц — гладкие мышцы в стенках полых органов, поперечно-полосатые мышцы сердца и поперечно-полосатые скелетные мышцы. Последующее изложение относится преимущественно к последнему виду мышц.
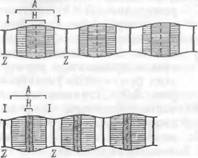
Мышцы имеют волокнистое строение. Под обычным микроскопом без труда наблюдается поперечно-полосатая структура мышечных волокон. Отдельное мышечное волокно имеет диаметр 0,02—0,08 мм. Оно окружено-мембраной, толщина которой около 100 А. Волокно состоит из 1000—2000 более тонких волокон — миофибрилл диаметром 1—2 мкм. Фибриллы имеют оболочку, образованную трубочками и пузырьками саркоплазм этического ретикулума, о роли которых сказано дальше. Мышца содержит также митохондрии, расположенные между фибриллами. Микроскопическое строение миофибриллы показано на рис. 5.4. Мио - фибрилла в свою очередь состоит из ряда белковых нитей — толстых и тонких. Симметрия их расположения в поперечном сечении гексагональна (рис. 5.5). На рис. 5.6 показано продольное сечение миофибриллы, а на рис. 5.7 — ее схематическое строение. Черные линии на рис. 5.6 (они отчетливо видны и на рис. 5.4) — это так называемые Z-линии (Z-диски, имеющие вид линий в продольном сечении). Участок миофибриллы между двумя Z-линиями называется саркомером. Он разделяется на несколько зон, хорошо наблюдаемых с помощью фазово-конт- растной микроскопии. Центральная А-полоса анизотропна и обладает двойным лучепреломлением. К ней примыкают с двух сторон изотропные I-полосы. При растяжении покоящейся мышцы в середине А-полосы появляется зона Н меньшей плотности. Эти детали структуры изображены схематически на рис. 5.6 и 5.7.
Электронно-микроскопические исследования, проведенные Хаксли и Хансон [16, 17], позволили установить расположение толстых и тонких белковых нитей в саркомере (см. рис. 5.5 и 5.7). Толстые нити образованы белком миозином, тонкие — в основном белком актином, Каждая толстая нить состоит из
180—360 продольно ориентированных молекул миозина, ответственных за анизотропию плотной А-полосы. Менее плотная

Рис. 5.4. Электронная микрофотография миофнбриллы мышцы лягушки.
I-полоса образована тонкими нитями актина, молекулы которого представляют собой двойные спирали (F-форма актина),
Возникшие в результате полимеризации глобулярного G-актина. В саркомере число G-глобул равно примерно 800 на одну тонкую нить. Тонкие нити F-актина проходят через Z-диски.
У высших позвоночных молярное отношение актина к миозину примерно равно 4:1, весовое отношение — 1:2.
О О о о О О о о О о о о о О о о О о
О о о О о о О о о О о о О о J О о о О о о
Г о о о о о
Рис. 5.5. Схема участка попереч ного сечения миофнбриллы.
I—толстые нити, 2—тонкие.
Актиновая нить представляет собой двойную спираль с G-субъ- единицами, повторяющимися через 54,6 А вдоль каждой из двух цепей с расстоянием между точками их пересечения 340—420 А [18,19]. Диаметр двойной спирали актина составляет 60—80 А. Толстые нити миозина
имеют диаметр 140 А. Из миозиновой нити выступают «головки», расположенные на нити в виде спирали 6/2. На данном уровне два выступа находятся напротив друг друга. Следующие два выступа находятся на расстоянии 143 А и повернуты относительно первой пары на 122°. Структура как целое повторяется с периодом З X 143 = 429 А [18, 19].
Миозин представляет собой фибриллярный белок — он состоит из молекул длиною
Н
TOC \o "1-3" \h \z Z ■ Z

Z Z
1 у/уу/уууу, ууу/ууууу/ууууууууа
Г (■ ■ ...>
У////.у у.:у, у, уу, уу, м.у/а
Рис. 5.6. Схема продольного сечения Рис. 5.7. Схема строения сарко - миофибриллы при трех разных ее мера,
длинах.
1500 А и диаметром около 20 А. Утолщенный конец молекулы («головка») имеет длину около 200 А и ширину около 40 А. На
|
,1 - • . 1. ■ ' V/y. • • • .: • t ■ |
: - * / . 'і ж5 •1 - V > ••■•' |
|
V : - • Л.' . J*"" J*"' . » > * |
. ..... ■ , • ■ Ш ' > ■ . • |
Рус. 5.8. Электронные микрофотографии молекул миозина при увеличении 175 000, полученные Такахаши.
Рис. 5.8 показаны электронные микрофотографии миозина [20]. Подробное электронно-микроскопическое исследование миозина
привело к результатам, показанным на рис. 5.9 [21]. Молекула построена из фрагментов, отвечающих фракциям, получаемым при гидролизе трипсином, а именно, из легкого ме-
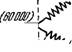
ТММ S-2
ТММ S-1 (КОООО)
370А
МММ (150000)
930А
Рис. 5.9. Схема строения молекулы миозина.
Указаны продольные размеры фрагментов и их молекулярные веса.
Ромиазина (ЛММ) и тяже-
Лого меромиозина (ТММ), имеющего два фрагмента S-1 и S-2. Молекулярные веса и продольные размеры этих фрагментов указаны на рис. 5.9. Длинная прямая часть молекулы является двойной суперспиралью. Общий молекулярный вес миозина составляет около 5-Ю5, степень а-спиральности велика (примерно 58%). Миозин со- держитПЯэльшое "число кислотных и основных аминокислотных остатков.
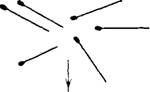
При образовании толстой нити молекулы миозина агрегируют, по-видимому, в результате электростатических взимодей-
Ствий между их ЛММ-«хво-
Стами». Схема агрегации показана на рис. 5.10. «Головки», выступающие из толстой нити, образованы фрагментами S-1 тяжелого меромиозина. Детальная модель структуры миозиновой нити предложена в работах [22, 23].
Сфероидальные мономеры G-актина имеют диаметр около 55 А и молекулярный вес 46 000—47 ООО. Степень а-спиральности около 30%. Полимеризация G-актина в F-актин происходит с участием АТФ
Рис. 5.10.
Схема агрегации молекул миозина.
N(G-актин— АТФ) F-актин — «АДФ - f пФн.
Полимеризация в растворе идет в присутствии солей, в частности, для этого требуются ионы Mg++. Скорость дефосфорилиро - вания АТФ зависит от начальной концентрации G-актина и растет пропорционально ее третьей или четвертой степени [24]. Количественная теория кооперативной спиральной агрегации актина предложена в работе [25].
В тонких нитях наряду с актином содержатся в меньших количествах другие белки — тропомиозин и тропонин. Тропомио - зин имеет молекулярный вес около 70 000 и состоит из длинных молекул — длина их около 450 А, а отношение длинной и короткой осей эффективного эллипсоида превышает 20. Степень а-спиральности тропомиозина около 90%. Тропонин — глобулярный белок, состоящий из трех компонентов с молекулярными весами 37 000, 23 000 и 19 000.
Тонкая нить представляет собой комплекс актина с тропомиозином и тропо - нином. Как уже сказано, сферы G-актина объединены в двойную спираль. Согласно схеме, предложенной Эбаши [26], длинные молекулы тропомиозина располагаются вдоль каждой борозды двойной спирали, глобула тропонина помещается вблизи молекулы тропомиозина (рис. 5.11) [26].
Пока что мы располагаем скудными сведениями о других белках миофиб - рилл — об а - и $-актинине и М-белке. Их молекулярные веса равны соответственно 100 000, 70 000 .и 155 000. Наряду с тропомиозином и тропонином эти белки играют, по-видимому, регуляторную роль [27]. Дальнейшие подробности, относящиеся к химическим и физико-химическим свойствам мышечных белков, приведены в монографиях [20, 28, 29].
В работах Вазиной и соавторов [106—109] установлено, что сократительные белки мышцы, а также актин из плазмодия миксомицета и флагеллин из жгутиков бактерий образуют в растворе жидкие кристаллы. Такие системы дают при рентгенографическом исследовании прекрасные дифракционные картины с двумя типами рефлексов, обусловленных соответственно структурой фибрилл и их упаковкой. Жидко-кристаллические структуры анизотропны, они способны к полиморфным превращениям, т. е. в них возможны фазовые переходы. Выше были рассмотрены жидко-кристаллические свойства биологических мембран (§ 3.9). Эти свойства в значительной степени определяют биологическую функциональность мембран. Есть основания Думать, что жидко-кристаллические свойства сократительных белков существенны для сокращения. мышцы.
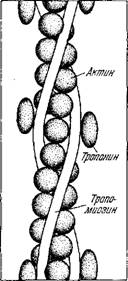
Рис. 5.11. Схема строения тонкой нити.
Световая и электронная микроскопия позволила установить основные структурные особенности мышечного сокращения.
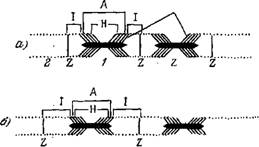
При сокращении (укорочении) мышцы происходит сужение 1-полос без изменения протяженности А-полосы. Z-диски движутся навстречу друг другу. В конечном счете I-полосы исчезают вовсе, а в центре саркомера появляется уплотнение. Объем саркомера при укорочении меняется мало, следовательно, он становится толще.
Мостики
Очевидно, вещество А-полосы более жестко, чем вещество 1-полос. Наблюдаемые изменения оптической плотности можно
І Р'^Г"»^*^
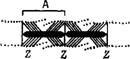
Рис. 5.12. Скользящая модель.
Z Ж*Ж
Ф
А — нормальное строение волокна, б—растянутое волокно, в—сильно укороченное волокно. Справа — поперечное сеченне.
Объяснить только, предположив, Что в укорачивающемся сарко - мере происходит перемещение вещества. Электронная микроскопия действительно показывает, что при укорочении толстые нити вдвигаются между тонкими и саркомер укорачивается подобно подзорной трубе. Это — скользящая модель мышцы, развитая X. Хаксли (см. [28]).
Взаимодействие толстых и тонких нитей происходит посредством «головок» миозина, образующих мостики, соединяющие нити. Мостики, таким образом, состоят из ТММ. В нормальном физиологическом состоянии мышцы перекрывание между толстыми и тонкими нитями таково, что могут образоваться все возможные мостики (рис. 5.12, а); при сильном растяжении этого уже нет (рис. 5.12,6). При больших укорочениях, по - видимому, происходит деформация тонких нитей (рис. 5.12, в).
Миозин ответствен за анизотропию А-полосы: в 1-полосах миозина нет и, следовательно, тонкие нити сами по себе анизотропии не создают.
В скользящей модели каждый мостик работает циклически. Мостик толкает или тянет актин к центру А-полосы на расстояние порядка 50—100 А, затем он отщепляется от актина и присоединяется к актину вновь в другой его точке, находившейся вначале на большем удалении от центра А-полосы. Далее цикл повторяется. Непрерывное движение актиновых нитей происходит в результате асинхронного действия мостиков [30]. Этот механизм требует структурной полярности в расположении сократительных белков в толстых и тонких нитях. Действительно, все молекулы миозина ориентированы в одну сторону в одной половине толстой нити и в другую — во второй половине [31]. Найдено также, что все мономеры актина, лежащие вдоль двойной спирали, имеют одинаковую полярность, а полярности тонких нитей, выходящих из Z-мембраны в разные стороны, противоположны [31]. ""
Изучение мышечных волокон методом рассеяния рентгеновых лучей под малыми углами полностью подтверждает результаты электронно-микроскопических исследований и существенно их дополняет [18, 32, 33]. Поскольку объем саркомера при укорочении не меняется, можно было ожидать, что расстояния между нитями будут обратно пропорциональны корню квадратному из длины саркомера. Измерения экваториальных рентгеновских рефлексов дают линейную зависимость между этими величинами, что свидетельствует об эффективном «удлинении» мостиков при укорочении мышцы, т. е. о гибкости «головок» ТММ. С другой стороны, дифракция рентгеновых лучей под малыми углами подтверждает неизменность длины самих толстых и тонких нитей.
В работе [34] методом рентгенографии показано, что при сокращении мышцы происходит радиальное перемещение мостиков.
Толкающее или тянущее усилие, развиваемое мостиком, может быть лишь результатом конформационного превращения. Такое превращение может выражаться либо в активном изменении угла, под которым «головка» ТММ присоединена к тонкой нити, либо в изменении ее формы. Опыт показывает, что связь мостиков с толстыми нитями гибкая, а их связь с тонкими нитями весьма жестка [18, 31]. На рис. 5.13 показана схема изменения угла, под которым мостик присоединен к тонкой нити в последовательные моменты времени [30].
При окоченении мышцы (rigor) возникают жесткие и неподвижные связи между мостиками и тонкими нитями. Спиральная
Периодичность нарушается, период 429 А исчезает и заменяется слоевыми линиями, отвечающими 360—380 А. Вместе с тем период 143 А сохраняется. Эти явления также можно
Объяснить изменениями в расположении мостиков при сохранении структуры толстой нити.
Описанная структурная картина, находящаяся в полном согласии со скользящей моделью, может считаться надежно установленной. Физическая теория мышечного сокращения должна основываться на скользящей модели как на опытном факте. Одновременно теория, задачей которой является молекулярное истолкование особенностей мышечного сокращения, должна наряду со структурными данными учитывать и объяснять результаты биохимических и биофизических (физиологических) экспериментальных исследований. Структурные, биохимические и биофизические исследования — три источника информации о строении и функции мышц.

