СТРУКТУРА МЕМБРАН
Феноменологическое рассмотрение мембранного транспорта на основе неравновесной термодинамики или кинетических моделей не дает сведений о молекулярных механизмах явления. Развитие физики мембран связано с детальным изучением их молекулярного строения и молекулярной функциональности. Биологическая мембрана есть динамическая организованная система; необходимо исследовать как ее устройство, так и динамику ее поведения. Соответствующие задачи очень сложны и, несмотря на громадное число работ, им посвященных, мы не располагаем еще сколько-нибудь полной картиной динамической мембраны. Тем не менее сейчас установлен ряд важных фактов и предложены убедительные модели мембран.
Мембраны состоят в основном из липидов и белков. В клетках млекопитающих содержатся и небольшие количества углеводов, связанных с белками (гликопротеиды) или с липидами (гликолипиды). Во внутренних мембранах присутствуют в основном фосфолипиды, в плазматических содержатся и нейтральные липиды. Так, в мембранах эритроцитов 30% липидов образует холестерин.
В табл. 3.4 [64] приведено относительное содержание белков и липидов, в также холестерина и фосфолипидов в различных биологических мембранах.
Таблица 3.4
Состав биологических мембран
Холестерии/фосфо- липид (молярное отношение)
Велок/липид (весовое отношение)
Мембрана
0,25
0,7-1,2 0,3-0,5
1,0-1,4 2,2 1.5-4,0
0,9-1,0
0,7-1,2 1,2 3,6 1,5
0,03-0,08 0,03-0,09 0,02-0,04 0,13 0
0,8
Миелииовая оболочка Плазматические мембраны
Клетки печени
Клетки асцита Эрлиха
Тени эритроцитов Внутренняя мембрана
Эндоплазматический ретикулум Внешняя мембрана митохондрий Внутренняя мембрана митохондрий Палочки сетчатки Ламеллы хлоропласта
Для изучения состава мембран необходимы методы выделения из мембран индивидуальных компонентов. Сейчас такие методы хорошо разработаны. Они основаны на применении детергентов (например, додецилсульфата натрия), солюбилизирую - щих нерастворимые вещества, и разделении полученных белков путем электрофореза в полиакриламидном геле [64, 65].
В большинстве случаев мембраны чрезвычайно гетерогенны. Фосфолипиды и липиды представлены в них целыми семействами. Так, в мембранах эритроцитов человека содержится не менее 20 видов лецитина [66]. На рис. 3.7 представлена схема, показывающая строение и состав липидов в этих мембранах [67]. Липиды построены из полярной «головы» и двух длинных неполярных углеводородных «хвостов», обладающих гидрофобными свойствами. Как мы увидим, этим определяется структура мембран.
Белки мембран также разнообразны. Около трети белков мембраны эритроцита образует спектрин, состоящий из двух компонентов с молекулярными весами 255 000 и 220 000. Вторая треть — ряд белков с молекулярными весами около 90 000 и третья треть — белки с молекулярными весами 9000— 15 000 [65, 68]. Существуют мембраны и более простого состава — внутренние мембраны палочек сетчатки содержат лишь один белок — родопсин (см. гл. 7). Состав мембран каждого типа клеток специфичен, что, по-видимому, имеет прямое функциональное значение. Было высказано предположение о присутствии на внешней стороне цитоплазматической мембраны характеристических белков, ответственных за узнавание [69].
Липиды играют не только структурную роль в мембранах. Можно было бы представить себе и чисто белковую мембрану, молекулы которой связаны друг с другом слабыми взаимодействиями, прежде всего гидрофобными. Таких мембран, однако, нет, хотя известны стабильные белковые надмолекулярные структуры (например, коллаген) и белково-углеводные мембра - ноподобные системы. Можно думать, что белковая мембрана была бы слишком стабильна и, тем самым, лишена структурной лабильности, необходимой для многообразной функциональности мембраны [70].
Основываясь на косвенных данных о свойствах клеток и проницаемости мембран, Даниэлли и Давсон еще в 1935 г. предложили модель универсальной биологической мембраны, так называемой унитарной мембраны [71]. Эта модель симметрична. Матрикс мембраны, ее внутренность формируют неполярные «хвосты» липидов, образующие два слоя. На поверхность выходят полярные «головы» липидов, взаимодействующие с внешними мономолекулярными белковыми слоями. В дальнейшем эту модель неоднократно модифицировали и усовершенствовали
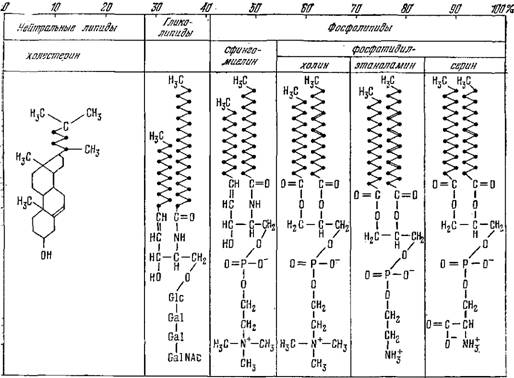
Рис. 3.7. Структура и состав липидов и фосфолипидов в мембране эритроцита человека.
На основании данных, полученных с помощью электронной микроскопии и рентгенографии. Модель Робертсона [72] состоит из двух липидных слоев с гидрофобными «хвостами», обращенными внутрь, и полярными «головами», смотрящими наружу. Мономолекулярные слои белка различны на двух сторонах мембраны. Толщина внутреннего гидрофобного билипидного слоя около 35 А, толщина каждого из внешних слоев, состоящих из полярных «голов» и белка, — около 20 А, толщина унитарной мембраны в целом — около 75 А. Другие модели приведены в [2].
Данные, полученные методом электронной микроскопии, возможно, требуют уточнений. Оттенение препаратов производится 0s04, KMn04 и т. п. Химия происходящих при этом процессов еще недостаточно изучена, неясно также, что происходит при выделении мембран и подготовке препаратов. Здесь не исключены артефакты. Тем не менее основной принцип построения унитарной мембраны — двуслойное расположение липидов — по-видимому, правилен. Это доказывается, в частности, рентгенографическими данными. Установлено, что чистые фосфоли- пиды, диспергированные в воде и образующие бимолекулярные слои вследствие гидрофобных взаимодействий, дают дифракционную картину, весьма сходную с картинами, получаемыми с диспергированными биологическими мембранами. Оказалось, что столь различные объекты, как мембраны эритроцитов, бактерий Mycoplasma laidlawii и плазматические мембраны нервных окончаний крысы, имеют в основном сходное строение, согласующееся с унитарной моделью.
Сказанное, однако, не относится к расположению белков в мембране. Предложенные модели исходят из того, что мембранные белки имеют гидрофильные, полярные, поверхности, взаимодействующие с полярной липидной поверхностью мембраны. В действительности это не так. Были проведены исследования выделенных мембранных белков и мембран косвенными методами— воздействием на них протеолитических ферментов и включением в белки мембран различных меток [2,5]. Оказалось, что белки мембран можно разделить на два класса. Одни из них связываются только поверхностями мембраны; подобно глобулярным белкам, функционирующим в водном окружении, они имеют гидрофильную поверхность. Белки второго класса способны проникать в мембрану, взаимодействуя с гидрофобными «хвостами» липидов. Такие белки нерастворимы в воде и имеют преимущественно гидрофобный характер [68]. Исследования мембран методами инфракрасной спектроскопии, спектрополя - риметрии, спектроскопии ЯМР и т. д. указывают на разнообразие белковых структур и, вероятно, значительную роль взаимодействия белков друг с другом, не учитываемого в унитарной модели [73]. В модели Бенсона [74] глобулярные белки «утоплены» в мембране. Липиды не образуют сплошного бимолекулярного слоя, но рассредоточены между белковыми глобулами так, что их углеводородные «хвосты» контактируют с гидрофобными участками белков (см. также [65, 75]).
В настоящее время наиболее правдоподобной представляется мозаичная модель мембраны, отличная и от модели Даниэлли и Давсона, и от модели Бенсона.
Ряд данных непосредственно доказывает, что в отличие от унитарной модели белки в мембране распределены асимметрично. Для исследования применялись методы изменения наружной поверхности мембраны под действием непроник'ающих агентов, идентификация наружных компонентов с помощью специфических антител, введение селективных меток, сравнение ферментативной и транспортной активностей нативных и «вывернутых» везикул и т. д. [75]. Особенно детально изучены мембраны эритроцитов. Прямой метод локализации компонентов мембраны — ЯМР-спектроскопия с применением гидрофильных парамагнитных меток — дал особенно убедительные доказательства этой асимметрии [75—78].
Важные результаты получены при помощи методики скалывания в замороженном состоянии (freeze etching). Мембраны быстро замораживают при температуре жидкого азота и дробят в вакууме. Лед сублимируется, образец оттеняют, реплицируют платиной и углеродом и исследуют под электронным микроскопом. Выяснилось, что излом проходит вдоль внутренней гидрофобной области мембраны эритроцита. При этом обнаружились большие глобулярные частицы диаметром до 75 А. Эти частицы — белки [65, 79, 80].
Многие свойства биологических мембран, не связанные с ферментативной активностью, удается моделировать экспериментально. Оказалось возможным получать и исследовать искусственные липидные мембраны, имеющие двухслойное строение.
Стабильные двухслойные системы такого рода были впервые получены в 1962 г. [81]. Искусственные мембраны получаются при контакте смеси фосфолипидов и нейтральных липидов, растворенных в органических соединениях, с водой. При этом можно получить «черные» мембраны, т. е. тонкие слои, лишенные интерференционных цветов. Толщина таких мембран менее 100 А. Разработаны весьма надежные способы их изготовления (см., например, [82]). Используются как природные, так и синтетические липиды [83].
Искусственные двухслойные липидные мембраны весьма разнообразны, но в целом сходны с моделью унитарной мембраны. Внутри расположены неполяриые группы липидов, снаружи — их полярные участки. Искусственные двухслойные мембраны имеют физические свойства, очень близкие к свойствам биоло - гических мембран, как о том свидетельствует табл. 3.5 [84]. Электронно-микроскопические картины также оказываются сходными.
Таблица 3.5
Сравнение свойств двухслойных липидных и биологических мембран
|
Толщина, А |
60-100 |
67-75 |
|
Емкость, нФ/мм2 |
0,5-1,3 |
0,38-1,0 |
|
Сопротивление, Ом • см2 |
10'-Ю5 |
10е - Юэ |
|
Напряжение пробоя, мВ |
100 |
150-200 |
|
Поверхностное натяжение, дин/см2 |
0,03-1,0 |
0,5-2,0 |
|
Проницаемость для воды, мкм/с |
0,37-400 |
31,7 |
|
Энергия активации для транспорта |
9,6 |
12,7 |
|
Воды, ккал/моль |
||
|
Проницаемость для мочевнны, |
0,015-280 |
4,2 |
|
102 мкм/с |
||
|
То же, для глицерина |
0,003-27 |
4,6 |
|
То же, для пентаэритрита |
0,007 -5 |
0,75 |
Свойства
Биологическая мембрана при 25 °С
Двухслойная мембрана при 36 °С
Искусственные двухслойные мембраны, естественно, лишены метаболической активности и не обладают столь высокой селективностью, как биологические мембраны. Вместе с тем, они моделируют важные свойства биомембран, что позволяет изучать переносчики ионов и возбудимость. Все это показывает, что двухслойная липидная структура в той или иной мере свойственна биологическим мембранам.
Обладают ли липиды специальной функциональностью помимо их способности образовывать слоистые структуры, гидрофобные внутри и гидрофильные снаружи? Роль липидов далеко не изучена, но в работах Лузатти с сотрудниками [85—88] установлено, что в системах липид — вода наблюдается ряд различных фаз в зависимости от состава системы и температуры и изучены эти фазы. Они могут быть лишены ближнего порядка или обладать частично упорядоченными парафиновыми цепями. Напротив, наблюдаются фазы с дальним порядком, подобные кристаллам или, скорее, жидким кристаллам (исключением служат мицеллярные изотропные растворы, получаемые при малой концентрации липидов, — мыла). Обнаружены также сложные ламеллярные и стержнеобразные структуры липидов — ламеллярные фазы могут представлять собой двумерные слои липидов, чередующиеся со слоями воды и уложенные в одномерную решетку с вращательным беспорядком. Наблюдаются и плоские липидные слои, упакованные в двумерную гексагональную решетку с вращательным беспорядком, лентообразные структуры с конечными ширинами ламеллярных элементов, диски, организованные в объемно центрированную орторомбиче - скую решетку. Наблюдаются стержнеобразные фазы, образованные бесконечными или конечными стержнями — двумерная гексагональная совокупность бесконечных стержней, плоские двумерные квадратные и гексагональные сетки и сложные трехмерные сетки.
Эти системы представляют самостоятельный научный интерес, сочетая высокий дальний порядок с отсутствием ближнего порядка и обладая большой гетерогенностью и углеводородных цепей, и полярных групп. Есть основания думать, что многофаз - ность липидных систем имеет прямое отношение к функциям биологических мембран (см. ниже).

