СИНАПТИЧЕСКАЯ ПЕРЕДАЧА
Когда импульс достигает окончания нервного волокна, он должен либо произвести свое действие, скажем, в нервно-мы - шечнОм (мионевральном) соединении, индуцируя мышечное сокращение, либо перейти на другое нервное волокно. И в том и в другом случае реализуется синаптическая передача импульса с одной клеткй на другую. Синапс представляет собой функциональный контакт двух возбудимых клеток, каждая из которых заключена в отдельную мембрану.
Современная биология располагает богатой цитологической, биохимической и физиологической информацией о синаптиче - ской передаче. Эти данные изложены, в частности, в монографин Катца [5] и в обзоре [85]. Они пока недостаточны для построения молекулярной физической теории соответствующих явлений, но позволяют наметить пути ее развития.
Расстояние между пресинаптической и постсинаптической мембранами, синаптическая щель, может достигать 150—200 А. В мионевральном соединении разрыв еще больше — до 500— 1000 А. Вместе с тем существуют синапсы с сильно сближенными и даже; сливающимися пресинаптической и постсинаптической мембранами. Соответственно реализуются два типа передачи импульса — при больших щелях передача имеет химический характер, при тесном контакте возможно прямое электрическое взаимодействие. Здесь мы рассмотрим химическую передачу.
При химической передаче электрический импульс, дошедший до окончания волокна, включает специфический химический механизм, усиливающий электрический сигнал. Такой механизм состоит в освобождении некоторого химического вещества, медиатора, синтезируемого и запасаемого в нервных окончаниях, в его рецепции специфическими центрами постсинаптической мембраны и, как результат этой рецепции, изменении ее проницаемости, вследствие чего появляется новый импульс.
Установлено, что медиатором служит прежде всего ацетил- холин (АХ)
НзС.
НзС—N+—CIV - СН2—О— СО— СН3>
НзС/
А также другие родственные соединения (карбахол, сукцинил- холин, допамин, у-аминомасляная и глутаминовая кислоты, глицин и т. д.). Роль ацетилхолина была открыта еще в 1921 г. Лёви [86]. Далее было показано, что АХ концентрируется в пузырьках пресинаптических окончаний [87].
Пресинаптический механизм представляет собой нейросекре- цию, т. е. освобождение АХ из пузырьков под действием нервного импульса. Оценка числа молекул АХ, выделяемых на один импульс, дает несколько миллионов [88].
В постсинаптической мембране мионеврального соединения установлена высокая концентрация ацетилхолинэстеразы (АХЭ) — фермента, катализирующего гидролиз АХ. Было высказано предположение, что АХЭ и представляет собой вещество - рецептор [89]. АХЭ, выделенная из Electrophorus electricus, имеет молекулярный вес 260 000 и состоит из четырех одинаковых субъединиц [90]. Шанжё и соавторы рассматривают АХЭ как аллостерический фермент, содержащий каталитические и регу - ляторные центры. Предполагается, что в рецепторной мембране присутствует система, состоящая из макромолекулярного рецептора АХ, способного узнавать ацетилхолин и влиять на селективный транспорт катионов, стимулированный связыванием АХ. Эти две сопряженные функции могут переноситься одной и той же макромолекулой АХЭ, но выполняются разными липопро - теидными системами [91].
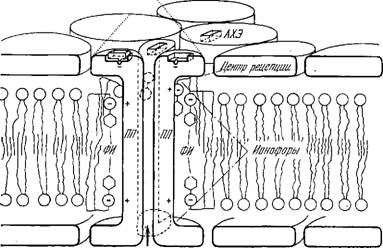
Де Робертису удалось строго показать, что рецепторным веществом является не АХЭ, но специальный протеолипид, в котором имеется гидрофобный белок [85]. Этот белок был выделен из мембран нервных окончаний. Он имеет большое сродство к АХ и к другим холинэргическим веществам. Де Робертис предложил модель постсинаптической мембраны, основанную на изученных свойствах рецепторного вещества (рис. 4.30). В мембрану включены дискретные рецепторные области. Белок-рецептор, имеющий гидрофобную поверхность, проходит сквозь липид - ные слои мембраны и создает в ней каналы. Стенки канала образованы четырьмя параллельными молекулами белка. АХЭ присутствует как отдельная молекула. АХ присоединяется к активному центру рецепторного белка, расположенному на его внешней поверхности. В результате присоединения — сильного ионного взаимодействия — происходят конформационные и трансляционные превращения в мембране, приводящие к изменениям ее ионной проницаемости.
В работах Де Робертиса получены предварительные результаты по созданию работающей модели постсинаптической мембраны путем включения выделенного белка-рецептора в искусственную двуслойную липидную мембрану.
Роль АХЭ состоит в основном в гидролизе АХ. Если бы АХ не гидролизовался, он блокировал бы АХЭ и синап гическая
передача прекратилась бы. Так действуют конкурентные ингибиторы АХЭ, в частности растительный яд кураре и другие алкалоиды. Соответственно блокируется иннервация мышц.
Область рецепции АХ /-.
Кат
Рис. 4.30. Схема возможной макромолекулярной организации постсинаптической мембраны по Де Робертису. ЯЛ—молекулы протеолипида, ФИ—молекулы фосфатидилинозитола.
Общая картина процессов, происходящих при мионевральной передаче, может быть, согласно Катцу, представлена схемой, показанной на рис. 4.31 [5].
Лретатицесш Лш/йшееШ Іїоєюеинттітееш область щелк облаем.
/ІЇинтезАХ
/
//атлет АХ
£сасывалЩ 'холма
FopfljfWJT-j-
* %
\
\
АХЗ/ >
Шпуме „ \
Ронращенив' тшци
Рис. 4.31. Схема мионевральной передачи.
Экспериментально показано, что медиатор — АХ — действительно повышает проницаемость концевой пластины мионевраль-
Ного соединения для ионов Na+ и К+ одновременно и в одинаковой степени. На проницаемость к ионам С1 АХ не влияет [92]. Другие количественные характеристики мионеврального соединения приведены в монографии Катца [5], который указывает, что «по своему электрическому эффекту воздействие передатчика поистине эквивалентно кратковременному «проколу» мембраны».
Вернемся в пресинаптическую область. Имеются данные, показывающие, что выделение небольших порций АХ происходит и в покое, независимо от нервного импульса. Импульс очень сильно повышает эту активность за время порядка 1 мс. Установлено, что спонтанная нейросекреция не обусловлена утечкой АХ из нервных окончаний путем случайной диффузии. Спонтанная нейросекреция есть спонтанное квантованное освобождение АХ, «при котором сконцентрированные порции АХ выделяются в случайные моменты времени по типу «все или ничего» из дискретных точек концевой мембраны аксона» [5]. Величина «кванта АХ» не зависит от изменений мембраны, связанных с нервным импульсом. Импульс изменяет в сотни тысяч раз вероятность выделения кванта. Потенциал постсинаптической мембраны, возникающий под влиянием нервного импульса, слагается из большого числа «миниатюрных потенциалов», создаваемых отдельными порциями, квантами, АХ. Число квантов, участвующих в реакции в одном мионевральном соединении, зависит от присутствия ионов Са++ и Mg++. Са++ стимулирует секрецию АХ, Mg++ — ее ингибирует.
Бойд и Мартин [93] (ср. [5]) провели статистический анализ реакции концевой пластинки — постсинапгического участка мионеврального соединения. Это оказалось возможным благодаря сильному понижению количества АХ, выделяемого при одном импульсе, вызванному уменьшением концентрации Са++ в среде. Удалось доказать, что каждая реакция на импульс слагается из целого числа «квантов АХ», и освобождение одного «кванта» есть событие с очень малой вероятностью р 1. Всего наблюдалось 198 импульсов. Число случаев, в которых освобождается х порций АХ, должно выражаться законом Пуассона
Где х = 0, 1, 2 ... — число порций АХ, т — среднее число порций, освобождаемых одним импульсом. В изученной системе
Средняя амплитуда реакции,0,933 мВ __
Т Средняя амплитуда спонтанных 0,4 мВ ' " потенциалов
Совпадение вычисленных и наблюдавшихся значений рх оказалось превосходным. В частности, согласно закону Пуассона
Р0 = n0/N = ехр (— т),
Где п0 — число реакций, в которых освобождается 0 порций, равное в рассматриваемой серии 18, N — полное число импульсов. Имеем
M = In (N/n0) = In (198/18) == 2,4
Вместо опытного значения 2,33.
Мы не касаемся здесь множества важных физиологических, фармакологических и медицинских проблем, связанных с синап - тической передачей (см. [5, 85, 94]).
Очевидно, что нейросекреция и химическая рецепция в постсинаптической мембране ставят ряд вопросов перед биофизикой. «Квантование» выделяемого АХ заставляет думать, что нейросекреция представляет собой кооперативный молекулярный процесс, к рассмотрению которого можно подойти на основе элект- ронно-конформационных взаимодействий. Те же идеи могут оказаться полезными для понимания сущности возникновения нового импульса в ответ на воздействие медиатора. Построение соответствующих кинетических моделей — задача вполне реальная, но мы располагаем пока слишком скудной экспериментальной информацией о молекулярной структуре систем, участвующих в синапсах.
Проблемы синаптической передачи непосредственно связаны с исследованиями нейронных сетей, посредством которых моделируется высшая нервная деятельность. Рассмотрение этих вопросов выходит за рамки книги. Существующие модели имеют математический, но не физический характер, так как мы не располагаем еще достаточными знаниями о явлениях высшей нервной деятельности (см. монографию [95]).