МОЛЕКУЛЯРНАЯ РЕГУЛЯЦИЯ БИОСИНТЕЗА БЕЛКА
Явления молекулярного узнавания, реализуемые посредством слабых взаимодействий, ответственны за совокупность регуляторних процессов в живой клетке, определяющих весь ход ее развития (см. гл. 9). Молекулярные взаимодействия формируют необходимые для регуляторных процессов обратные связи. Это относится, в частности, к функционированию аллостериче - ских ферментов ([1], гл. 7). Здесь мы рассмотрим молекулярную регуляцию биосинтеза белка, регуляцию действия генов.
Синтез белка искажается при воздействии мутагенов на ДНК- Немутагенные вещества также могут существенно влиять на. работу генов. Это ярко выражается в явлении так называемого индуцированного синтеза ферментов. Клетки Е. coli дикого типа, растущие в среде из неорганических солей с негалакто - зидным источником углерода (с янтарной кислотой), почти не синтезируют фермент р-галактозидазу, катализирующий гидролиз галактозида — лактозы до глюкозы и галактозы. Добавление индуктора, например, метилтиогалактозида к растущей культуре Е. coli дикого типа увеличивает скорость синтеза р-га - лактозидазы в 103 раз. Галактозид служит индуктором синтеза, а дикий тип Е. coli представляет собой индуцируемый тип. Имеются мутантные штаммы Е. coli, синтезирующие р-галакто - зидазу и без действия индуктора. Такие мутанты называются конститутивными. Опыты с мечеными атомами показали, что индуцированный синтез фермента происходит de novo из свободных аминокислот. Индуктор воздействует на генетическую систему клетки. Жакоб и Моно провели генетический анализ индуцированного синтеза, исходя из простой гипотезы, получившей в дальнейшем веские подтверждения [72, 73]. Гипотеза состояла в том, что индуцированный синтез подавляется специфическим соединением, находящимся в цитоплазме. Это соединение— репрессор — синтезируется под контролем особого гена - регулятора. В дальнейшем было установлено, что репрессоры представляют собой белки [74, 75].
Репрессор действует на ген-оператор, управляющий переносом информации от нескольких структурных генов к синтезируемым белкам. При воздействии репрессора прекращается работа всей совокупности этих генов.
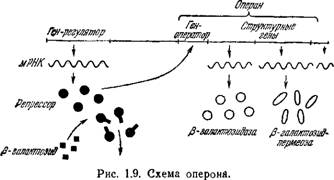
Индуктор синтеза взаимодействует с белком-репрессором и выключает его влияние на ген-оператор. Возможен и противоположный процесс активации некоторым метаболитом неактивного репрессора. Такой метаболит называется корепрессором.
На рис. 1.9 показана схема описанной генетической системы. Группа структурных генов, контролируемая одним геном-оператором, называется опероном. В рассматриваемом примере репрессор р-галактозидазы контролирует синтез по крайней мере Двух ферментов: р-галактозидазы и p-галактозидпермеазы. Второй фермент определяет скорость поступления Р-галактози - Дов в бактериальные клетки сквозь мембраны. В отсутствие
Р-галактозидпермеазы клетки Е. соїі не могут накапливать Р-галактозидазу. Синтез двух ферментов необходимым образом коррелирован.
Описанная модель (оперон) полностью подтверждена генетическими исследованиями, доказавшими существование гена - регулятора и гена-оператора и установившими свойства соответствующих мутаций (см., например, [76], гл. 7). Синтез Р-галактозидазы в Е. coli контролируется так называемым Лак - опероном. На него действует Лак-репрессор — тетрамерный белок с молекулярным весом 150 000. На основе модели оперона проведено теоретическое рассмотрение химической дифференци- ровки системы, развивающейся в процессе онтогенеза (см. § 9.10).
В настоящее время известны системы, в которых один специфический репрессор воздействует на несколько несвязанных оперонов (см. также [77]).
Контроль гена-оператора над опероном, по-видимому, определяется тем, что синтез мРНК начинается с того конца оперона, который примыкает к соответствующему оператору.
Описанный способ контроля и регуляции биосинтеза белка у прокариотов еще не может обеспечить регуляторные нужды клетки. Белки, кодируемые одним и тем же опероном, могут требоваться в разных количествах и в разное время. Для понимания соответствующих регуляторных явлений необходимо детальное рассмотрение механизма синтеза мРНК на ДНК, протекающего с непременным участием РНК-полимеразы (см. [78]). Процесс образования начала молекулы РНК существенно отличен от последующего роста ее цепи. Соответственно рационально рассматривать начало синтеза РНК (инициацию) и продолжение этого синтеза (элонгацию) как две самостоятельные стадии.
ДНК-зависимый синтез РНК подавляется рядом антибиотиков, таких, как актиномицин, которые блокируют матрицу ДНК [79]. Антибиотики группы рифамицина, напротив, действуют не на матрицу ДНК, но на РНК-полимеразу [80]. Установлено, что этот фермент содержит специфический центр, в котором связывается рифамицин. Центры связывания РНК-полимеразы с матрицей и рифамицином формируются различными полипептидами [81]. Рифамицин оказывает свое действие на стадии инициации, препятствуя образованию первой межнуклеотидной связи. Другие вещества ингибируют элонгацию, влияя на РНК - полимеразу. Напротив, актиномицин препятствует элонгации, взаимодействуя с ДНК, а не с ферментом [78].
Регуляция транскрипции далеко не всегда реализуется по схеме Жакоба и Моно посредством репрессора, негативного регуляторного фактора. В случае фаговых ДНК считывание определенных генов не происходит и в отсутствие каких-либо ре - прессоров. Для включения этих генов необходимы позитивные регуляторные факторы.
При заражении клетки Е. coli Т-четными фагами (Т2 и Т4) реализуется четко отрегулированная временная последовательность процессов транскрипции. Через несколько минут после заражения происходит выключение синтеза мРНК и белков клетки-хозяина и синтезируется несколько новых ферментов, необходимых для синтеза фаговой ДНК, а затем осуществляется синтез структурных белков фага. Как показал Хесин и его сотрудники, специфические фаговые мРНК появляются при фаговой инфекции не сразу, а последовательно [82, 83]. На ранних и поздних стадиях развития фага Т2 в клетке Е. coli образуются отличающиеся друг от друга наборы мРНК, синтезируемые на разных группах генов. РНК-полимераза способна узнавать промоторы генов мРНК, образующиеся на ранних стадиях фаговой инфекции. Аналогичные группы «ранних» и «поздних» РНК обнаруживаются и при развитии фага Т4 [84]. Оказалось, что появление разных групп мРНК фага Т4 зависит от процессов синтеза белка и репликации фаговой ДНК-
Модели, предлагаемые для объяснения этих регуляторных явлений, исходят из рассмотрения сложной субъединичной структуры РНК-полимеразы, которая изменяется при воздействии белковых регуляторных факторов [74]. Детальные молекулярные механизмы временной регуляции белкового синтеза пока неизвестны. Так или иначе, эти механизмы должны определяться молекулярным узнаванием на уровне фермента и матрицы, на уровне молекул белков и нуклеиновых кислот.
Регуляторные воздействия на биосинтез белка реализуются, по-видимому, на всех его стадиях. Регуляции подлежит работа полимераз, аминоацил — тРНК-синтетазы и рибосом. Воздействия химических соединений на биосинтез далеко не сводятся к мутагенезу. Так, антибиотики влияют на трансляцию кода, воздействуя на рибосомы. Стрептомицин нарушает трансляцию в бесклеточной системе (см. [85]). Этот антибиотик внедряется в 305 субъединицы рибосомы.
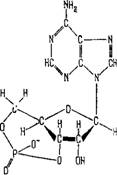
Важным регулятором функциональности генов на уровне трансляции является циклическая аденозинмонофосфорная кислота цАМФ. Остановимся на свойствах этого вещества (см. [86, 87, 128]), структура которого показана на рис. 1.10. Циклическая - АМФ функционирует как химический сигнал, регулирующий ферментативные реакции в клетках, запасающих сахара и жиры. Циклическая АМФ регулирует также транскрипцию генов. Впервые со свойствами цАМФ столкнулись при изучении активности гормона адреналина. Этот гормон повышает уровень сахара (глюкозы) в крови. Глюкоза поступает в кровь из кле - ТРк, запасающих животный крахмал — гликоген. Сложный процесс воздействия адреналина состоит из многих стадий. Адреналин является медиатором лишь первой из них, активируя фермент аденилатциклазу. Под действием этого фермента АТФ трансформируется в цАМФ, активирующую фермент, действующий в первом звене последовательности реакций, завершающейся конверсией гликогена в глюкозу. Как показали Сазер - ленд и его сотрудники, цАМФ играет роль «вторичного мессенд-
Жера» — универсального внутриклеточного посредника при действии ряда гормонов — «первичных мессенджеров» [129].
Циклическая АМФ присутствует в разнообразных клетках в количествах примерно в 1000 раз меньших, чем АТФ. Содержание цАМФ в клетке контролируется посредством ферментативной регуляции скорости ее синтеза из АТФ и превращения цАМФ в инертную нециклическую АМФ.
Эти малые количества цАМФ все же на два-три порядка больше коли - Рис. 1.10. Циклическая чества гормона. Тем самым обеспечи - аденозинмонофосфорная вается более чем 100-кратное усиление кислота (цАМФ). внешнего сигнала, воздействующего на клетку [128].
Воздействие цАМФ на гены состоит в стимуляции их активности в процессе транскрипции. Циклическая АМФ служит химическим триггером, включающим в ряде случаев процесс транскрипции гена. Ее действие состоит в связывании белка-рецептора цАМФ. Транскрипция начинается, когда комплекс цАМФ с белком-рецептором активирует некоторый промотор - ный участок ДНК в начале оперона (опыты проводились с Е. coli и активировался оперон лактозы, Лак-оперон). РНК - полимераза присоединяется к активированному промоторному участку и затем перемещается вдоль цепи ДНК, организуя синтез мРНК. Комплекс цАМФ — рецептор не содействует транскрипции при наличии специфического белка, Лак-репрессора. Циклическая АМФ может стимулировать транскрипцию ряда различных оперонов. Действие цАМФ в клетках эукариотов иное, но она и здесь влияет на генетическую систему — на матричную активность хроматина (см. [128]).
Роль цАМФ действительно универсальна. Это вещество участвует в процессе зрительного возбуждения и регулирует агрегацию «общественных амеб». Разнообразие функций цАМФ демонстрируется различием между механизмом деградации гликогена и липидов, с одной стороны, и стимулированием транскрипции генов — с другой. Сформулирована гипотеза, согласно которой дифференцировка эмбриональных клеток может определяться содержанием в них цАМФ и цГМФ (а также неорганических катионов — щелочных, щелочно-земельных и Zn++) [130].
Редупликация ДНК, происходящая на определенной стадии развития клетки, также представляет собой регуляторный процесс. В работах [88, 89] предложена гипотеза, согласно которой репликация ДНК индуцируется некоторым белковым веществом. Генетический элемент (хромосома или эписома) реплицируется как целое после такой индукции. Подобный элемент именуется репликоном.
В отличие от оперона репликон начинает функционировать под действием некоторого инициатора, а не индуктора, связывающего репрессор. Инициатор является не негативным, но позитивным регуляторным фактором. Циклическая хромосома ДНК бактерии или фага содержит структурный ген, ответственный за синтез активирующего белка, действующего на ген-репликатор. Возможно, что при этом происходит разрыв кольца и хромосома реплицируется как целое. Гипотеза репликона приводит к ряду генетических выводов о природе мутантов структурных генов и репликатора, подтверждаемых экспериментально [90]. Многие факты, включая результаты прямых электронно - микроскопических исследований, показывают, что во время деления бактериальной клетки инициатор связан с клеточной мембраной. Молекулярные процессы лежат в основе клеточных.