АКСОН И НЕРВНЫЙ ИМПУЛЬС
Генерация и распространение нервного импульса в организмах животных, возбуждение нервных и мышечных клеток — важнейшие мембранные явления. Мембранная теория возбуждения была сформулирована Бернштейном еще в 1902 г. [1]. Согласно его теории, возбуждение определяется электрохимическими процессами, локализованными в мембранах нервных и мышечных клеток. Эти процессы сводятся к перемещению малых ионов. Позднее Лазарев опубликовал монографию об ионной природе нервного возбуждения [2]. Исследования, проведенные Ходжки- ном, Катцем, Хаксли, Тасаки и другими учеными [3—6], раскрыли принципиальные механизмы генерации нервного импульса и его распространения (см. также [7—9]).
Нервное возбуждение распространяется по нервным волокнам— аксонам. Принято разделять нервную систему высших организмов на центральную и периферическую. Периферическая система содержит аксоны, служащие для передачи сигналов, а также ганглии вегетативной нервной системы. Аксоны являются коммуникациями для афферентных сообщений от органов чувств, направляемых в центральную систему, и для эфферентных сигналов, направляющихся от центральной системы к мышцам. Аксоны представляют собой отростки центрально расположенных клеток. Нервная система беспозвоночных имеет иное строение, но она также содержит коммуникационные аксоны.
Исследование генерации нервного импульса и его распространения в аксоне — старая и традиционная проблема биофизики/ Уже Гельмгольц измерял скорость распространения нервного возбуждения/В настоящее время решены важные физические задачи, относящиеся к функции аксона. Напротив, современное состояние науки позволяет лишь формально моделировать работу центральной нервной системы и мы еще далеки от понимания физической природы высших ее функций — памяти и мышления.
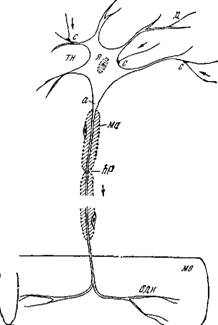
На рис. 4.1, заимствованном из [5], представлена схема строения нервной клетки, именуемой иначе нейроном. Нейрон полу
чает сообщения от многих других нейронов через их тонкие ответвления, образующие контакты — синапсы — с телом клетки и его короткими отростками — дендритами. Аксон имеет макроскопические протяженность и сечение. Длины аксонов в теле крупных животных достигают нескольких метров.\
Контакты с другими клетками образуются не только в синапсах.^ Боль - шая часть поверхности нейрона покрыта прилегающими к нему глиальными, или иіванновскими, клетками^ роль которых пока не выяснена. С другой стороны^из мембран шванновских клеток образуется миелиновая оболочка миелинизирован - ных аксонов, показанная ^схематически на рис. 4.1. ^Оболочка прерывается через каждые 1—2 мм длины аксона перехватами Ранвье, имеющими протяженность /Т около 1 мкм. В области перехватов мембрана аксона непосредственно контактирует с окружающей средойЛ^
Немиелинизированные во - ЛОКНа могут быть объеди - Рис. 4.1. Схема строения нервной клетки нены одной шванновской (двигательный нейрон).
К-ТТР. ТКПЙ чтп ППКЯ1ЯНП R гр - і тн~тел0 нейрона,1Ца — аксои1Смо — миелиновая клеткой, ЧТО UOKdJdHU В се ~ оболочка, перехват Ранвье^д-дендрит,
ЧЄНИИ на рис. 4.2. Погру - X*— ядро,^с —синапсыЛодн—окончание двига о г - г тельного нерва,\мв — мышечное волокно.
Женныи в шванНЬвскую 1
Клетку аксон создает глубокую инвагинацию мембраны шванновской клетки, причем образуется мезаксон — две шванновские мембраны, расположенные рядом^В правом нижнем углу схематически показана двойная мембрана, разделяющая цитоплазму шванновской клетки и цитоплазму аксона, аксоплазму [9].
Герен [10] установила, что миелиновая оболочка аксона образована многократным спиральным закручиванием мембраны шванновской клетки вокруг аксоиаГМиелин представляет собой, - т-а«им~ойразом,/многослойную (доЧїбО слоев) мембрану, строение которой наблюдается с помощью электронного микроскопа. Миелии защищает мембрану аксона от окружающей среды.
6 М. В. Волькеиштейн
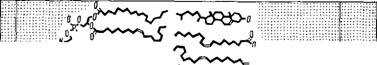
Структура миелина была детально изучена методом рентгенографии с разрешением 10 А [11]. Определены профили электронной плотности миелина седалищного нерва кролика и лягушки и миелина зрительного нерва кролика. На рнс. 4.3 показаны эти кривые для нервных волокон кролика и схема структуры миелина, соответствующая данным кривым. Миелин построен асимметрично, холестерин сосредоточен преимущественно на стороне
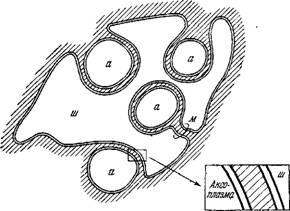
Рис. 4.2. Схема строения немиелинизированнного нервного волокна позвоночного.
А — аксон, м — мезаксон— шванновская клетка.
Миелина, соприкасающейся с мембраной аксона. Схема согласуется с липидным составом миелина млекопитающих, установленным ранее [12]. Белковые слои граничных областей миелина содержат йоду. Внутренняя область построена из гибких углевОдорОдных «хвостов» липидов.
/Уже давно установлено, что нервы и мышцы способны генерировать электродвижущие силы, биопотенциалы. Электрическая активность клеток проявляется в форме коротких разрядов, каждый из которых длится около 1 мс. Современная экспериментальная техника позволяет усиливать эти сигналы и регистрировать их с помощью осциллографа или другим путем. Установлено, что активность нерва всегда сопровождается электрическими явлениями — и при внешнем возбуждении и при посылке сигнала мозгом в соответствующем аксоне наблюдаются электрические импульсы. На рис. 4.4 показаны импульсы в зрительном нервном волокні краба Limulus, вызванные вспышкой света длительностью 1 с [13]. Частота и характер последовательности импульсов, имеющие несомненное информационное значе
ние, зависят от интенсивности и спектрального состава света [14, 15] (см. гл. 7) .1 Величина и длительность отдельного импульса не зависят отТгрироды и силы раздражения."
О 20 40А
-J 1 1 1 1
0 0 .::•:
![]()
»w0#0
^ V J 1 O^^-v^.p..
Г У. Го 0
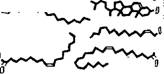
Внугрен^/7о/тярже=Стероид щ^Гибх/гя ^Стероид ^//плярная Внешний
Нийбеяоцт. группы^ +ягесткая цепь +жесткая белок
+еоЗа '— " цепь - цепь — —~ +вода углеводороды
Рис. 4.3. Схема миелиновой мембранной структуры.
Вверх* - профили электронной плотности для глазного (пунктир) н седалищного (сплошная
Лнння) нервов кролика.
Электрический сигнал, отвечающий отдельному импульсу, распространяющемуся вдоль аксона, называется потенциалом действия или спайком. Это — основная единица информации, передаваемой по нервному волокну.

Скорость распространения импульса по аксону равна по порядку величины 1—100 м/с, она меньше для немиелинизиро - ванных и больше для миелинизированных аксонов.


Рис. 4.4. Импульсы в зрительном нервном волокне Limulus, вызванные вспышкой света длительностью I с.
Цифры справа указывают относительную интенсивность вспышки. Период освещения указан разрывом верхней белой линии, отметка времени на нижней белой линии 0,2 с.
В табл. 4.1 [3] приведены некоторые данные. Проведение нервного возбуждения есть проведение электрического импульса. Несмотря на то, что аксоплазма представляет
Таблица 4.1
Скорость проведения возбуждения в нервном н мышечном волокнах
|
Волокно |
Температура, °С |
Диаметр волокна мкм |
Скорость проведения, м/с |
|
Миелинизированные нервные волок |
38 |
2-20 |
10-100 |
|
На кошки |
|||
|
Немиелинизированные нервные во |
38 |
0,3-1,3 |
0,7—2,3 |
|
Локна кошки |
|||
|
Миелинизированные нервные волок |
20 |
3-16 |
6-32 |
|
На лягушки |
35 |
||
|
Миелинизированные нервные во |
20 |
20 |
|
|
Локна креветки |
|||
|
Немиелинизированные нервные во |
20 |
30 |
5 |
|
Локна краба |
|||
|
Гигантский аксон кальмара (немие- |
20 |
500 |
Около 25 |
|
Линизированное волокно) |
|||
|
Мышечное волокно лягушки |
20 |
60 |
1,6 |
') Для миелинизированных волокон указаны значения наружного диа^ метра миелиновой оболочки.
Собой раствор электролитов, никоим образом нельзя считать, что ионный ток в ней определяет распространение импульса. ("Удельное сопротивление аксоплазмы равно по порядку величины 10—100 Ом-см. Следовательно, сопротивление на единицу длины волокна диаметром 1 мкм составляет 109—Ю10Ом-см, т. е. превышает сопротивление медного провода того же диаметра в 108 раз. В таком проводнике очень велики потери и утечки. Между тем аксон передает первичный импульс на расстояния свыше метра б^а-затухания. и без иска^кения.^.
В нейрофизиологии и в биофизике нервнЪ'го""возбуждения сыграло большую роль развитие методов работы на изолированных аксонах, техники введения микроэлектродов в аксон и метода перфузии, т. е. выдавливания аксоплазмы из волокна и ее замены искусственными растворамиДОсобенно удобна работа на гигантских аксонах кальмара, имеющих диаметр до 0,5 мм (см. табл. 4.1 ^Элементарный опыт состоит во введении в аксон двух микроэлектродов: первый служит для электрической стимуляции возбуждения, второй-^- для измерения генерируемого потенциала (рис. 4.5) [4]./Опыт показывает, что ""величина и временной ход токов действия совершенно не зависят от величины стимулирующего тока и что потенциал действия не возникает, если электрический стимул не достигает некоторого порогового потенциала. Тем самым, нервное волокно
Гл. 4. нервный импульс
Подчиняется закону «все или ничего». Иными словами, потенциал действия постоянной величины либо возникает, либо не возникает вовсе.
Для возбуждения аксона необходимо некоторое минимальное количество электричества.,' Соответственно по мере уменьшения
Раздражение Осцилмерар
ЕЖЖ^,..»,, ,
Аксон
Рис. 4.5. Схема исследования нервного импульса при помощи двух микроэлектродов.
Длительности At подаваемого импульса необходимо увеличивать силу тока / — эти две величины обратно пропорциональны. Для длительных прямоугольных импульсов существует минимальная
Сила тока, достаточная для возбуждения; более слабый ток неэффективен при любой длительности.
Fta рис. 3/S показана кривая зависимости силы порогового тока от длительности импульса. Кривая имеет гиперболическую форму. Было предложено описывать ее эмпирической формулой
/п = а/At - f b,
Где Іп— пороговый ток, At— длительность импульса, b — так называемая реобаза — минимальное значение возбуждающего тока при At-> оо. При очень коротких импульсах, т. е. при At—>-0 /п = а/At, т. е. произведение IaAt есть константа, характеризующая пороговое значение количества электричества при коротких импульсах. Из приведенной формулы следует, что при /п = 2b получим А^хр = а/Ь. В действительности, однако, оказалось, что при At = ajb /п~1,4Ь и простая эмпирическая формула несправедлива во всем интервале значений A^.j
166
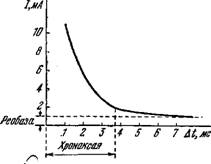
Рисі 4.6. Зависимость силы порогового тока от длительности импульса.
Если сообщить волокну два последовательных стимула, разделенных некоторым интервалом времени, то возникающая ситуация зависит от этого интервала. Немедленно после генерации импульса данное место волокна находится в абсолютном
Рефрактерном состоянии, т. е. не может быть возбуждено вновь. Затем следует относительное рефрактерное состояние. В таком состоянии заметно увеличено значение порогового потенциала и может возникнуть лишь медленно распространяющийся импульс. Продолжительность всего рефрактерного состояния варьирует от одной до нескольких миллисекунд.
В состоянии покоя аксоплазма имеет отрицательный заряд по отношению к внешней среде, характеризуемый потенциалом покоя около 80 мВ. Пороговое возбуждение при этом имеет потенциал, примерно равный —50 мВ, а потенциал действия при надпороговом возбуждении равен потенциалу противоположного знака, составляющему около 40 мВ. Это изображено схематически на рис. 4.7 [4].
Прохождение импульса определяется изменением состояния мембраны аксона при ее стимуляции. Как уже говорилось, в состоянии покоя клеточной мембраны в результате активного транспорта ионов концентрация ионов К+ в цитоплазме (аксо - плазме) значительно превосходит их концентрацию во внешней среде, а для ионов Na+ ситуация противоположна^ В табл. 4.2 [3] приведен состав аксоплазми аксонов Loligo и состав плазмы крови, характерный для внешней среды, и близкий к нему состав морской воды.
Таблица 4.2 Концентрация нонов н других веществ в аксонах Loligo
Концентрация, ммоль на 1 кг НаО
|
Вещество |
Морская |
||
|
Аксоплазма |
Кровь |
Вода |
|
|
К+ |
400 |
20 |
10 |
|
Na+ |
50 |
440 |
460 |
|
Сг |
40—150 |
560 |
540 |
|
Са++ |
0,4 |
10 |
10 |
|
Mg++ |
10 |
54 |
53 |
|
Изэтионовая кислота |
250 |
— |
— |
|
Аспарагнновая кислота |
75 |
— |
— |
|
Глутаминовая кислота |
12 |
— |
— |
|
Янтарная н фумаровая кислоты |
17 |
— |
— |
|
Ортофосфат |
2,5-9 |
— |
— |
|
АТФ |
0,7—1,7 |
— |
— |
|
Аргннннфосфат |
1,8-5,7 865 г/кг |
— |
— |
|
Вода |
870 г/кг |
966 г/кг |
При наложении на мембрану стимулирующего потенциала вначале увеличивается ее проницаемость для ионов Na+, в состоянии покоя значительно меньшая проницаемости для ионов К+. Ионы Na+ входят в аксон, в результате чего внутренняя поверхность мембраны изменяет знак своего заряда с отрицательного на положительный. Иными словами, происходит деполяризация мембраныЛЕсли воспользоваться для выражения разности потенциалов на двух сторонах мембраны аксона формулой (3.105)
+ + (4.1)
^ РКСК + PNacNa + РС1сС\ '
То состояние покоя мембраны характеризуется следующим отношением ионных проницаемостей:
Рк ■ ^Na •' Реї = 1 : 0,04:0,45.
В состоянии возбуждения, отвечающем генерации потенциала действия, имеем
Рк: Pnа: Ра = 1 :20: 0,45.
Подчеркнем, что истолкование возбуждения как результата изменения ионных проницаемостей является феноменологическим и не раскрывает молекулярный механизм процесса.
Наружная среда
![]()
Активный участок
+ + + - - - - + + + + +
Импульс Э-
Электрические токи, возникающие при деполяризации мембраны аксона.
При деполяризации мембраны возникают токи, замыкающиеся через наружную проводящую среду (рис. 4.8) [5]. Они возбуждают следующий участок аксона.
Таким образом, согласно мембранной теории при генерации импульса в мембране аксона открывается некий «канал», сквозь который ионы Na+ проникают внутрь аксона, вызывая деполяризацию мембраны. Во время генерации импульса натриевый канал закрывается и открывается калиевый канал. Ионы К+ выходят наружу, что приводит к восстановлению нормального отрицательного заряда на внутренней стороне мембраны. Происходит реполяризация мембраны. После прохождения рефрактерного периода мембрана приобретает способность передавать новый импульс (рис. 4.9) (4].
+40 О
-за
3
Оотенциол действия
Птещиал пот
+ к - - у + + + + + + + + + + + +
Їфі TtII 'МрЖ. 111111
+ T —+ + + + + + + + + + + ®
+40
![]()
О
+ + + + + + + + І " + + + + + + + + + + + + + + ї—+ + + + + +
+40 О
-ВО
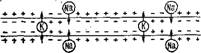
Рис. 4.9. Распространение нервного импульса сопровождается изменениями нонной проницаемости мембранного аксона.
Наружный раствор
/ / і ±
А/гсоплаэма
\
Рнс. 4.10. Эквивалентная схема элемента возбудимой мембраны аксона.
Как видно из рис. 4.8, суммарный продольный ток через сечение аксона и окружающую среду равен нулю — в любом месте внутренние токи равны по силе и противоположны по направлению. Но плотность продольного тока и продольная разность потенциалов между двумя точками внутри аксона иные, чем снаружи.
Мембрана аксона имеет сопротивление 1000 Ом-см2, ее емкость равна 1 мкФ/см2, что соответствует бимолекулярному липидному слою толщиной 50 А с диэлектрической проницаемостью е=5 и удельным сопротивлением 2-Ю9 Ом-см. Во время генерации импульса проводимость мембраны увеличивается примерно в 1000 раз. Можно моделировать электрические свойства мембраны эквивалентной схемой, показанной на рис. 4.10 [3]. Рисунок изображает лишь один элемент мембраны, и следует представить себе длинную линейную последовательность таких элементов, моделирующих непрерывный кабель. Сопротивление R характеризует аксоплазму, наружный раствор имеется в большом избытке и изображается проводником без сопротивления. Натриевая и калиевая «батареи» и S'k,
Определяют генерацию импульса, добавочная «батарея» Sy ответственна за движение других ионов, не изменяющееся при возбуждении.
Таким образом, распространение импульса представляет собой самоподдерживающийся процесс, подобный горению бикфордова шнура. Очевидно, что процесс этот сводится к превращению химической энергии в электрическую.
Как уже сказано, распространение импульса в миелинизированном волокне происходит быстрее, чем в немиелинизированном. Доказано, что в миелинизированном аксоне проведение импульса является сальтаторным, т. е. происходит путем перескока импульса от одного перехвата Ранвье к другому. Калиевые и натриевые каналы открываются и закрываются только в перехватах Ранвье — миелинизированные участки хорошо изолированы. Миелин имеет малую емкость, чем и объясняется большая скорость проведения импульса. Схема сальтаторного проведения импульса показана на рис. 4.11. ^
![]()
РирГ 4.Т7Т^ Схема сальтаторного проведения импульса. пР—перехват Ранвье, л —миелин, а — аксо-
Прямые доказательства сальтаторной їеории, впервые предложенной Лилли [16], были получены в работах Кубо, Оно и Юге (см. [17]). В одиночном нервно-мышечном препарате, погруженном в раствор Рингера, пороговая величина стиму
лирующего тока зависит от расстояния между стимулирующим микрозлектродом и перехватом Ранвье. Она имеет наименьшее значение, если микрозлектрод помещен непосредственно в перехвате. Количественная теория этого эффекта была развита Та - саки (см. [6]).
Обозначим потенциалы трех последовательных перехватов — 1, 0 и 1 буквами ifi_i, if)0 и ij)j. Если миелин представляет собой идеальный изолятор, то ток, протекающий внутри аксона от 1 к 0, пропорционален if>i— if>o, от 0 к —1 — пропорционален ■ф-i — if>o. Через перехват 0 идет ток І, пропорциональный (грі — ij)0) - f (\j)_i — %,). Имеем
' = І{(+-,-*о) + (+,-+о)}. (4.2)
Где R — сопротивление между двумя соседними перехватами (оно равно примерно 20 МОм).
Расстояния между микроэлектродом и перехватами 0, 1 и —1 равны Хо, Х\, х-\. Разность потенциалов, создаваемая микроэлектродом, дающим ток I, равна
Где р — удельное сопротивление среды (для раствора Рингера оно равно 100 Ом-см). Из (4.2) и (4.3) получаем
TOC \o "1-3" \h \z i = Ч (4-4)
4яR \ х0 х\ х-1 ) 4 '
И если микроэлектрод очень близок к перехвату 0, т. е. Хи Х-1 » *0, то
= (4-5)
В опытах варьировалось расстояние х0 и при каждом значении Хо определялась величина /, отвечающая критическому значению і — іс. Опытные данные действительно согласуются с линейной зависимостью I от х0
І= — Ісх0. (4.6)
Установлено, что факторы, блокирующие распространение импульса (кокаин, уретан, ультрафиолетовое облучение), действуют именно на перехваты Ранвье, но не на участки между ними.
Прямые и строгие доказательства сальтаторной теории получены в работах Тасаки и его сотрудников [6, 18, 19]. Основной опыт ставился на одиночном волокне, лежащем в трех каплях раствора Рингера, разделенных двумя воздушными промежутками, расстояние между которыми равнялось приблизительно 1 мм (рис. 4.12) [3]. В первом опыте (рис. 4.12, а) в средней капле находилась только миелинизированная часть аксона, во втором (рис. 4.12,6)—в средней капле находился перехват Ранвье. Измерялся радиальный ток. Через сопротивление R проходит ток, равный il2— г23, где i\2— ток, текущий в наружной цепи от капли 1 к капле 2, і23— от капли 2 к капле 3. Эта разность равна току, входящему в волокно из капли 2.

1ме 1ма
Рис. 4.12. Мембранный ток:
А—через участок аксона, расположенный между перехватами Раивье, б —через перехват Ранвье. Отклонение осциллограммы вверх соответствует выходящему току.
В первом опыте радиальный ток направлен наружу, что объясняется пассивным разрядом миелинизированного участка через перехват. Правый перехват разряжается позже левого, соответственно на осциллограмме видны два пика. Во втором опыте первая фаза тока направлена наружу, что означает пассивную деполяризацию перехвата. Во второй фазе ток направлен внутрь — перехват Ранвье находится в активном состоянии. Эти опыты однозначно подтверждают теорию (дальнейшие подробности см. в [3, 6, 18, 19]).
Мембранная теория в целом непосредственно подтверждается опытами с перфузией аксонов. Оказалось возможным выдавить аксоплазму из гигантского аксона Loligo без повреждения мембраны и заменить аксоплазму искусственными растворами (см. [3, 6, 20—22]). Перфузированные аксоны способны проводить до 105—106 импульсов в течение нескольких часов.
Потенциал покоя исчезает при равенстве наружной и внутренней концентраций калия. При замене в аксоплазме КС1 на NaCl потенциал покоя падает до нуля. В то же время потенциал покоя малочувствителен к концентрациям К+, меньшим 20 мМ (см. также § 3.6). Перфузионные опыты показывают, что потенциал покоя действительно регулируется ионами калия.
При указанной замене К. С1 на NaCl и значительном увеличении концентрации К (до 600 мМ) создается положение, обратное нормальному, и внутренняя часть волокна заряжается положительно, а не отрицательно по отношению к наружной среде. И в самом деле, при заполнении волокна, погруженного в изотонический раствор КС1, таким же раствором NaCl внутренний раствор заряжен положительно по отношению к наружному и <р составляет 50—60 мВ.
Прямые опыты с мечеными атомами показывают, что проведение импульса связано с возрастанием скорости движения калия и натрия по градиентам концентрации. В гигантском аксоне каракатицы Sepia при каждом импульсе наблюдается входящий поток Na+, равный 10,3-Ю-12 моль/см2, и выходящий поток 6,6-Ю-12 моль/см2. Чистый вход Na+ 3,7-Ю-12 моль/см2 за импульс примерно равен выходу К+. Действительно, для изменения напряжения конденсатора емкостью 1 мкФ на 120 мВ нужен заряд 0,12-Ю-6 Кл, что эквивалентно 1,3-Ю-12 моль/см2 одновалентного катиона. Таким образом, измеренный вход Na+ более чем достаточен для возникновения потенциала действия.
За один импульс в немиелинизированном аксоне через 1 мкм2 поверхности проходит около 20 000 ионов Na+. В миелинизиро - ванном аксоне за один импульс через каждый перехват Ранвье входит 6-Ю6 ионов Na+. Площадь мембраны в перехвате примерно равна 20 мкм2, следовательно, через 1 мкм2 проходит 300 000 ионов Na+. Плотность ионного тока в перехвате примерно в 10 раз больше, чем в немиелинизированных гигантских аксонах.
Мембранная теория встречается, однако, с трудностями при попытках объяснить тепловые явления в нерве. Согласно мембранной теории генерация импульса происходит за счет свободной энергии, определяемой градиентом концентрации ионов Na+. Если перенос ионов адиабатичен, то система, совершая электрическую работу, должна охлаждаться. Однако оказалось, что во время генерации импульса сначала происходит нагревание нерва, за которым следует охлаждение [23]. Аналогичное явление наблюдается при разряде электрического органа угря на внешнее сопротивление [24]. Эти тепловые явления до сих пор не объяснены. Несомненно, что мембрана аксона представляет собой диссипативную систему, и можно думать, что к рассмотрению генерации нервного импульса применима неравновесная термодинамика. Соответствующая теория еще не построена, она должна описать и теплопродукцию нерва. Подлинное объяснение этих явлений требует, однако, раскрытия их молекулярных механизмов.
В заключение приведем электрические характеристики мие- линизированного нервного волокна лягушки (табл. 4.3) [3].
Таблица 4.3
Электрические характеристики аксона
|
Диаметр волокна |
14 мкм |
|
Толщина миелиновой оболочки |
2 мкм |
|
Расстояние между перехватами Ранвье |
2 мм |
|
Площадь мембраны в перехвате Ранвье |
22 мкм2 |
|
Сопротивление на единицу длины осевого ци |
140 МОм/см |
|
Линдра |
110 Ом • см |
|
Удельное сопротивление аксоплазми |
|
|
Емкость на единицу длины миелиновой оболочки |
10—16 пФ/см |
|
Емкость на едниицу площади миелиновой обо |
0,0025—0,005 мкФ/см2 |
|
Лочки |
|
|
Диэлектрическая проницаемость миелиновой обо |
5-10 |
|
Лочки |
|
|
Удельное сопротивление миелиновой оболочки |
500—800 МОм/см |
|
Емкость перехвата Ранвье |
0,6-1,5 пФ |
|
Емкость на единицу площади перехвата Ранвье |
3—7 мкФ/см2 |
|
Сопротивление перехвата Ранвье в покое |
40—80 МОм |
|
Сопротивление, умноженное на единицу площади |
10-20 Ом-см2 |
|
Мембраны в перехвате Ранвье |
|
|
Потенциал действия |
116 мВ |
|
Потенциал покоя |
71 мВ |
|
Максимальная плотность входящего тока |
20 мА/см2 |
|
Скорость проведения |
23 м/с |