ОКСИМЕТИ Л ФЕНОЛЫ (МЕТИ ЛОЛ ФЕНОЛЫ, ФЕНОЛОСПИРТЫ)
Оксиметилфенолы образуются на первой стадии взаимодействия фенола с формальдегидом в щелочной среде (водно-щелочной раствор, 15—50 °С, pH = 9). Реакция протекает ступенчато (может длиться от нескольких минут до нескольких суток) с образованием смеси различных моно-, ди - и триоксиметилфенолов в соотношениях, зависящих от условий реакции. Синтез индивидуальных оксиметилфенолов осложняется некоторой разницей в реакционных способностях орто - и тга/?а-положений.
При нейтрализации раствора часть оксиметилфенолов может выпадать в виде кристаллов, основная же часть находится в растворе вместе с непрореагировавшими фенолом и формальдегидом. Образовавшиеся продукты в дальнейшем могут реагировать с фенолом с получением диоксидифенилметана. Устанавливаемое равновесие между исходными веществами и оксиметилфенолами зависит от pH среды. Образование оксиметилфенолов (фенолоспиртов) в кислых средах (1 моль фенола, 0,86 молей формальдегида, 0,66 г щавелевой кислоты) было доказано с помощью бумажной хроматографии. Считают, что процесс присоединения формальдегида к фенолу аналогичен образованию альдоля. Скорость суммарной реакции образования оксиметилфенолов при конденсации с формальдегидом была определена Фримэном [3].
Константа ско - Энергия рости к • 105/число активации, реакционноспособ - ккал/моль - ных положений
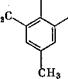
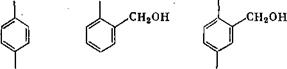
Метилольные группы могут занимать все свободные положения в мёлекуле фенола, кроме мета-положения, что приводит к возникновению следующих соединений^
|
ОН |
![]()
|
ОН |
![]()
|
ОН |
![]()
|
СН2ОН |
![]()
|
СН2ОН |
![]()
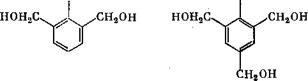
|
4-оксиметил - , фенол |
![]()
|
ОН |
![]()
|
2-оксиметил- Фенол |
![]()
|
2,4~бис(окси- Метил)фенол Он |
![]()
|
2,6-бис(окси- Метил)фенол |
![]()
|
2,4,6-трис(окси- Метил)фенол |
![]() При соотношении фенола и формальдегида 1 : 1,4 в щелочной среде образуется реакционная смесь, состоящая из 5—10% свободного фенола, 10—15% 2-оксиметилфенола, 35—40% 4-окси - метилфенола, 30—35% 2,4-бис(оксиметил)фенола и 4—8% 2,4,6- трис(оксиметил)фенола [6].
При соотношении фенола и формальдегида 1 : 1,4 в щелочной среде образуется реакционная смесь, состоящая из 5—10% свободного фенола, 10—15% 2-оксиметилфенола, 35—40% 4-окси - метилфенола, 30—35% 2,4-бис(оксиметил)фенола и 4—8% 2,4,6- трис(оксиметил)фенола [6].
В водно-щелочном растворе при 65 °С фенол присоединяет
3 моля формальдегида, при этом образуются соли 2,4,6-трис(окси - метил)фенола [7]. Заметные количества трис-соединений [8] образуются уже при использовании 1 моля формальдегида на 1 моль
Фенола. Эти соединения наряду со свободным фенолом содержатся в технических резолах [9].
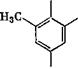
Крезолы в щелочной среде взаимодействуют с формальдегидом аналогично фенолу с образованием следующих соединений:
|
СН2ОН |
![]()
|
СН2ОН |
![]()
|
Б-метил-2,4-бис(окси- метил)фенол |
![]()
 ОН ОН
ОН ОН
|
|
|
НОН |
|
СН2ОН |
|
4-метил-2,6-бис(окси- Метил)фенол |
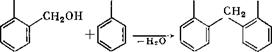
В щелочных средах из п-крезола образуются 4-метил-2,6- бис(оксиметил)фенол и 4-метил-2-оксиметилфенол (температура плавления 105 °С). Сравнительно легко образуется четырех - замещенный /г, п'-диоксидифенилметантетраокриметил. Указанные соединения использовались при изучении реакции поликонденсации, а некоторые из нй$к применяются при вулканизации каучука [12].
|
-н*о |
![]()
|
-н*о |
![]()
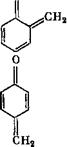
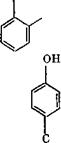 Метилольные группы оксиметилфенолов, находящиеся в орто - или тга/?а-положениях, благодаря поляризующему действию кислородного атома гидроксилов, обладают большей реакционной способностью, чем ОН-группы ароматических спиртов. Поляризующее действие кислородного атома монкет вызвать внутримолекулярное отщепление воды с образованием хинонметидов: ОН О
Метилольные группы оксиметилфенолов, находящиеся в орто - или тга/?а-положениях, благодаря поляризующему действию кислородного атома гидроксилов, обладают большей реакционной способностью, чем ОН-группы ароматических спиртов. Поляризующее действие кислородного атома монкет вызвать внутримолекулярное отщепление воды с образованием хинонметидов: ОН О
СН2ОН
Н2ОН
Хултч отводит хинонметидам ведущую роль в химизме получения фенольных смол.
При взаимодействии оксиметилфенолов друг с другом возникают диметилэфирные связи. Реакция сопровождается внутримолекулярным отщеплением воды с образованием диоксидибен- зилового эфира:
ОН ОН ОН ОН
При взаимодействии оксиметилфенолов с фенолом возникают метиленовые мостики:
|
ОН ОН ОН ОН
|
Этерификацию оксиметильных групп следует рассматривать как электрофильное замещение иона реакционноспособного окси - бензилкарбония на кислотный анион. Она протекает гораздо легче этерификации алифатических спиртов минеральными кислотами, так что достаточно простого перемешивания оксиметил - фейолов в водном растворе НС1.
Для синтеза некоторых низкомолекулярных продуктов фор - конденсации и для выявления структуры фенольных смол использовали галогенпроизводные. С их участием проводили поликонденсацию фенола с формальдегидом в кислых средах.
Этерификация оксиметилфенолов спиртами протекает относительно легко. При обработке оксиметилфенолов меркаптанами получают тиоэфиры [14].
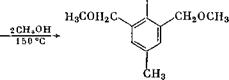
Этерификация может проводиться и в нейтральной среде. Так, при обработке 4-метил-2,6-диоксиметилфенола метиловым спиртом при 150 °С получают соответствующий диметиловый эфир [15]:
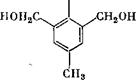 ОН ОН
ОН ОН
|
|
Практически количественно проходит метоксиметилирование пространственно затрудненного 2,6-ди-треяг-бутилфенола смесью формальдегида, метилового спирта и Г^аОН при 35—75 °С до получения соответствующих эфиров [16].