КАК РАЗМЕЩЕНЫ ЗАРЯДЫ В АТОМАХ
|
И |
Так, в любом атоме, а значит, и в любой молекуле должны быть мельчайшие электрические частицы. Но почему же окружающие нас тела далеко не всегда обнаруживают свой заряд? Это можно объяснить очень просто. Электрические заряды атомов не дают о себе знать потому, что положительный заряд в атоме в точности равен отрицательному, и действия обоих зарядов уже на небольшом расстоянии от атома взаимно погашаются — заряды нейтрализуют друг друга. Однако в некоторых случаях, например при растворении, при нагревании, атомы могут терять или присоединять одну или несколько электрических частиц и превращаться в заряженные осколки — ионы.
Теперь постараемся выяснить, какие электрические частицы может терять или приобретать атом - положительные или отрицательные. Чтобы решить этот вопрос, мы должны узнать, как расположены заряды в атоме, как построен сам атом.
В первом разделе нашей книжки мы уже решали задачу о распределении зарядов, спрятанных в картонной коробке. Такая же по существу задача стоит перед нами и сейчас. Разница только в масштабах. Атомы имеют размеры в несколько стомиллионных долей сантиметра. Значит, и внутриатомные заряды, помещены друг от друга на расстоянии не в один сантиметр, как в коробочке, изображённой на рисунке 2, а в сто миллионов раз ближе. Примерно на такое расстояние и нужно «подобраться» к атому с пробным зарядом. Да и сам пробный заряд должен быть не тяжелее атома, иначе он будет слишком груб — его не сдвинут электрические силы атома. Сделать такой заряд не по силам человеческому искусству, но, по счастью, на помощь здесь пришла сама природа. Пробные заряды доставили нам радиоактивные вещества. Испускаемые этими веществами альфа-частицы оказались вполне подходящими для «прощупывания» внутриатомных зарядов. Альфа-частицы достаточно малы и легки. Скорости их огромны: встречаются альфа-частицы, летящие со скоростью 20 ООО километров в секунду. Альфа-ча - стицы имеют положительный электрический заряд. Таким образом, они вполне подходят для исследования строения атома.
Но как провести опыт? Увидеть отдельные атомы и альфа-частицы нельзя даже в самый сильный микроскоп. А ведь мы должны заглянуть внутрь атома и по поведению альфа-частиц узнать, как расположены в атоме заряды.
Прежде всего надо было найти способ, как следить за путями альфа-частиц. Это сделать удалось. Есть вещество — сернистый цинк, — которое обладает интересным свойством: если на него надает альфа-частица, оно светится — даёт кратковременную вспышку. По вспышке можно узнать, куда попала вылетевшая из крупицы радиоактивного вещества альфа-частица, а зная это место, можно, очевидно, сообразить, по какому пути она летела, хотя в полёте и оставалась невидимой.
|
|
|
С |
|
Рис. 4. |
Затем следовало отыскать подходящую для альфа-ча - стицы мишень. Такой мишенью послужил очень тонкий, толщиной в тысячную долю миллиметра, листок металла.
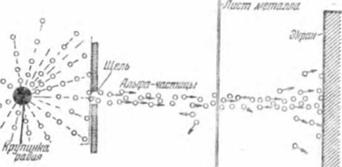
Установка для опыта была собрана так, как схематически показано на рис. 4. Большая чёрная точка слева — крупица радиоактивного элемента радия. Из неё по всем направлениям непрерывным потоком вылетают альфа - частицы. Щель, прорезанная в толстой металлической пластинке, пропускает узкий «луч» альфа-частиц. Он падает на мишень — тонкий листок металла. А за листком поставлен экран, покрытый сернистым цинком.
И вот оказывается, что тонкий листок металла — не препятствие для несущихся с огромной скоростью альфа - частиц. Они пронизывают листок насквозь и, падая на середину экрана, дают яркое свечение. Это навело ученых на мысль, что атом вовсе не является сплошной частицей вещества, а состоит из отдельных частей, разделённых пустым пространством, через которое альфа-частицы могут свободно пролетать.
Но некоторые альфа-частицы ведут себя иначе. Они отклоняются от прямого пути. Это видно из того, что в других местах экрана тоже вспыхивают и гаснут отдельные искорки — следы ударов альфа-частиц, изменивших своё направление. Большинство частиц лишь немного меняет направление своего полёта, но есть и такие, которые отклоняются сильно, а некоторые отскакивают назад. Как это объяснить?
Альфа-частица заряжена положительно. Значит, отклонить её может только некоторый положительный заряд в атоме, или, точнее, положительно заряженная часть атома, более тяжёлая, чем сама альфа-частица. Эту часть атома называют ядром. Если альфа-частица налетает прямо на ядро, «лобовым ударом», то она может быть отброшена назад. Поскольку таких частиц в нашем опыте мало, мы делаем заключение, что попадание в ядро — редкий случай. А это свидетельствует о том, что размеры ядра очень малы.
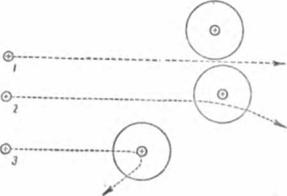
Теперь картина прохождения альфа-частиц через металлический листок ясна: частицы, не испытавшие отклонения от прямолинейного пути, прошли вдали от атомных ядер. Частицы, отклонившиеся в сторону, прошли на небольших расстояниях от ядер, и очень немного частиц попало прямо в ядро и было отброшено назад.
Таким образом, опыт с обстрелом атома альфа-частицами доказывает нам, что положительные заряды атома сосредоточены в маленьком тяжёлом ядре. А отрицательные? Они не дают о себе знать в этом опыте. Они совершенно не действуют на альфа-частицу, не могут притянуть её к себе. И нам остаётся заключить, что отрицательные заряды в виде лёгких мельчайших частиц распределены вокруг ядра. Эти мельчайшие частицы отрицательного электричества и были названы электронами.
Как же теперь мы должны представлять себе строение атома? — В центре атома находится ядро. В нём заклю-1 чены все положительные заряды атома и почти вся его масса (рис. 5). А вокруг ядра располагаются электроны.
Электроны составляют оболочку атома, легко проницаемую для альфа-частиц. Исходя из этого, мы можем предположить, что именно электроны, как более лёгкие и поэтому более подвижные, слабее связаны с атомом и могут переходить от одного атома к другому.
|
Рис. 5. Альфа-частицы встречают на своём пути атомы металла. Цифрами 7, 2 и 3 обозначены альфа-частицы; большие кружки —атомы, в центре их — положительно заряженные ядра. |
Опыты это полностью подтвердили. Оказалось, что многие атомы, например атомы металлов, легко теряют часть своих электронов. Это происходит и при нагревании, и при освещении, и при действии тех же альфа-ча - стиц. Другие же атомы, наоборот, более склонны присоединять к своей оболочке лишние электроны. Как отрыв, так и присоединение электронов к атому называют ионизацией (потому что атом при этом превращается в ион).
Теперь мы можем ответить и на вопрос о том, как из молекулы соляной кислоты при растворении получаются положительный ион водорода и отрицательный ион хлора. Атом водорода отдаёт электрон атому хлора, и в результате в оболочке атома хлора оказывается избыток отрицательных зарядов (по. сравнению с количеством положительных зарядов в ядре), а водородный атом становится положительно заряженным ионом. Так как водородный атом отдал только один электрон, а атом хлора получил этот электрон, то очевидно, что заряды полученных ионов равны заряду электрона.